कार्बन तथा इसके यौगिक | Class 10Th Chemistry Chapter – 4 Notes | Model Question Paper | कार्बन तथा इसके यौगिक Solutions
कार्बन तथा इसके यौगिक | Class 10Th Chemistry Chapter – 4 Notes | Model Question Paper | कार्बन तथा इसके यौगिक Solutions
कार्बन तथा इसके यौगिक (Carbon and Compound)
स्मरणीय तथ्य : एक दृष्टिकोण
(MEMORABLE FACTS : AT A GLANCE)
- पृथ्वी पर कार्बन 0.02% पाया जाता है।
- वायु में कार्बन डाइऑक्साइड के रूप में कार्बन 0.03% पाया जाता है।
- कार्बन हीरे, ग्रेफाइट तथा कोयला में मुक्त अवस्था में पाया जाता है।
- कार्बन संयोजित अवस्था में कार्बोनेट खनिजों में पाया जाता है।
- कार्बन सभी सजीवों के निर्माण में आवश्यक अवयव होता है।
- पुराने समय में सजीव स्रोत (वनस्पति-जगत व प्राणी जगत) से प्राप्त यौगिकों को कार्बनिक यौगिक कहा जाता था । उदाहरण के लिये चीनी (ईख से), सिट्रिक अम्ल (नींबू से), ऐसीटिक अम्ल (सिरका से), तेल व वसा (चर्बी से) तथा यूरिया (पेशाब से) इत्यादि
- कार्बनिक यौगिक का हमारे दैनिक जीवन में अत्यधिक महत्व है।
- सुबह से शाम तक हम जिन वस्तुओं का प्रयोग करते हैं, वे सभी कार्बनिक यौगिक के बने होते हैं।
- हमारे भोजन (कार्बोहाइड्रेट, प्रोटीन, वसा, विटामिन), कपड़ा, कागज, चमड़ा, साबुन, रंग, प्लास्टिक की वस्तुएँ बच्चों के खिलौने इत्यादि कार्बनिक यौगिक के बने होते हैं।
- कृत्रिम वस्त्र जैसे – रेयॉन, नाइलॉन, डेक्रॉन, टेरीलीन इत्यादि को बनाने में कार्बनिक यौगिकों का उपयोग किया जाता है।
- कार्बन के परमाण सहसंयोजक बंधन द्वारा आपस में संयोग करके श्रृंखला बनाने की प्रवृत्ति रखते हैं। कार्बन में उपस्थित इस प्रवृत्ति को कार्बन का श्रृंखलन गुण (Catenation Property) कहते हैं।
- कार्बनिक यौगिक का उपयोग कीटाणुनाशक जैसे—DDT, गैमेक्सीन इत्यादि के रूप में भी किया जाता है।
- रोगों से मुक्त होने के लिये कार्बनिक यौगिकों का व्यवहार दवा के रूप में भी किया जाता है। उदाहरण के तौर पर सल्फा ड्रग्स, पेनीसिलीन, क्लोरोमाइसेटीन, टेरामाइसीन, ऐस्पिरीन इत्यादि ।
- कार्बनिक विस्फोटक जैसे, डाइनामाइट, ट्राइनाइट्रोटॉलूईन (TNT), ट्राइनाइट्रोट्रबेंजीन (TNB) इत्यादि का प्रयोग युद्ध काल से होता आ रहा है।
- हर सभी सजीव कार्बनिक यौगिकों से घिरे हुये हैं। अगर इस धरती से कार्बन और उसके यौगिक हटा दिये जायें तो पृथ्वी भी चन्द्रमा की तरह जीवविहीन हो जायेगी।
- बर्जीलियस (Berzelius) ने 1815 में “जीवन शक्ति का सिद्धान्त ” दिया जिसके अनुसार सजीव पदार्थों में कार्बनिक यौगिकों का निर्माण एक अदृश्य जीवन शक्ति (Vital Force) द्वारा होता है।
- जीवन शक्ति के सिद्धान्त का अन्त वोहलर (Wohlar) ने किया।
- अबतक करीब 10 लाख से अधिक कार्बनिक यौगिक प्रयोगशाला में बनाये जा चुके हैं।
- लगभग सभी कार्बनिक यौगिक कार्बन और हाइड्रोजन के बने होते हैं। अत: कार्बनिक रसायन वस्तुत: हाइड्रोकार्बन और उनके व्युत्पन्नों का रसायन है।
- जब दो परमाणु अपने बाह्यतम कक्षा के इलेक्ट्रॉनों का आपस में साझा करके संयोग करते हैं तब उनके बीच स्थित बंधन को सहसंयोजक बंधन कहते हैं तथा इस प्रकार से निर्मित यौगिक सहसंयोजक यौगिक कहलाते हैं।
- क्लोरीन की परमाणु संख्या 17 है और इसका इलेक्ट्रॉनिक विन्यास 2,8, 7 होता है।
- ऑक्सीजन परमाणु की बाह्यतम कक्षा में 6 इलेक्ट्रॉन होते हैं।
- ऑक्सीजन के दो परमाणु अपना अष्टक पूरा करने के लिए दो-दो इलेक्ट्रॉन का परस्पर साझा करते हैं जिससे उन दोनों परमाणुओं की बाह्यतम कक्षाओं में आठ-आठ इलेक्ट्रॉन हो जाने से स्थायी ऑक्सीजन का निर्माण होता है।
- जब दो परमाणु दो-दो इलेक्ट्रॉनों का साझा करते हैं तब दो सहसंयोजक बंधन बनते हैं जिसे द्विबंधन (Double bond) कहते हैं।
- नाइट्रोजन परमाणु की बाह्यतम कक्षा में 5 इलेक्ट्रॉन होते हैं।
- नाइट्रोजन के दो परमाणु आपस में तीन-तीन इलेक्ट्रॉनों का साझा करके एक स्थायी नाइट्रोजन अणु की रचना करते हैं।
- जब दो परमाणु तीन-तीन इलेक्ट्रॉनों का साझा करते हैं तब तीन सहसंयोजक बंधन बनते हैं। जिसे त्रिबंधन (Triple bond) कहते हैं।
- अमोनिया के एक अंगु निर्माण में नाइट्रोजन का एक परमाणु और हाइड्रोजन के तीन परमाणु भाग लेते हैं।
- कार्बन डाइऑक्साइड के एक अणु के निर्माण में कार्बन का एक परमाणु तथा ऑक्सीजन के दो परमाणु भाग लेते हैं।
- कार्बन प्रकृति में कई रूपों में पाया जाता है ।
- हीरा तथा ग्रेफा कार्बन के दो अपररूप हैं।
- हीरा में कार्बन परमाणु त्रिविमीय संरचना (Three dimensional structure) के रूप में सजे होते हैं जिनमें प्रत्येक कार्बन चार अन्य कार्बन परमाणुओं से सहसंयोजी बंधन द्वारा जुड़े होते हैं। यह सहसंयोजक बंधन हीरे की संरचना को काफी मजबूती प्रदान करता है जिससे हीरा कठोर हो जाता है।
- फुलेरीन कार्बन का एक अन्य शुद्धतम अपररूप है जो बड़ी संख्या में कार्बन परमाणुओं के संयोजित होने से बनते हैं।
- C60 फुलेरीन में साठ कार्बन परमाणु होते हैं तथा इसकी आकृति फुटबॉल जैसी होती है। इसकी संरचना बकमिंस्टर नामक एक अमेरिकी शिल्पकार द्वारा निर्मित जीओडेसिक गोलाकार गुंबज के सदृश था। इसलिये इसे बकमिंस्टर फुलेरीन कहा गया। इन्हें प्रायः बक्की बॉल्स (Bucky balls) भी कहते हैं।
- आयनिक यौगिक जिन्हें वैद्युत संयोजक यौगिक भी कहते हैं। इसका निर्माण एक परमाणु से दूसरे परमाणु में इलेक्ट्रॉन के स्थानांतरण से होता है।
- आयनिक यौगिकों के द्रवणांक और क्वथनांक उच्च होते हैं तथा द्रवित अवस्था में या जलीय अवस्था में ये विद्युत के सुचालक होते हैं।
- कार्बनिक यौगिकों के द्रवणांक और क्वथनांक निम्न होते हैं, क्योंकि इनके अणुओं के बीच बहुत कमजोर अन्तर आणविक बल (वान् डर वाल्स बल) रहता है।
- कार्बनिक यौगिक प्राय: विद्युत के कुचालक होते हैं, क्योंकि ये विलयन में आयन नहीं देते।
- कार्बनिक यौगिकों के सूत्र तीन प्रकार से व्यक्त किये जाते हैं—(i) लूइस इलेक्ट्रॉन बिंदु (Lewis electron dot structure), (ii) संरचना सूत्र (Structural formula) तथा (iii) त्रिविम सूत्र (Three dimensional formula)।
- लूइस इलेक्ट्रॉन बिंदु सरंचना प्रत्येक परमाणु से जुड़े परमाणुओं की तथा संयोजन इलेक्ट्रॉन की व्यवस्था को दर्शाता है।
- संरचना सूत्र में दो परमाणुओं के बीच के बंधन इलेक्ट्रॉन को एक रेखा (bond) (–) द्वारा । जिसे एकल बंधन (Single bond) कहते हैं।
- संरचना सूत्र को त्रिविम (Three dimensional) आकृति में भी निर्देशित किया जाता है।
- IUPAC प्रणाली में सभी कार्बनिक यौगिकों को हाइड्रोकार्बनों का व्युत्पन्न माना कार्बनिक यौगिकों के नाम उनके संगत के हाइड्रोकार्बन के नाम पर ही आधारित होते हैं।
- बेंजीन के सदृश यौगिकों को ऐरोमैटिक यौगिक कहा जाता है।
- बेंजीन अणु एकतलीय (Planer) होता है। इसके सभी कार्बन परमाणु और हाइड्रोजन परमाणु कागज की तल में होते हैं।
- समावयवियों के अणुसूत्र समान होते हैं तथा भौतिक और रासायनिक गुण भिन्न-भिन्न होते हैं ।
- कार्बनिक यौगिकों के स्रोत मुख्य रूप से पेट्रोलियम, कोयला एवं पेड़-पौधे होते हैं। संतृप्त हाइड्रोकार्बन के अण अध्रुवीय होते हैं, अतः जल में अघुलनशील होते हैं।
- ऐल्केन स्थायी और अक्रिय यौगिक होता है।
- ऐल्केन का उपयोग द्रवित पेट्रोलियम गैस (LPG), पेट्रोल, किरोसिन, डीजल एवं कम्प्रेस्ड नैचुरल गैस (CNG) के रूप में किया जाता है।
- ऐल्केन में प्रतिस्थापन अभिक्रिया होती है तथा ऐल्कीन में योगशील प्रतिक्रिया होती है।
- लाखों वर्ष पूर्व पृथ्वी के जंगलों में पेड़-पौधे भूकंप, ज्वालामुखी आदि के कारण जमीन के अन्दर धँस गये और इनके ऊपर मिट्टी, बालू और जल की परतें बैठ गयीं। कालान्तर में ये ऑक्सीजन के सम्पर्क से वंचित हो गये। फलतः इनका ऑक्सीकरण नहीं हो पाया। ऑक्सीजन की अनुपस्थिति में धरती के अन्दर के उच्च दाब और उच्च ताप तथा बैक्टीरिया के संयुक्त प्रभाव से इनका रूपान्तरण कोयले में हो जाता है।
- पेट्रोलियम की उत्पत्ति समुद्र में रहने वाले सूक्ष्म जीवों (Micro Organisms) तथा छोटे-छोटे पौधों से होती है। इनकी मृत्यु होने पर ये बालू और मिट्टी से ढँक जाते हैं। लाखों वर्ष तक ऊष्मा, दाब तथा बैक्टीरिया के प्रभाव के कारण ये अन्ततः हाइड्रोकार्बन में परिवर्तित हो जाते हैं, ये हाइड्रोकार्बन सछिद्र चट्टानों के जरिये ऊपर आने लगते हैं। इस क्रम में अगम्य चट्टानें (Impervious rocks) इनका मार्ग अवरुद्ध कर देती हैं। इन चट्टानों के नीचे ये तेल (Oil) के रूप में विद्यमान रहते हैं।
- विसरित ( diffused) सूर्य के प्रकाश की उपस्थिति में ऐल्केन की अभिक्रिया क्लोरीन के साथ होने पर ऐल्केन के सभी हाइड्रोजन परमाणु बारी-बारी से क्लोरीन परमाणु द्वारा प्रतिस्थापित हो जाते हैं। इस अभिक्रिया को हैलोजनीकरण (Halogenation) कहते हैं। इस अभिक्रिया को प्रतिस्थापन अभिक्रिया भी कहते हैं।
- पीने के अयोग्य बने हुये एथिल ऐल्कोहॉल को विकृतिकृत ऐल्कोहॉल (Denatured alcohol) अथवा मेथिलीकृत स्पिरिट (Methylated spirit) कहते हैं।
- वनस्पति तेल एवं वसा का क्षार द्वारा जल अपघटन की क्रिया के फलस्वरूप साबुन तथा गिल्सरॉल का बनना साबुनीकरण (Saponification) कहलाता है।
- अविलेय साबुन कपड़ों की छिद्रों में बैठ जाता है जिससे उनकी धुलायी में कठिनायी होती है। इसके निदान के लिये एक अन्य धुलायी सामग्री प्रस्तुत किया गया जिसे अपमार्जक (Detergent) कहते हैं।
- सर्फ (Surf), मैजिक (Magic), लक्स ( Lux) इत्यादि वाशिंग पाउडर में लगभग 15% से 30% अपमार्जक रहता है।
- पाउडर को शुष्क (Dry) रखने के लिये उसमें सोडियम सल्फेट और सोडियम सिलिकेट मिला दिये जाते हैं।
- सोडियम परबोरेट की उपस्थिति में पाउडर में विरंजक गुण आ जाता है। यह कपड़ों में सफेदी लाता है।
अभ्यासार्थ प्रश्न
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर (क, ख, ग या घ) लिखें।
1. प्रयोगशाला में संश्लेषित पहला कार्बनिक यौगिक है –
(क) CH4
(ख) CH3COOH3
(ग) NH2–CO–NH2
(घ) CH3COOCH
उत्तर – (ग)
2. प्रथम कार्बनिक यौगिक यूरिया का संश्लेषण किसने किया था ?
(क) कोल्बे ने
(ख) वोहलर ने
(ग) बर्जिलियस ने
(घ) कोई नहीं
उत्तर – (ख)
3. जीवन शक्ति के सिद्धांत का प्रतिपादन किसने किया था ?
(क) बर्जिलियस ने
(ख) लभ्वाजे ने
(ग) वोहलर ने
(घ) कोल्बे ने
उत्तर – (क)
4. कार्बनिक यौगिकों में निम्नलिखित कौन-से गुण पाए जाते हैं
(क) ये रंगहीन एवं गंधहीन होते हैं।
(ख) इनके क्वथनांक अथवा द्रवणांक निम्न होते हैं।
(ग) ये कार्बनिक विलायकों में अविलेय होते हैं।
(घ) ये समावयवता प्रदर्शित नहीं करते।
उत्तर – (ख)
5. कार्बनिक यौगिकों में तत्वों के संयोग का आधार होता है प्राय: –
(क) विद्युत संयोजकता
(ख) सहसंयोजकता
(ग) उपसहसंयोजकता
(घ) कोई नहीं
उत्तर – (ख)
6. ऐल्डिहाइड श्रेणी के यौगिकों में निम्नांकित में कौन क्रियाशील समूह विद्यमान होता है ?
(क) –OH
(ख) –COOH
(ग) –CHO
(घ) –NH2
उत्तर – (ग)
7. 1- ब्यूटीन तथा 2ब्यूटीन किस प्रकार के समावयवी हैं ?
(क) स्थान समावयवीं
(ख) क्रियाशील समावयवी
(ग) श्रृंखला समावयवी
(घ) इनमें कोई नहीं
उत्तर – (क)
8. हीरे में कार्बन परमाणुओं को बाँधे रखनेवाले कौन-से बंध हैं ?
(क) आयनिक
(ख) सहसंयोजी
(ग) द्विध्रुवीय
(घ) वान् डरे वाल्स बल
उत्तर – (ख)
9. निम्न में कौन योगशील अभिक्रियाएँ प्रदर्शित करता है ?
(क) ऐल्केन
(ख) ऐल्कीन
(ग) ऐल्किल समूह
(घ) इनमें सभी
उत्तर – (ख)
10. कैल्सियम कार्बाइड जल के साथ अभिक्रिया करके देता है ?
(क) मेथेन
(ख) एथेन
(ग) एथीन
(घ) एथाइन
उत्तर – (घ)
11. निम्न में किसके जल अपघटन से मेथेन बनता है ?
(क) CaC2
(ख) Al4C3
(ग) CH2Cl
(घ) HCHO
उत्तर – (ख)
12. विसरित ( diffused) सूर्य के प्रकाश में मेथेन क्लोरीन के आधिक्य में अभिक्रिया करके देता है –
(क) CHCl3
(ख) CCl4
(ग) CH3Cl
(घ) CH2Cl2
उत्तर – (ख)
13. एथीन को जब CC4 की उपस्थिति में Br2 के साथ अधिकृत किया जाता तब कौन-सा यौगिक बनता है ?
(क) 1,2 डाइब्रोमोएथेन
(ख) 1 – ब्रोमो – 2 – क्लोरोएथेन
(ग) (क) और (ख) दोनों
(घ) 1, 1 – डाइब्रोमोएथेन
उत्तर – (क)
14. निम्न में कौन-सी गैस धातु वेल्डिंग में प्रयुक्त होती है
(क) ऐसीटिलीन
(ख) एथेन
(ग) ब्यूटेन
(घ) एथिलीन
उत्तर – (क)
15. ऐल्कोहॉल बनाने में शर्करा का किण्वन किसकी क्रिया से होती है ?
(क) एन्जाइम
(ख) ऑक्सीजन
(ग) वायु
(घ) कार्बन डाइऑक्साइड
उत्तर – (क)
16. ओलेइक, स्टिएरिक, पामिटिक अम्ल हैं
(क) न्यूक्लिक अम्ल
(ख) ऐमीनो अम्ल
(ग) वसीय अम्ल
(घ) इनमें कोई नहीं
उत्तर – (ग)
17. एक कार्बनिक यौगिक (A) की अभिक्रिया NaHCO3 के संतृप्त जलीय घोल से कराने पर फदफदाहट के साथ CO2 गैस मुक्त होती है। निम्न में (A) कौन-सा यौगिक है ?
(क) ऐल्केन
(ख) ऐल्कीन
(ग) एथेनोइक अम्ल
(घ) एथेनॉल
उत्तर – (ग)
18. निम्नलिखित में मेथेन किसका उदाहरण है ?
(क) संतृप्त हाइड्रोकार्बन का
(ख) असंतृप्त हाइड्रोकार्बन का
(ग) एरोमैटिक हाइड्रोकार्बन का
(घ) अकार्बनिक यौगिक का
उत्तर – (क)
II. रिक्त स्थानों की पूर्ति करें।
1. कार्बन तथा हाइड्रोजन से बने यौगिक को ……… कहा जाता है।
उत्तर – हाइड्रोकार्बन
2. कार्बन के ……… गुण के कारण कार्बन के कुल यौगिकों की संख्या अत्यधिक है।
उत्तर – शृंखलन
3. वैसे यौगिक जिनके अणुसूत्र समान तथा संरचनाएँ भिन्न-भिन्न होते हैं समावयवता ……….. कहलाते हैं।
उत्तर – संरचनात्मक
4. बेंजीन में ………. परमाणु होते है।
उत्तर – बारह
5. ऐरोमैटिक यौगिक का स्रोत ………. होता है। तथा ऐलिफैटिक यौगिकों का स्रोत ……….. होता है
उत्तर – कोयला, पेट्रोलियम
6. मुख्य हाइड्रोकार्बन चार प्रकार के होते हैं जिन्हें ………. तथा ……… कहा जाता
उत्तर – ऐल्केन, ऐल्कीन, ऐल्काइन, ऐरोमेटिक
7. वह परमाणु या मूलक जिस पर यौगिक के गुण निर्भर करते हैं; ………… कहलाता है।
उत्तर – क्रियाशील मूलक
8. किसी समजात श्रेणी के दो क्रमागत सदस्यों के बीच …………. का अंतर रहता है।
उत्तर – —CH2
9. ऐसीटोन का क्रियाशील मूलक ………. है।
उत्तर – >C= O
10. सबसे कठोर पदार्थ ……… है।
उत्तर – हीरा
11. त्रिबंधयुक्त असंतृप्त हाइड्रोकार्बन ………. कहलाते हैं।
उत्तर – ऐल्काइन
12. एक एल्केन में कार्बन की संख्या 6 है। इस ऐल्केन में हाइड्रोजन की संख्या ……….. होगी।
उत्तर – चौदह
13. तेल और वसा उच्च वसीय अम्ल तथा ग्लिसरॉल के ………..होते हैं।
उत्तर – एस्टर
14. 6-8% ऐसीटिक अम्ल को ………. कहा जाता है।
उत्तर – सिरका
15. कोयला एक …….. ईंधन है।
उत्तर – जीवाश्म
III. सही / गलत का चयन करें ।
1. यूरिया का संश्लेषण वोहलर ने किया था।
उत्तर-सही
2. कार्बनिक यौगिक सिर्फ सजीव स्रोत से ही प्राप्त किए जाते हैं।
उत्तर – गलत
3. कार्बनिक रसायन हाइड्रोकार्बन और उनके व्युत्पन्नों का रसायन है।
उत्तर – सही
4. क्रियाशील मूलक पर यौगिकों के रासायनिक गुण निर्भर करते हैं।
उत्तर – सही
5. बेंजीन अणु एक तलीय (planer) होता है।
उत्तर – सही
6. अणुसूत्र C5H12 के पाँच शृंखला समावयवी होते हैं।
उत्तर – गलत
7. वैसे समावयवी जिनमें दो समान समूह द्विबंध के एक ओर स्थित हां, ट्रांस रूप कहलाते हैं।
उत्तर – गलत
7. समावयवियों के समान अणुसूत्र होते हैं।
उत्तर – सही
9. समावयवियों के समान क्रियाशील मूलक होते हैं।
उत्तर – गलत
10. समावयवियों के समान कार्बन श्रृंखला होते हैं।
उत्तर – गलत
11. हीरा विद्युत का सुचालक होता है, किन्तु ग्रैफाइट नहीं।
उत्तर – गलत
12. 100% ऐसीटिक अम्ल को सिरका कहा जाता है।
उत्तर – गलत
13. स्टिएरिक अम्ल एक ऐमीनो अम्ल होता है।
उत्तर – गलत
14. ऐसीटिलीन गैस को वायु के साथ जलाने पर ऑक्सी ऐसीटिलीन लौ प्राप्त होता है।
उत्तर – गलत
15. Al4C3 की अभिक्रया जल से कराने पर मेथेन गैस प्राप्त होता है।
उत्तर – सही
16. अपमार्जक उच्च वसीय अम्लों कं सोडियम लवण होते हैं।
उत्तर – गलत
17. कोलतार में अनेक कार्बनिक यौगिक विद्यमान होते हैं।
उत्तर – सही
18. कार्बनिक यौगिकों के रासायनिक गुण उनके क्रियाशील समूह पर निर्भर करते हैं।
उत्तर – सही
अतिलघु उत्तरीय प्रश्न
1. निम्नलिखित के एक-एक उदाहरण दें-
(i) ऐल्केन
(ii) ऐल्कीन
(iii) ऐल्काइन
(iv) ऐल्कोहॉल
(v) ऐल्डिहाइड
(vi) कीटोन
(vii) कार्बोक्सिलिक अम्ल
(viii) एस्टर
(ix) ऐमीन
(x) ईथर
उत्तर –
(i) ऐल्केन — मिथेन (CH4); CH3 – CH3 (इथेन)
(ii) ऐल्कीन — इथिलीन (CH2 = CH2), प्रोपीन (CH3 – CH = CH2)
(iii) ऐल्काइन — इथाइन (CH ≡ CH); प्रोपाइन (CH ≡ C – CH3)
(iv) ऐल्कोहॉल — इथाइल अल्कोहल (CH3 – CH2 – OH); मेथिल अल्कोहल (CH3 – OH)
(v) ऐल्डिहाइड — फार्मल्डिहाइड (H – CHO); ऐसिटल्डिहाइड (CH3CHO)
(vi) कीटोन — ऐसीटोन (CH3 – CO – CH3); डाइएथिल कीटोन (CH3 – CH2 – CO – CH2 – CH3)
(vii) कार्बोक्सिलिक अम्ल — फॉर्मिक अम्ल (HCOOH), एसिटिक अम्ल (CH3COOCH3)
(viii) एस्टर — मिथाइल प्रोपेनोएट (CH3CH2COOCH3)
(ix) ऐमीन — इथाइल एमाइन (CH3CH2NH2)
(x) ईथर — इथोक्सी इथेन (CH3CH2OCH2CH3)
2. निम्नलिखित के संरचना सूत्र लिखें –
(i) 2 मेथिल ब्यूटेन
(ii) ब्यूटेनोइक अम्ल
(iii) 2 ब्यूटेनॉल
(iv) मेथेनामीन
(v) 2-मेथिल-2 – हेक्सीन
(vi) 3-मेथिल – 3- हेक्सेनॉल
(vii) प्रोपेनोन
(viii) एथाइन
(ix) एथिलीन
(x) एथिल ऐल्कोहॉल
उत्तर – यौगिक के नाम संरचना सूत्र

3. निम्नलिखित कार्बनिक यौगिकों का संघनित संरचना सूत्र लिखें-
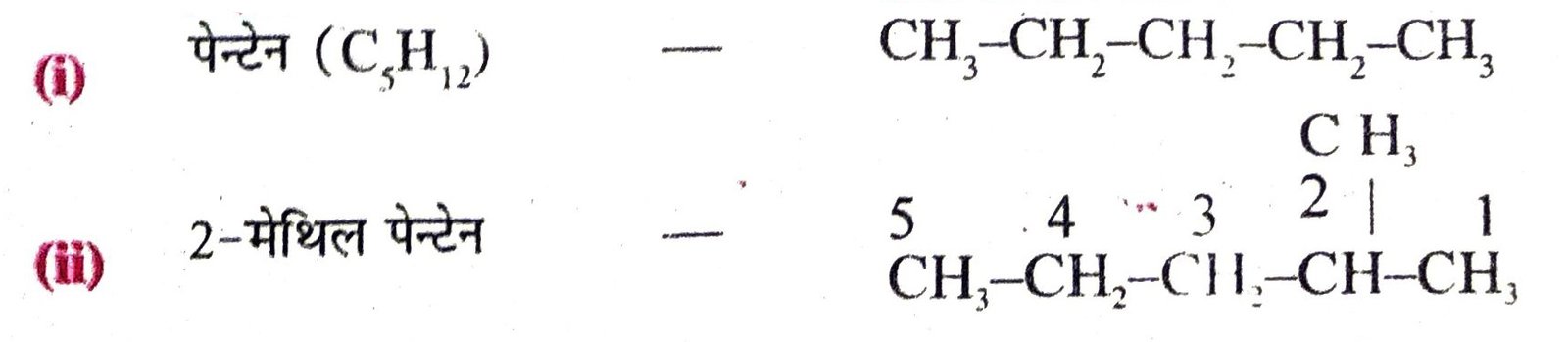
(i) पेन्टेन
(ii) 2 – मेथिलपेन्टेन
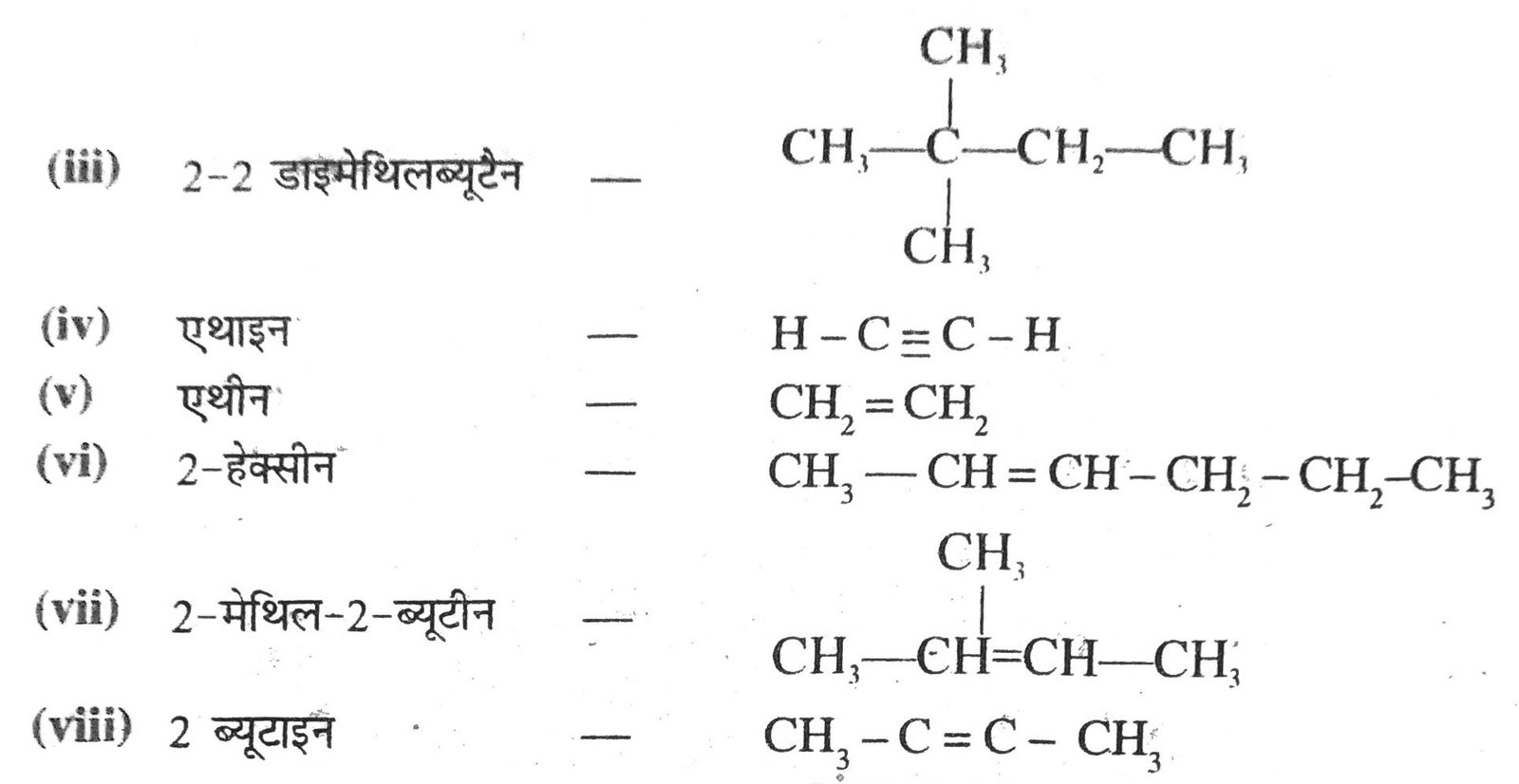
(iii) 2, 2 – डाइमेथिलब्यूटेन
(iv) एथाइन
(v) एथीन
(vi) 2 – हेक्सीन
(vii) 2 – मेथिल – 2 – ब्यूटेन
(viii) 2 – ब्यूटाइन
उत्तर – यौगिक
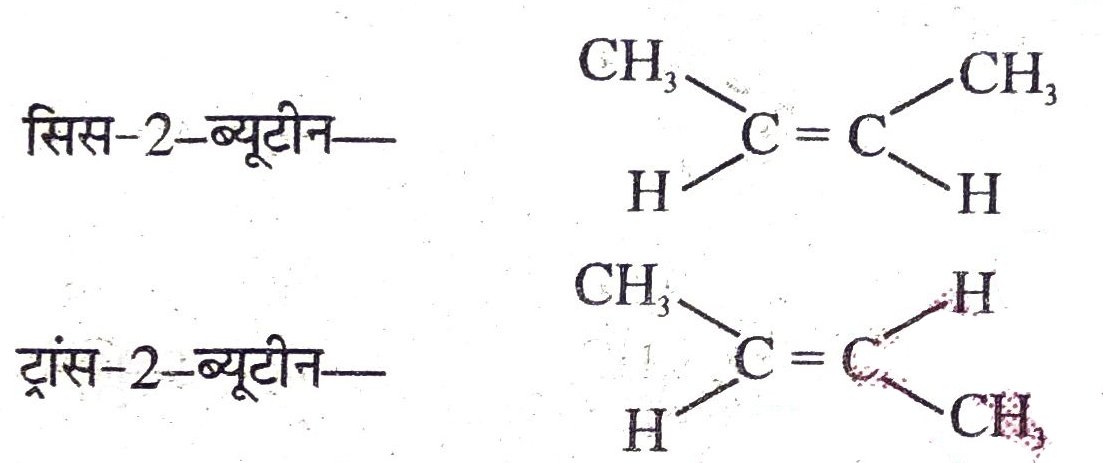
4. सिस- 2 – ब्यूटीन तथा ट्रांस-2 – ब्यूटीन के संरचना सूत्र लिखें।
उत्तर –
5. कार्बन के दो अपररूपों के नाम लिखें।
उत्तर – कार्बन के दो अपररूप हैं—(i) हीरा तथा (ii) ग्रेफाइट।
6. अचार बनाने में किस कार्बोक्सिलिक अम्ल का उपयोग परिरक्षक (Preservative) के रूप में किया जाता है ?
उत्तर – ऐसीटिक अम्ल (CH3COOH) को सिरका कहते हैं जिसका उपयोग अचार बनाने में परिरक्षक के रूप में होता है।
7. CnH2n+1 किसका सामान्य सूत्र है ?
उत्तर – CnH2n+1 ऐल्किल समूह (R) का सामान्य सूत्र है।
8. किन्हीं दो एंजाइम का नाम बतायें।
उत्तर – दो एंजाइम हैं—(i) इनवरटेज तथा (ii) जाइमेंस।
9. सिरके में उपस्थित कार्बनिक अम्ल का नाम लिखें।
उत्तर – सिरके में उपस्थित कार्बनिक अम्ल का नाम ऐसीटिक अम्ल है।
10. निम्नलिखित के लिये कारण स्पष्ट करेंऔद्योगिक कार्यों के लिये आपूर्ति की जानेवाली ऐल्कोहॉल में कॉपर सल्फेट मिश्रित होता है।
उत्तर – औद्योगिक कार्यों में आपूर्ति की जानेवाले ऐल्कोहॉल में कॉपर सल्फेट (तूतिया) मिला दिया जाता है ताकि वह विषैला हो जाये और कोई व्यक्ति इसे नहीं पी सके । इसे मेथिलीकृत स्पिरिट भी कहते हैं ।
11. सोडियम के एक छोटे टुकड़े को एथेनॉल में डालने पर क्या होता है ?
उत्तर – सोडियम एथॉक्साइड तथा हाइड्रोजन गैस देता है।
12. हीरा किस तत्व का अवरूप है।
उत्तर – हीरा कार्बन का अवरूप है।
लघु उत्तरीय प्रश्न
1. श्रृंखलन गुण (Catenation Property) क्या होते हैं ?
उत्तर – कार्बन के परमाणु सहसंयोजक बंधन द्वारा आपस में संयोग करके श्रृंखला बनाने की प्रवृत्ति रखते हैं। कार्बन में उपस्थित इस प्रवृत्ति को कार्बन का श्रृंखलन गुण कहते हैं।
2. ऐलिफैटिक यौगिक क्या है ?
उत्तर – वे कार्बनिक यौगिक जिनमें सभी कार्बन परमाणु एक-दूसरे से खुली श्रृंखला (open chain) में जुड़े रहते हैं, ऐलिफैटिक यौगिक कहलाते हैं।
3. क्रियाशील समूह क्या है ?
उत्तर – किसी कार्बनिक यौगिक में उपस्थित वह समूह जिसपर यौगिक का रासायनिक गुण निर्भर करता है। उसे यौगिक का क्रियाशील समूह कहते हैं। जैसे—C2H5OH में –OH क्रियाशील समूह है।
दूसरे शब्दों में, किसी कार्बनिक यौगिक के अणु में सामान्यतः दो भाग होते हैं। ये भाग या मूलक (Groups) कहलाते हैं। इनमें एक समूह अधिक महत्त्वपूर्ण होता है और इसी समूह यौगिक के रासायनिक गुण निर्भर करते हैं। यह क्रियाशील समूह कहलाता
4. अकार्बनिक यौगिकों की अपेक्षा कार्बनिक यौगिकों की संख्या अधिक क्यों है ?
उत्तर – कार्बन के परमाणु आपस में संयोग करके श्रृंखला (Chain) बनाने की प्रवृत्ति रखते हैं। कार्बन में उपस्थित इस गुण को श्रृंखलन गुण (Catenation Property) कहते हैं। इसी गुण F के कारण कार्बन के कुल यौगिकों की संख्या अत्यधिक है। कार्बन के अतिरिक्त किसी भी तत्व के परमाणुओं में परस्पर संयुक्त होकर ऐसी श्रृंखलायें बनाने की क्षमता उतनी नहीं पायी जाती जितनी कार्बन में पायी जाती है। अतः अकार्बनिक यौगिक की अपेक्षा कार्बनिक यौगिकों की संख्या अधिक होती है।
5. कार्बनिक और अकार्बनिक यौगिकों में मुख्य भेद बतायें।
उत्तर – कार्बनिक एवं अकार्बनिक यौगिकों में अन्तर इस प्रकार हैं

6. सहसंयोजक यौगिक क्या होते हैं ? कार्बन परमाणु स्थायित्व को कैसे प्राप्त करता है ?
उत्तर – जब दो परमाणु अपने बाह्यतम कक्षा के इलेक्ट्रॉनों का आपस में साझा करके संयोग उनके बीच स्थित बंधन को सहसंयोजक बंधन कहते हैं और इस प्रकार निर्मित यौगिक सहसंयोजक यौगिक कहलाते हैं। उदाहरण के लिये, हाइड्रोजन परमाणु की बाह्यतम कक्षा में एक ही इलेक्ट्रॉन रहता है। हाइड्रोजन का अणु बनते समय हाइड्रोजन के दोनों परमाणु अपने एक-एक इलेक्ट्रॉन का आपस में साझा निम्न रूप से करते हैं —

चूँकि परमाणु अपने स्थायित्व के लिये अक्रिय गैस के विन्यास को प्राप्त करना चाहता है। अत: कार्बन चार इलेक्ट्रॉन त्याग कर 2 इलेक्ट्रॉन (He परमाणु) का स्थायी विन्यास प्राप्त कर लेता है। अतः कार्बन परमाणु स्थायित्व को प्राप्त करता है।
7. समावयवी क्या है ?
उत्तर – वे कार्बनिक यौगिक जिनके अणुसूत्र समान होते हैं, लेकिन भौतिक और रासायनिक गुण भिन्न-भिन्न होते हैं, समावयवी (Isomers) कहलाते हैं और ऐसी घटना समावयवता कहलाती है। उदाहरण के तौर पर, अणुसूत्र C2H6O के दो समावयवी होंगे—

8. सिस-ट्रांस समावयवता क्या होती है ?
उत्तर – द्विबंध से जुड़े कार्बन परमाणुओं का मुक्त घूर्णन (Free rotation) नहीं हो जिससे दो ज्यामितिक समावयवी संभव हो पाते हैं। वैसे समावयवी जिनमें दो समान समूह द्विबंध के एक ओर स्थित हों, सिस (cis) समावयवता कहलाते हैं तथा जिनमें दो समान समूह द्विबंध के विपरीत दिशा में स्थित हों, ट्रांस (trans) समावयवता (रूप) कहलाते हैं ।
9. जीवन शक्ति का सिद्धान्त क्या है ?
उत्तर – प्रारम्भ में ऐसी मान्यता थी कि कार्बनिक यौगिक सिर्फ सजीव स्रोत से ही प्राप्त किये जा सकते हैं। किन्तु ऐसा संभव नहीं हुआ | बर्जीलियस ने 1815 ई० में एक सिद्धान्त दिया जिसके अनुसार सजीव पदार्थों में कार्बनिक यौगिकों का निर्माण एक अदृश्य जीवन शक्ति द्वारा होता है । इसे ही जीवन शक्ति का सिद्धान्त कहा जाता है। लेकिन कालान्तर में इस धारणा का भी अन्त हुआ जब वोहलर ने प्रयोगशाला में यूरिया का संश्लेषण अमोनियम सायनेट को गर्म करके किया। आज 10 लाख से ऊपर कार्बनिक यौगिक बनाये जा चुके हैं।
10. हीरा और ग्रेफाइट के भौतिक गुणों में अन्तर पड़ने का कारण क्या है ?
उत्तर – हीरा और ग्रेफाइट दोनों ही कार्बन के परमाणुओं से बने हैं। कार्बन के परमाणुओं के परस्पर आबंधन के तरीकों के आधार पर ही इनमें अन्तर होता है। हीरे में कार्बन का प्रत्येक परमाणु कार्बन के चार अन्य परमाणुओं के साथ आबंधित होता है जिससे एक दृढ़ त्रिआयामी संरचना बनती है। ग्रेफाइट में कार्बन के प्रत्येक परमाणु का आबंधन कार्बन के तीन अन्य परमाणुओं के साथ एक ही तल पर होता है जिससे षटकोणीय व्यूह मिलता है। इनमें से एक आबंध द्विआबंधी होता है जिसके कारण कार्बन की संयोजकता पूर्ण होती है। ग्रेफाइट की संरचना में षट्कोणीय तत्व एक-दूसरे के ऊपर व्यवस्थित होते हैं।
इन दो विभिन्न संरचनाओं के कारण हीरे और ग्रेफाइट के भौतिक गुणधर्म अत्यन्त भिन्न होते हैं जबकि उनके रासायनिक गुणधर्म एकसमान होते हैं।
11. कार्बनिक यौगिकों के स्रोत क्या होते हैं ?
उत्तर – कार्बनिक यौगिकों के स्रोत मुख्य रूप से पेट्रोलियम, कोयला एवं पेड़-पौधे होते हैं। प्रारंभ में ऐसी मान्यता थी कि कार्बनिक यौगिक, सिर्फ सजीव स्रोत से ही प्राप्त किये जा सकते हैं तथा उन्हें प्रयोगशाला में तैयार करना संभव नहीं है। बर्जीलियस (Berzelius) ने 1815 में जीवन शक्ति का सिद्धान्त दिया जिसके अनुसार सजीव पदार्थों में कार्बनिक यौगिकों का निर्माण एक अदृश्य जीवन शक्ति (Vital force) द्वारा होता है। लेकिन इस धारणा का अन्त हुआ जब वोहलर (Wohler) ने प्रयोगशाला में यूरिया (कार्बनिक यौगिक) का संश्लेषण अमोनियम सायनेट (अकार्बनिक यौगिक) को गर्म करके किया।
बाद में कोल्बे ने ऐसीटिक अम्ल का तथा बर्थेलो ने मेथेन का संश्लेषण किया। अबतक 1 लाख से अधिक कार्बनिक यौगिक प्रयोगशाला में बनाये जा चुके हैं। लम्वाजे (Lavoisier) ने प्रयोग द्वारा यह दिखाया कि कार्बनिक यौगिक प्राय: कार्बन, हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, हैलोजन, फॉस्फोरस, गंधक और कुछ धातुओं के संयोग से बने होते हैं तथा इनमें कार्बन सर्वदा विद्यमान होता है। इस आधार पर यह कहा जा सकता है कि कार्बनिक यौगिकों के बहुत सारे स्रोत होते हैं, जिनको तरह-तरह के प्रयोग कर प्राप्त किये जा सकते हैं।
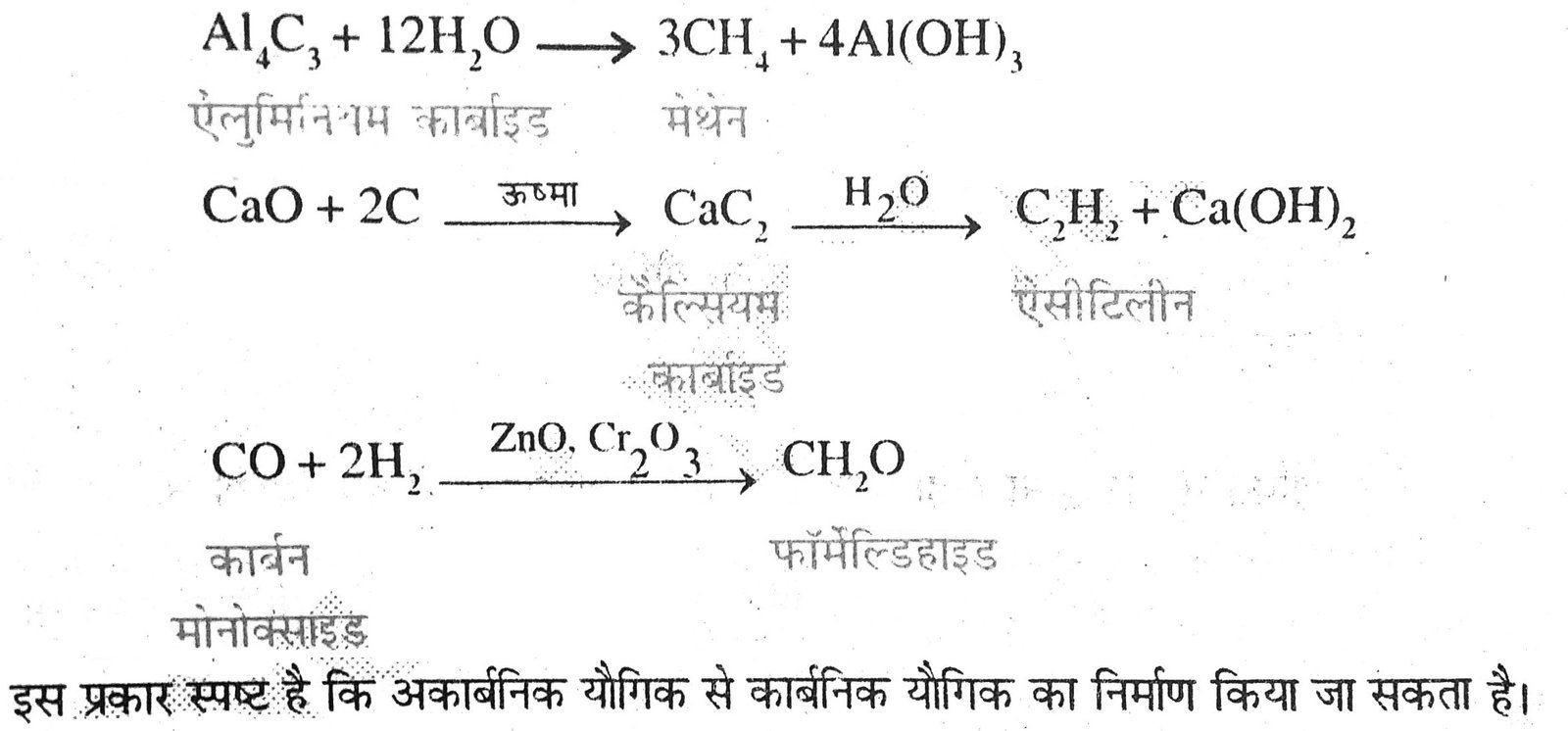
12. अकार्बनिक यौगिकों से कार्बनिक यौगिक कैसे बनाये जाते हैं ?
उत्तर – नीचे कुछ अभिक्रिया दी गयी है जिससे अकार्बनिक यौगिक को कार्बनिक यौगिक में बदला जाता है –
13. निम्नांकित में ऐल्कीन चुनें –
C2H6, C2H4, C3H4, C2H2, C6H6
उत्तर – ऐल्कीन— C2H4.
14. ऐल्कीन की जाँच की एक विधि बतायें।
उत्तर – ऐल्कीन की जाँच की प्रयोग विधि- ऐल्कीन या ऐल्काइन CCl4 (या जल) में घुलित ब्रोमीन जल के पीले विलयन को रंगहीन बना देता है। इस अभिक्रिया का उपयोग कार्बनिक यौगिकों में असंतृप्तता (unsaturation) का परीक्षण करने के लिए किया जाता है।
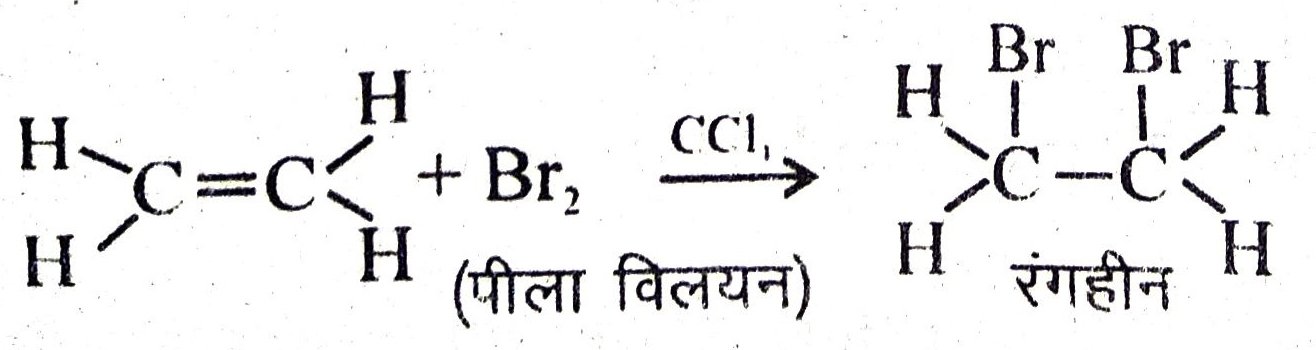
प्रयोग विधि- दो परखनली लें। एक परखनली में एल्केन (संतृप्त हाइड्रोजन) लें तथा दूसरे परखनली में ऐल्कीन लें तथा इन्हें CCl4 में घुला लें। CCl4 में Br2 में द्रव्य को दोनों परखर्नालियों में बूँद-बूँद डालकर परखनलियों को हिलाते रहें। एल्कीन वाले परखनली में वियलन का पीला रंग विरंजित होकर रंगहीन हो जाता है तथा ऐल्कन वाले परखनली में वियलन ज्यों-त्यों पीला रह जाता है।
15. एथेनॉल पीने से कौन-सा बुरा प्रभाव पड़ता है ?
उत्तर – एथेनॉल को ऐल्कोहॉल के नाम से भी जाना जाता है जिसका अधिकांश मात्रा में उपयोग ऐल्कोहॉलिक पेय (शराब) के रूप में किया जाता है। इसके अलावा ऐल्कोहॉल का उपयोग टिंचर आयोडीन (I2 + C2H5OH) कफ सीरप एवं टॉनिक बनाने में भी किया जाता है। थोड़ी मात्रा में ऐल्कोहॉल पीने से नशा आता है। ऐल्कोहॉल के लगातार सेवन से आलस्य, मानसिक व्याकुलता तथा मूर्छा आती है। इसके अलावा मनुष्य अपनी सोचने-समझने की शक्ति खो देता है।
16. सिरका क्या है ? इसके उपयोग को बतायें।
उत्तर – एथेनोइक अम्ल का साधारण नाम ऐसीटिक अम्ल है। 6-8% तनु ऐसीटिक अम्ल को सिरका (Vineger) कहते हैं जिसका उपयोग अचार (Pickles) बनाने में रक्षक (Preservative) के रूप में होता है।
17. वनस्पति तेल और वसा क्या होते हैं ?
उत्तर – वनस्पति, तेल और वसा उच्च वसीय अम्ल तथा ग्लिसरॉल से बने एस्टर होते हैं।
18. साबुनीकरण क्या होता है ?
उत्तर – वनस्पति तेल एवं वसा का क्षार द्वारा जल अपघटन की क्रिया के फलस्वरूप साबुन एवं ग्लिसरॉल का बनना साबुनीकरण कहलाता है।
19. साबुन क्या है ?
उत्तर – साबुन उच्च वसा अम्लों (Higher fatty acids) के सोडियम लवण होते हैं। अतः यह आयनिक होता है। जैसे—स्टिीयरेट आयन (C17H35COO) |
20. साबुन कैसे बनता हैं ?
उत्तर – वनस्पति तेल ( Vegetable Oil) या वसा (fat) को सोडियम हाइड्रॉक्साइड विलयन के साथ गर्म करने से साबुन बनता है।
21. एक एस्टर का नाम बतायें। एस्टर का गंध कैसा होता है ?
उत्तर – एथिल ऐसीटेट एक एस्टर है। इसका गंध फल जैसा मीठा होता है।
22. ऐरोमैटिक यौगिकों की जाँच कैसे की जाती है ?
उत्तर – नेफ्थलीन (ऐरोमैटिक यौगिक) की गोली या अन्य ऐरोमैटिक यौगिक के चूर्ण को ताँबे के पत्तर (Copper foil) पर रखकर बर्नर के प्रकाशहीन लौ (non-luminous flame) में गर्म करें। इसके बाद बर्नर की लौ का निरीक्षण करें। बर्नर कालिखयुक्त पीले लौ के साथ जलती है ।
23. मिसेल्स (micelles) क्या होते हैं ?
उत्तर – स्टियरेट आयन (C17H35COO) का हाइड्रोकार्बन भाग (C17H35) अध्रुवीय होता है जिसे पुछल्ला (tail) कहते हैं। यह भाग तेल या ग्रीस (एक हाइड्रोकार्बन) में घुल जाता है तथा इसका शीर्ष (head) COO ध्रुवीय होता है जो जल के अणुओं से संयोजित (Solvated) होकर कोलॉइडी आकार के कण बनाते हैं जिन्हें मिसेल्स कहते हैं।
मिसेल्स के प्रत्येक कण चारों ओर से ऋण आवेश (साबुन के आयनिक शीर्ष) से घिर जाते हैं जो एक-दूसरे को विकर्षित कर जल में निलंबित (Suspended) हो जाते हैं ताकि वे फिर साफ होनेवाली वस्तुओं से पुनः चिपक न जायें। कपड़े को धोते समय कपड़े का मैल हाथ से मलने अथवा ब्रश द्वारा रगड़ने से मिसेल्स के रूप में कपड़े को तुरंत छोड़कर जल में निलंबित हो जाता है।
24. सममूलक श्रेणी क्या होते हैं ?
उत्तर – समजातीय श्रेणी को ही सममूलक श्रेणी कहते हैं। कार्बनिक यौगिकों के गुणों का अध्ययन सुचारू रूप से करने के लिए इन्हें कई भागों में बाँटा गया है जिन्हें समजातीय या सममूलक श्रेणी कहते हैं तथा इनके प्रत्येक सदस्य सममूल या समजात (Homologue) कहलाते हैं । इस श्रेणी के किन्हीं दो क्रमागत यौगिकों के अणुसूत्रों में –CH2— का अन्तर होता है। सममूलक श्रेणी के सभी यौगिकों को एक ही सामान्य सूत्र द्वारा निरूपित किया जाता है। इस श्रेणी के सभी यौगिकों में एक ही क्रियाशील मूलक उपस्थित रहने के कारण उनके रासायनिक गुणों में समानता पायी जाती है। एक श्रेणी विशेष के सभी सदस्यों के बनाने की विधि एक समान होती है ।
25. जीवाश्म ईंधन क्या होते हैं ?
उत्तर – कोयला और पेट्रोलियम जीवाश्म ईंधन (Fossil fuels) हैं। पृथ्वी के अन्दर लाखों वर्ष तक मृत पेड़-पौधों और जानवरों का मिट्टी, बालू एवं चट्टानों की परतों के बीच दबे रहने के फलस्वरूप जो पदार्थ बनते हैं उन्हें जीवाश्म ईंधन कहते हैं। बड़े आकार वाले पेड़-पौधों से कोयला बनता है, जबकि छोटे-छोटे पौधों और जानवरों से पेट्रोलियम का निर्माण होता है।
26. ( क ) सहसंयोजी यौगिक प्रायः विद्युत के हीन चालक (कुचालक ) क्यों होते हैं ?
उत्तर – सहसंयोजक यौगिक विद्युत के कुचालक होते हैं। इसका कारण यह है कि ये उदासीन अणुओं से बने होते हैं आयनों से नहीं। ये पिछली या जलीय विलयन की अवस्था में आयन उत्पन्न नहीं करते हैं। इसीलिये ये विद्युत के कुचालक होते हैं। उदाहरण के तौर पर ग्लूकोस, यूरिया, ऐल्कोहॉल, कार्बन टेट्राक्लोराइड आदि विधुव के कुचालक होते हैं।
(ख) निम्नलिखित यौगिक का नाम लिखें –
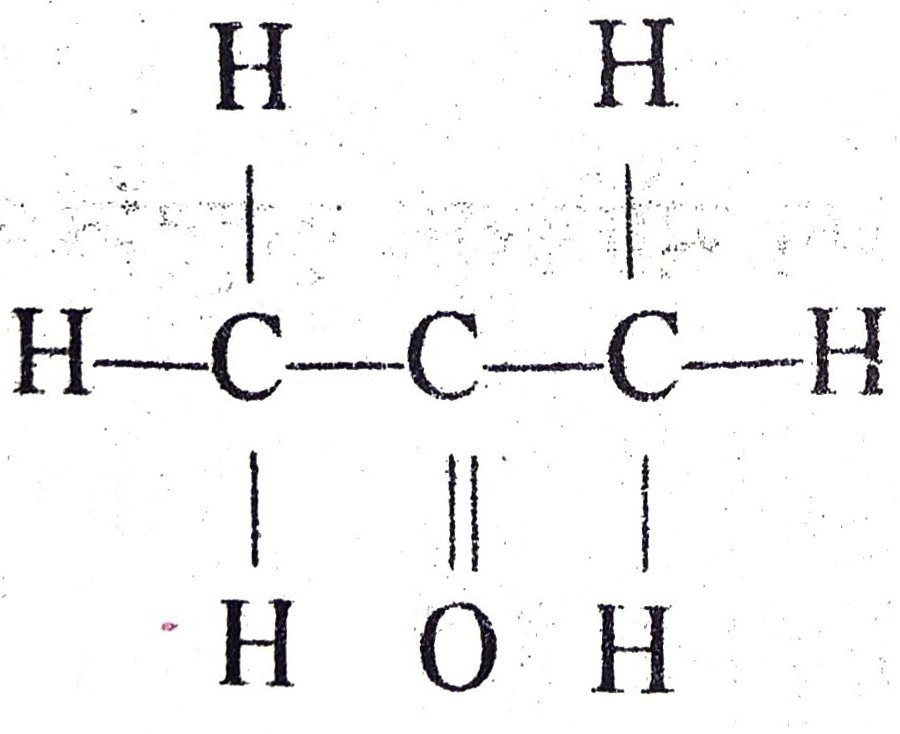
उत्तर – उपर्युक्त यौगिक का नाम प्रोपेनोन है।
(ग) उस गैस का नाम लिखें जो सोडियम कार्बोनेट पर एथेनोइक अम्ल डालने से उत्पन्न होती हैं। आप इस गैस की उपस्थिति कैसे सिद्ध करेंगे ?
उत्तर – सोडियम कार्बोनेट पर एथेनोइक अम्ल डालने से फदफदाहट (effervescence) के साथ CO2 गैस मुक्त होती है। इस गैस की उपस्थिति सिद्ध करने के लिये हम एक जलती हुयी मोमबत्ती को CO2 के पास ले जाते हैं। हम पायेंगे कि मोमबत्ती और अधिक तेजी से जलने लगती और कभी-कभी असावधानी के कारण आग भी लग जाती है। इस गैस का हमें आसानी से पता चल जाता है।
27. प्रतिस्थापना अभिक्रिया क्या है? उदाहरण देकर समझाएँ
उत्तर – देखें इसी अध्याय का अन्य महत्वपूर्ण प्रश्नोत्तर का लघुउत्तरीय प्रश्न संख्या-29 का उत्तर।
दीर्घ उत्तरीय प्रश्न
1. कार्बनिक रसायन क्या है ? जीवन शक्ति का सिद्धान्त क्या है ? इस सिद्धान्त का अंत कैसे हुआ ?
उत्तर – लभ्वाजे (Lavoisier) ने प्रयोग द्वारा यह दिखाया कि कार्बनिक यौगिक प्राय: कार्बन, हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, हैलोजन, फॉस्फोरस, गंधक और कुछ धातुओं के संयोग से बने होते हैं तथा इनमें कार्बन सर्वदा विद्यमान होता है। इस आधार पर कार्बन के यौगिकों को कार्बनिक यौगिक तथा कार्बन के यौगिकों के अध्ययन को कार्बनिक रसायन कहा गया। लगभग सभी कार्बनिक यौगिक कार्बन और हाइड्रोजन के बने होते हैं। अतः कार्बनिक रसायन वस्तुतः हाइड्रोकार्बन और इनके व्युत्पन्नों का रसायन है।
जीवन शक्ति का सिद्धान्त – प्रारम्भ में ऐसी मान्यता थी कि कार्बनिक यौगिक सिर्फ सजीव स्रोत से ही प्राप्त किये जा सकते हैं। किन्तु ऐसा संभव नहीं हुआ। बर्जीलिय ने 1815 ई० में एक सिद्धान्त दिया जिसके अनुसार सजीव पदार्थों में कार्बनिक यौगिकों का निर्माण एक अदृश्य जीवन शक्ति द्वारा होता है। इसे ही जीवन शक्ति का सिद्धान्त कहा जाता है। लेकिन कालान्तर में इस धारणा का भी अन्त हुआ जब वोहलर ने प्रयोगशाला में यूरिया का संश्लेषण अमोनियम सायनेद को मर्म करके किया। आज 10 लाख से ऊपर कार्बनिक यौगिक बनाये जा चुके हैं।
2. कार्बनिक यौगिकों के स्रोत एवं महत्व का उल्लेख करें।
उत्तर – कार्बनिक यौगिकों के स्रोत मुख्य रूप से पेट्रोलियम, कोयला एवं पेड़-पौधे होते हैं। प्रारंभ में ऐसी मान्यता थी कि कार्बनिक यौगिक, सिर्फ सजीव स्रोत से ही प्राप्त किये जा सकते हैं तथा उन्हें प्रयोगशाला में तैयार करना संभव नहीं है। बर्जीलियस (Berzelius) ने 1815 में जीवन शक्ति का सिद्धान्त दिया जिसके अनुसार सजीव पदार्थों में कार्बनिक यौगिकों का निर्माण एक अदृश्य जीवन शक्ति (Vital force) द्वारा होता है। लेकिन इस धारणा का अन्त हुआ जब वोहलर (Wohler) ने प्रयोगशाला में यूरिया (कार्बनिक यौगिक) का संश्लेषण अमोनियम सायनेट (अकार्बनिक यौगिक) को गर्म करके किया।
बाद में कोल्बे ने ऐसीटिक अम्ल का तथा बर्थेलो ने मेथेन का संश्लेषण किया। अबतक 1 लाख से अधिक कार्बनिक यौगिक प्रयोगशाला में बनाये जा चुके हैं। लम्वाजे (Lavoisier) ने प्रयोग द्वारा यह दिखाया कि कार्बनिक यौगिक प्राय: कार्बन, हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, हैलोजन, फॉस्फोरस, गंधक और कुछ धातुओं के संयोग से बने होते हैं तथा इनमें कार्बन सर्वदा विद्यमान होता है। इस आधार पर यह कहा जा सकता है कि कार्बनिक यौगिकों के बहुत सारे स्रोत होते हैं, जिनको तरह-तरह के प्रयोग कर प्राप्त किये जा सकते हैं ।
कार्बनिक यौगिक का महत्व कार्बनिक यौगिकों का हमारे दैनिक जीवन में काफी अधिक महत्व है। सुबह से शाम तक हम जिन वस्तुओं का इस्तेमाल करते हैं, वे सभी कार्बनिक यौगिकों के बने होते हैं। हमारे भोजन (कार्बोहाइड्रेट, प्रोटीन, वसा, विटामिन), कपड़ा, कागज, चमड़ा, साबुन, रंग, प्लास्टिक की वस्तुयें, बच्चों का खिलौना इत्यादि कार्बनिक यौगिकों के बने होते हैं। कार्बनिक यौगिकों का उपयोग कृत्रिम वस्त्र (रेयॉन, नाइलॉन, डेक्रॉन, टेरीलीन इत्यादि) बनाने में होता है। कार्बनिक यौगिकों का उपयोग कीटाणुनाशक DDT, गैमेक्सीन आदि के रूप में भी होता है। रोग से मुक्त होने के लिये कार्बनिक यौगिकों का व्यवहार होता है। उदाहरण के लिये, सल्फ ड्रग्स, पेनीसिलीन, क्लोरोमाइसेटीन, टेरामाइसीन, ऐस्पिरीन इत्यादि । कार्बनिक विस्फोटक जैसे डाइनामाइट, ट्राइनाइट्रोटॉलूईन (TNT), ट्राइनाइट्रोबेंजीन (TNB) इत्यादि का उपयोग युद्ध काल से होता आ रहा है।
इस प्रकार यह स्पष्ट तौर पर कहा जा सकता है कि कार्बनिक यौगिकों का हमारे दैनिक जीवन बहुत अधिक महत्व है।
3. कार्बनिक यौगिकों का वर्गीकरण किस प्रकार किया जाता है ?
उत्तर – कार्बनिक यौगिकों की कुल संख्या अनगिनत होने के कारण कार्बनिक यौगिकों को कई वर्गों में विभाजित किया जाता है जिससे कार्बनिक यौगिकों के गुणों का अध्ययन नियमित रूप से हो सके।
सबसे साधारण कार्बनिक यौगिक हाइड्रोकार्बन कहलाते हैं जो कार्बन तथा हाइड्रोजन के संयोग से बनते हैं। हाइड्रोकार्बन निम्नलिखित रूप से विभाजित किये जाते हैं-

4. (i) क्रियाशील समूह क्या होते हैं ?
(ii) निम्नलिखित यौगिक के क्रियाशील समूह के नाम और संरचना बतायेंऐल्कोहॉल, ऐल्डिहाइड, कीटोन, कार्बोक्सिलिक अम्ल, एस्टर, ऐमीन, ऐल्कीन, ऐल्काइन ।
उत्तर – (i) क्रियाशील समूह – किसी कार्बनिक यौगिक में उपस्थित वह समूह जिसपर यौगिक का रासायनिक गुण निर्भर करता है। उसे यौगिक का क्रियाशील समूह कहते हैं। जैसे—C2H5OH में –OH क्रियाशील समूह है।
दूसरे शब्दों में, किसी कार्बनिक यौगिक के अणु में सामान्यतः दो भाग होते हैं। ये भाग समूह या मूलक (Groups) कहलाते हैं। इनमें एक समूह अधिक महत्त्वपूर्ण होता है और इसी समूह पर यौगिक के रासायनिक गुण निर्भर करते हैं। यह क्रियाशील समूह कहलाता है।


5. कार्बन के कुछ विलक्षण गुणों का उल्लेख करें तथा बतायें कि कार्बन के यौगिकों की संख्या असंख्य क्यों है ?
उत्तर – 1. कार्बन में कार्बन के ही अन्य परमाणुओं के साथ बंध बनाने की अद्भुत क्षमता होती है। इस गुण को शृंखलन कहते हैं। इन यौगिकों में कार्बन की लंबी श्रृंखला कार्बन की विभिन्न शाखाओं वाली श्रृंखला या अँगूठी के आकार में व्यवस्थित कार्बन पाए जाते हैं। कार्बन के परमाणु एकल, युगल या तिहरे बंध में जुड़ सकते हैं।
2. कार्बन में चार संयोजकता होती है। इसलिए इसमें कार्बन के चार अन्य परमाणुओं या कुछ अन्य संयोजक तत्वों के परमाणुओं के साथ बंधन बनाने की क्षमता होती है। ऑक्सीजन, हाइड्रोजन, नाइट्रोजन, सल्फर, क्लोरीन तथा अनेक अन्य तत्व के साथ कार्बन के यौगिक बनते हैं। इससे ऐसे विशेष गुण करने वाले यौगिक बनते हैं, जो अणु में कार्बन के अतिरिक्त उपस्थित तत्व पर निर्भर करते हैं।
6. समावयवता क्या है ? विभिन्न प्रकार के समावयवता का उल्लेख उदाहरण के साथ करें।
उत्तर – समावयवता – वे कार्बनिक यौगिक जिनके अणुसूत्र समान होते हैं, लेकिन भौतिक और रासायनिक गुण भिन्न-भिन्न होते हैं, समावयवी कहलाते हैं तथा ऐसी घटना को समावयवता कहते हैं।
t$s–C2H6O के दो समावयवी हैं –
(i) CH3–CH2–OH (एथिल अल्कोहल)
(ii) CH3–CH3 (डायमेथिल ईथर)
समावयवता के प्रकार – समावयवता को दो वर्गों में विभाजित किया जाता है—
(A) संरचनात्मक समावयवता (Structural isomerism) तथा (B) त्रिविम समावयवता (Stereo isomerism)।
(A) संरचनात्मक समावयवता – कार्बनिक यौगिकों के अणु में उपस्थित परमाणुओं एवं विभिन्न प्रकार से जुड़े होने के कारण जो समावयवता होती है, उसे संरचनात्मक समावयवता कहते हैं। ये निम्न प्रकार के हैं –
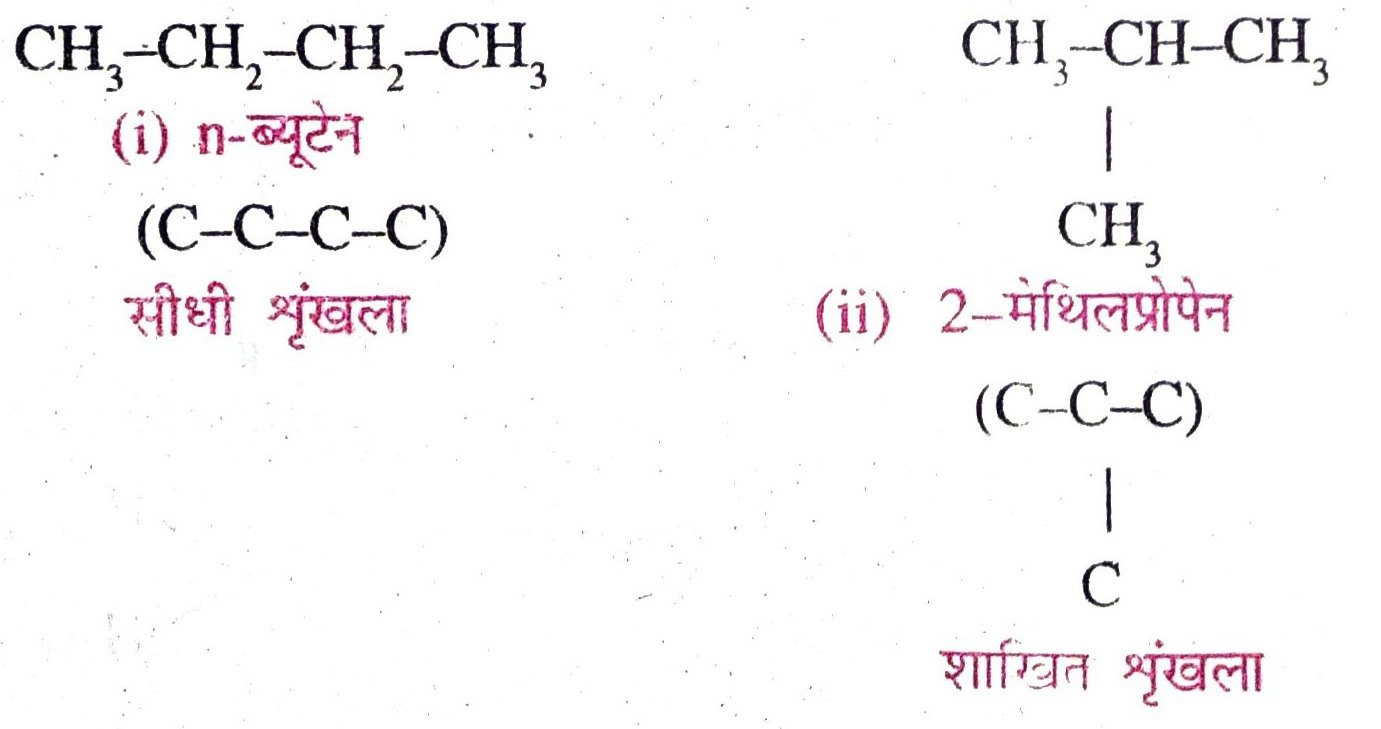
1. शृंखला समावयवता (Chain isomerism) – कार्बन की श्रृंखला में भिन्नता के कारण उत्पन्न होनेवाली समावयवता को शृंखला समावयवता कहते हैं। जैसे अणुसूत्र C4H10 के दो शृंखला समावयवी होते हैं –
2. स्थान समावयवता (Position isomeris.n) – क्रियाशील समूह के स्थान में भिन्नता – के कारण उत्पन्न होनेवाली समावयवता को स्थान समावयवता कहते हैं। उदाहरण – ऐल्कोहॉल के अणुसूत्र C3H8O के दो स्थान समावयवी 1-प्रोपेनॉल एवं 2- प्रोपेनॉल होते हैं। 1-प्रोपेनॉल में क्रियाशील समूह –OH का स्थान C1 पर तथा 2-प्रोपेनॉल में – OH का स्थान C2 पर है। –
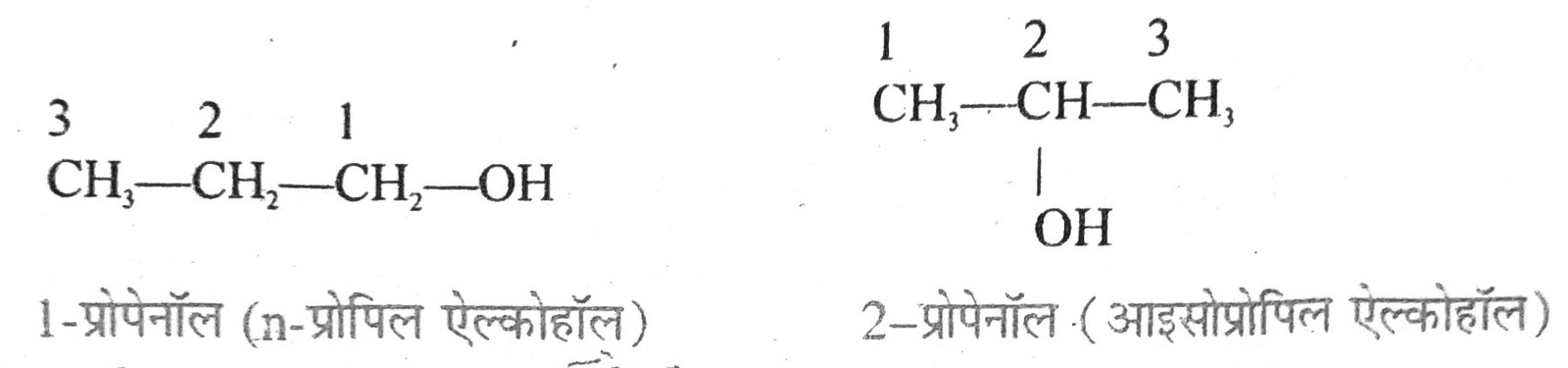
3. क्रियाशील समावयवता (Functional isomerism ) – जब दो या दो से अधिक यौगिकों के अणुसूत्र एक ही हों, किन्तु उनमें उपस्थित क्रियाशील समूह भिन्न-भिन्न हों तो इस घटना को क्रियाशील समावयवता कहते हैं। उदाहरण के लिये, C2H6O अणुसूत्र के दो क्रियाशील समावयवी एथेनॉल और डाइमेथिल ईथर होते हैं।

(B) त्रिविम समावयवता (Stereo isomerism) – त्रिविम समावयवियों का संख्या सूत्र समान होता है, किन्तु परमाणुओं एवं समूहों की स्थानिक व्यवस्था या विन्यास भिन्न होते हैं। ये दो प्रकार के हैं । –
1. ज्यामितिक समावयवता (Geometrical isomerism)-यह समावयवता वैसे ऐल्किनों या उनके व्युत्पन्नों द्वारा प्रदर्शित होती है जिनके द्विबंध से जुड़े प्रत्येक कार्बन के साथ दो भिन्न-भिन्न समूह जुड़े हों। जैसे –

2. प्रकाशिक समावयवता (Optical isomerism)– एक कार्बन परमाणु से चार भिन्न परमाणु या समूह जुड़े हों तो ऐसे कार्बनिक यौगिक के दो प्रकाशिक समावयवी होंगे। दोनों समावयवी एक-दूसरे के दर्पण प्रतिबिंब (mirror image) होते हैं। जैसे— *CH3CHBrCl के प्रकाशिक समावयवी हैं-
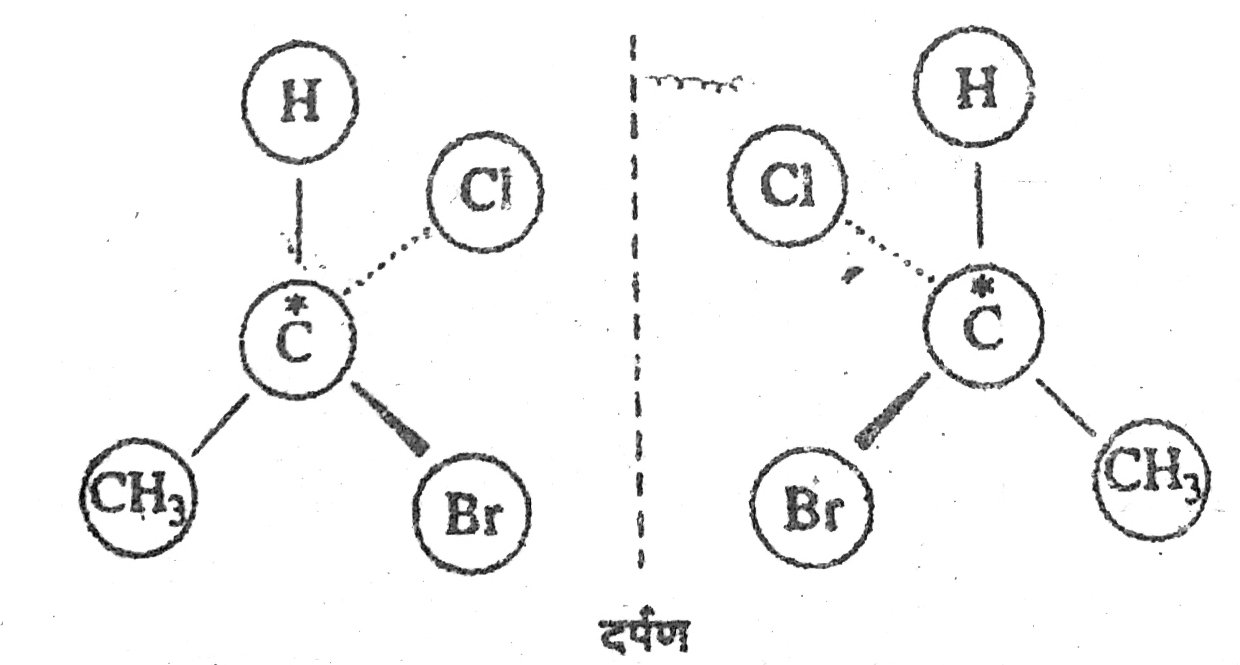
इस प्रकार समावयवता और उसके प्रकारों का विस्तृत अध्ययन करके हम समावयवता के बारे में विस्तार से ज्ञान प्राप्त करते हैं।
7. एथिल ऐल्कोहॉल का संरचना सूत्र लिखकर IUPAC यद्धति में इसका नाम बतायें तथा इसके बनने की एक विधि बतायें। इसके चार प्रमुख गुणों को लिखें।
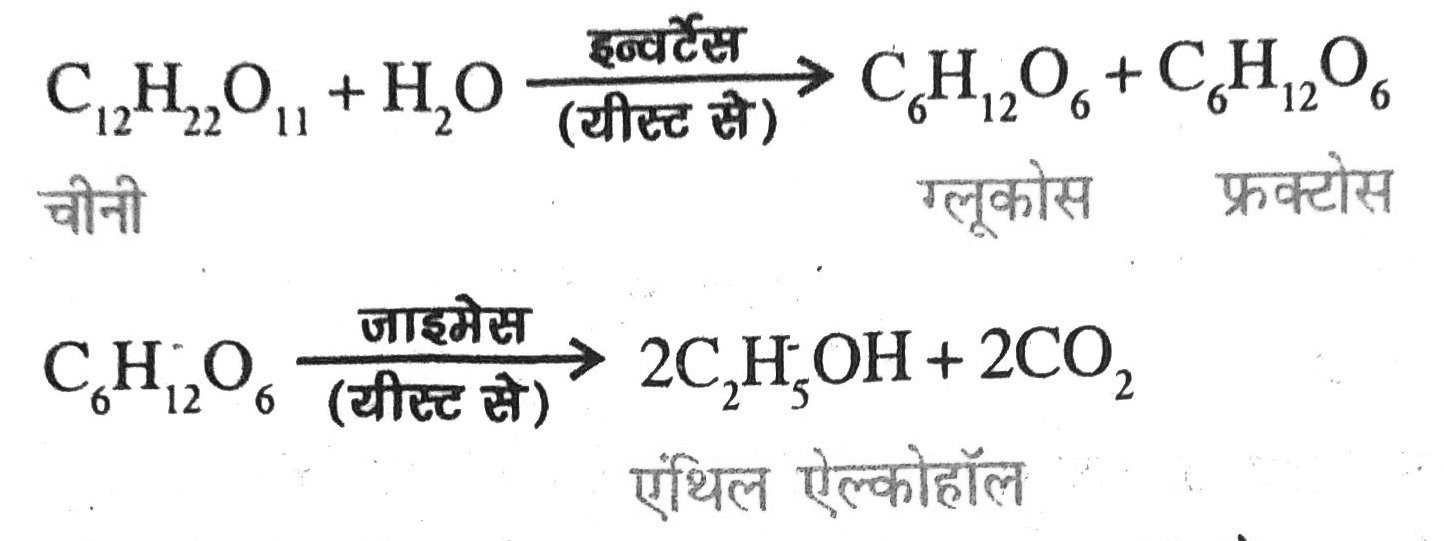
उत्तर – एथिल ऐल्कोहॉल का संरचना सूत्र CH3 – CH2 – OH और IUPAC पद्धति में इसका नाम एथेनॉल होता है।
एथिल ऐल्कोहॉल के बनने की विधि – व्यापारिक विधि में इसको चीनी या स्टार्च के किण्वन (fermentation) द्वारा बनाया का जाता है।
एथिल ऐल्कोहॉल के गुण- इसके बहुत सारे गुण होते हैं। चार प्रमुख गुण निम्न हैं –
(i) एथिल रंगहीन एवं वाष्पशील द्रव है।
(ii) इसका क्वथनांक 351K है ।
(iii) इसका गलनांक 156K है।
(iv) यह एक अच्छा विलायक है।
8. एथिल ऐल्कोहॉल से निम्नलिखित यौगिक किस प्रकार बनाये जाते हैं ?
(i) ऐसीटिक अम्ल
(ii) डाइएथिल ईथर
(iii) एथिल क्लोराइड
(iv) एथिलीन
उत्तर – एथिल ऐल्कोहॉल को IUPAC एथेनॉल ऐल्कोहॉल के रूप में जाना जाता है।
(i) एथिल या एथेनॉल ऐल्कोहॉल से ऐसीटिक अम्ल का बनना— एथेनॉल अम्लीय KMnO4 से ऑक्सीकृत होकर ऐसीटैल्डिहाइड देता है। ऐसीटैल्डिहाइड पुनः ऑक्सीकृत होकर ऐसीटिक अम्ल देता है।
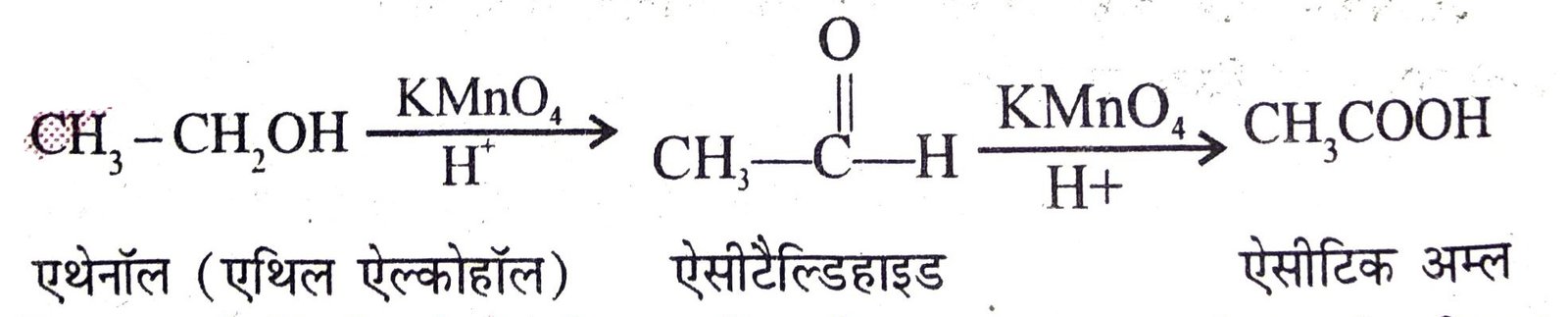
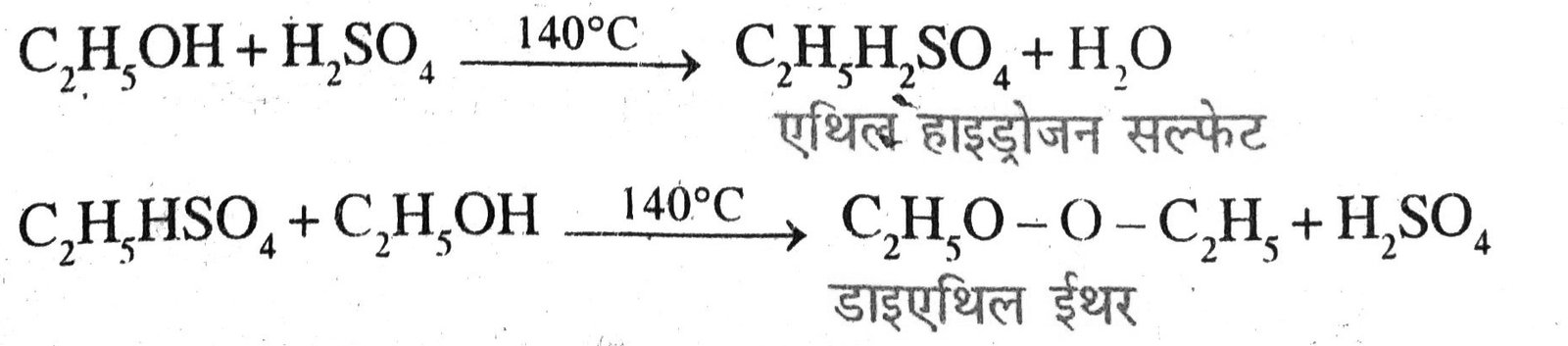
(ii) एथिल या एथेनॉल ऐल्कोहॉल से डाइएथिल ईथर का बनना- एथेनॉल की अधिकता में यदि सांद्र H2SO4 के साथ 140°C पर गर्म किया जाये तो डाइएथिल ईथर बनता है। यह अभिक्रिया दो चरणों में होती है—
(iii) एथिल या ऐल्कोहॉल द्वारा एथिल क्लोराइड का बनना – एथेनॉल PCl5 से अभिक्रिया कर एथिल क्लोराइड बनाता है ।
CH3CH2OH + PCl5 → CH3CH2Cl + POCl3 + HCl
एथेनॉल एथिल क्लोराइड
(iv) एथिल या एथेनॉल ऐल्कोहॉल द्वारा एथिलीन का बनना- एथेनॉल को यदि सांद्र H2SO4 की अधिकता में 170°C पर गर्म किया जाये तो एथिलीन बनता है।
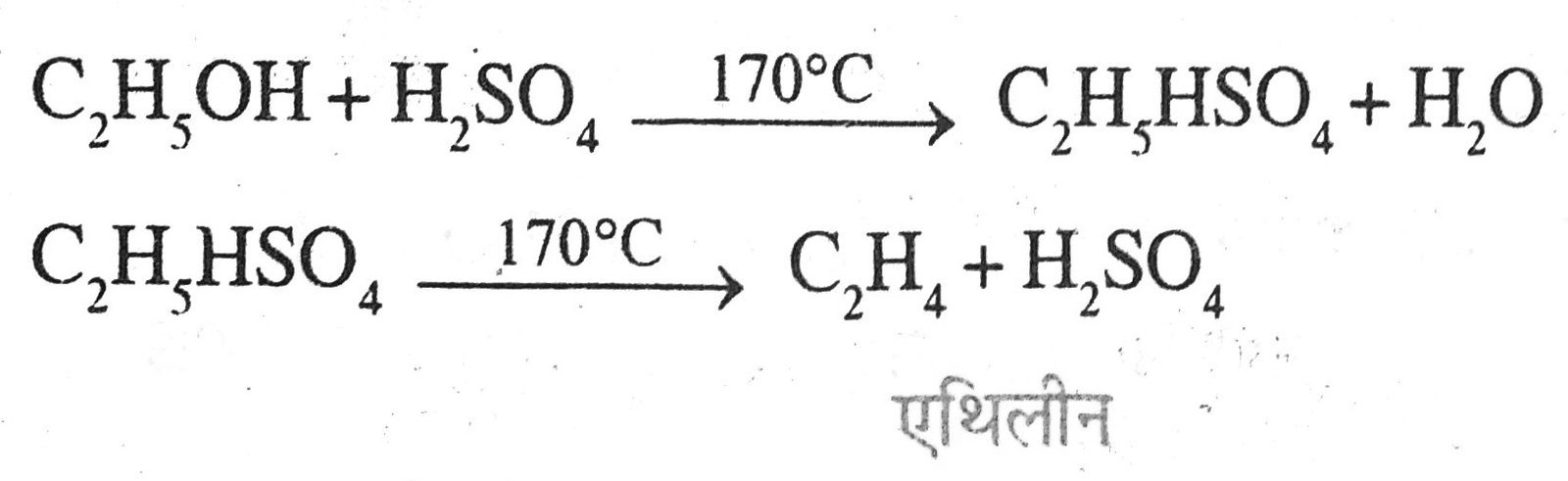
9. किण्वन क्या है ? चीनी से एथेनॉल किस प्रकार प्राप्त किया जाता है ?
उत्तर – किण्वन – किण्वन वह क्रिया है जिसमें शक्कर तथा स्टार्च के अणु छोटे अणुओं में टूट जाते हैं और साथ में कार्बन डाइऑक्साइड गैस उत्पन्न होती है।
एथेनॉल, शर्करा या स्टार्च के किण्वन द्वारा बनाया जाता है। यह किण्वन खमीर ( यीस्ट की उपस्थिति में होता है जिसमें दो एन्जाइम “इनवरटेज” तथा “जाइमेस” होते हैं।

किण्वन एक ऊष्माक्षेपी अभिक्रिया है। शर्करा के किण्वन की अभिक्रिया 20°C से 30°C तक के नियंत्रित ताप परास पर की जाती है। शक्कर के किण्वन की अभिक्रिया एक ऐसे पात्र में की जाती है जिसमें से किण्वन के दौरान बनी कार्बन डाइऑक्साइड गैस तो बाहर जा सकती है परन्तु बाहर की वायु पात्र के अन्दर नहीं जा सकती। इससे किण्वन से बने एथेनॉल का वायु की ऑक्सीजन द्वारा उपचयन नहीं होगा। शर्करा के किण्वन से एथेनॉल का तनु जलीय विलयन प्राप्त होता है। एथेनॉल का जल से पृथक्करण तथा शुद्धिकरण आसवन की प्रक्रिया द्वारा किया जाता है।
इस प्रकार स्पष्ट कहा जा सकता है कि एथेनॉल चीनी या स्टार्च के किण्वन (fermentation) द्वारा प्राप्त किया जाता है।
10. एथेनोइक अम्ल एवं निम्नांकित के साथ होनेवाली अभिक्रियाओं का रासायनिक समीकरण दें –
(i) सोडियम
(ii) सोडियम कार्बोनेट
(iii) सोडियम बाइकार्बोनेट
(iv) सांद्र H2SO4 की उपस्थिति में एथिल ऐल्कोहॉल की अभिक्रिया ।
उत्तर – (i) एथेनोइक अम्ल का सोडियम के साथ अभिक्रिया का रासायनिक समीकरण एथेनोइक अम्ल सोडियम से अभिक्रिया नहीं करता है जिसके फलस्वरूप कोई रासायनिक समीकरण नहीं बनता है।
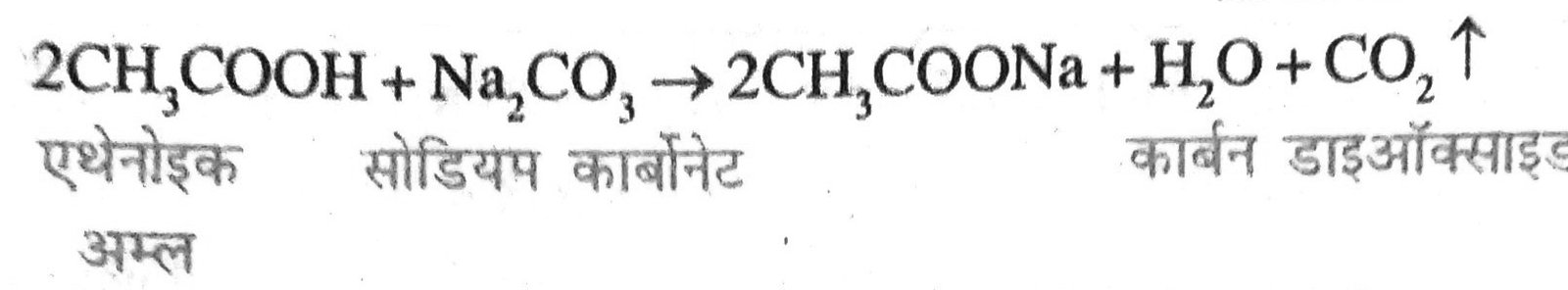
(ii) एथेनोइक अम्ल का सोडियम कार्बोनेट के साथ अभिक्रिया का रासायनिक समीकरण एथेनोइक अम्ल सोडियम कार्बोनेट के साथ अभिक्रिया करके फदफदाहट के साथ CO2 गैस मुक्त करता है।
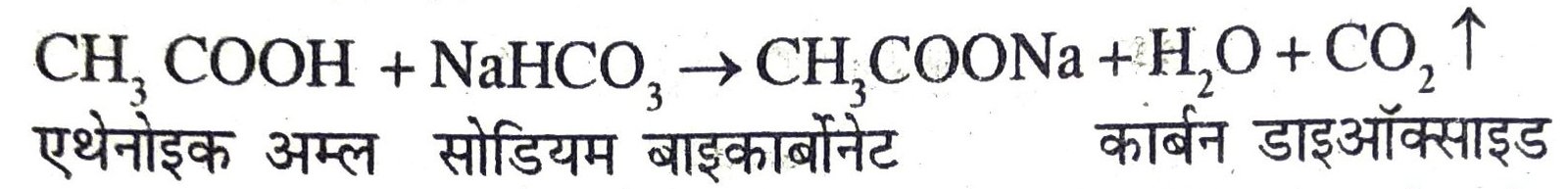
(iii) एथेनोइक अम्ल का सोडियम बाइकार्बोनेट के साथ अभिक्रिया का रासायनिक समीकरण एथेनोइक अम्ल की सोडियम बाइकार्बोनेट के साथ अभिक्रिया कर फदफदाहट के साथ CO2 गैस मुक्त करता है।
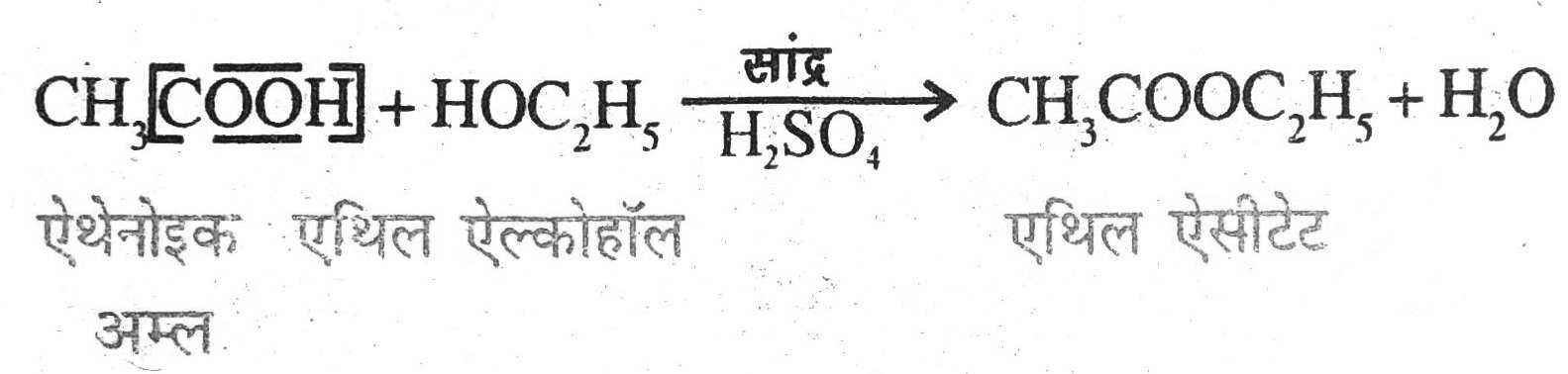
(iv) एथेनोइक अम्ल का सांद्र H2SO4 की उपस्थिति में एथिल ऐल्कोहॉल के साथ अभिक्रिया का रासायनिक समीकरण- सांद्र H2SO4 की उपस्थिति में एथेनोइक अम्ल को एथिल ऐल्कोहॉल के साथ गर्म करने पर एथिल ऐसटेट बनता है।
11. निम्नांकित पर नोट लिखें –
(i) एस्टरीकरण
(ii) हैलोजनीकरण
उत्तर – (i) एस्टरीकरण–सान्द्र H2SO4 की उपस्थिति में ऐसीटिक अम्ल को एथिल ऐल्कोहॉल के साथ गर्म करने पर एथिल ऐसीटेट बनता है जो एक एस्टर श्रेणी का यौगिक है। एस्टर बनने की इस क्रिया को एस्टरीकरण (esterification) कहते हैं।

(ii) हैलोजनीकरण (Halogenation)—विसरित (diffused) सूर्य के प्रकाश की उपस्थिति में ऐल्केन की अभिक्रिया क्लोरीन के साथ होने पर ऐल्केन के सभी हाइड्रोजन परमाणु बारी-बारी से क्लौरीन परमाणु द्वारा प्रतिस्थापित हो जाते हैं। इस अभिक्रिया को हैलोजनीकरण कहते हैं इसे प्रतिस्थापन अभिक्रिया भी कहा जाता है। जैसे –
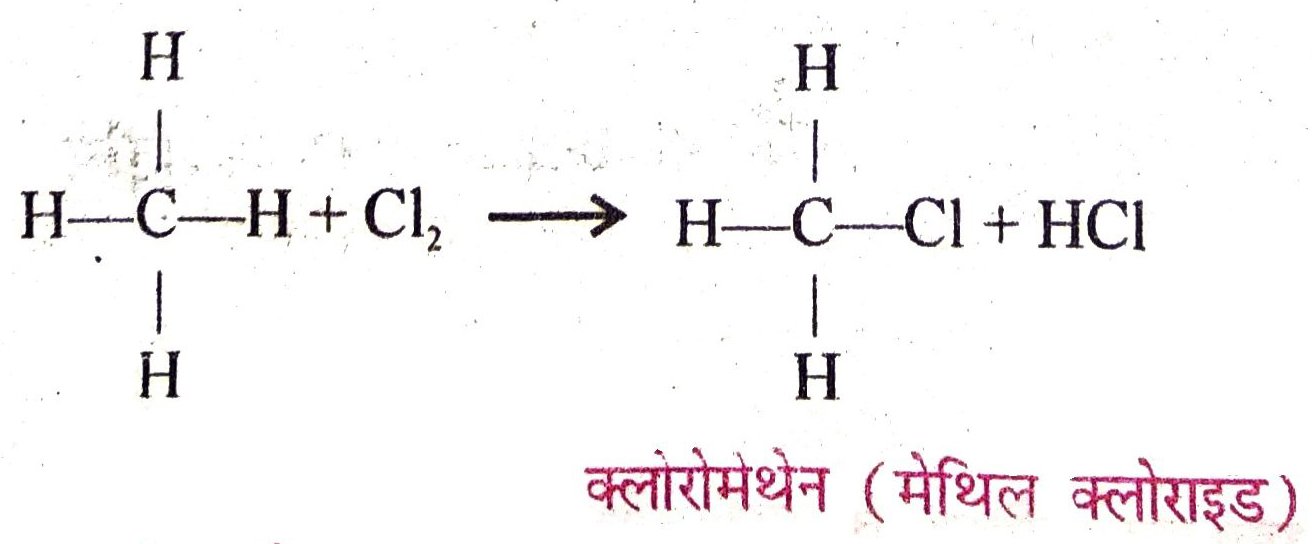
12. क्या होता है जब-
(i) ऐलुमिनियम कार्बाइड पर जल की अभिक्रिया करायी जाती है।
(ii) कैल्सियम कार्बाइड पर जल की अभिक्रिया करायी जाती है।
(iii) बेंजीन को सांद्र H2SO4 की उपस्थिति में सान्द्र HNO3 के साथ अभिक्रिया करायी जाती है।
(iv) बेंजीन को Fe की उपस्थिति में Cl2 से अभिक्रिया करायी जाती है।
उत्तर – (i) ऐलुमीनियम कार्बाइड पर जल की अभिक्रिया – ऐलुमीनियम कार्बाइड (Al4C3) पर जल (H2O) से अभिक्रिया कर मेथेन बनता है ।

(ii) कैल्सियम कार्बाइड पर जल की अभिक्रिया- कैल्सियम कार्बाइड (CaC2) पर जल (H2O) से अभिक्रिया कर ऐसीटिलीन बनता है।
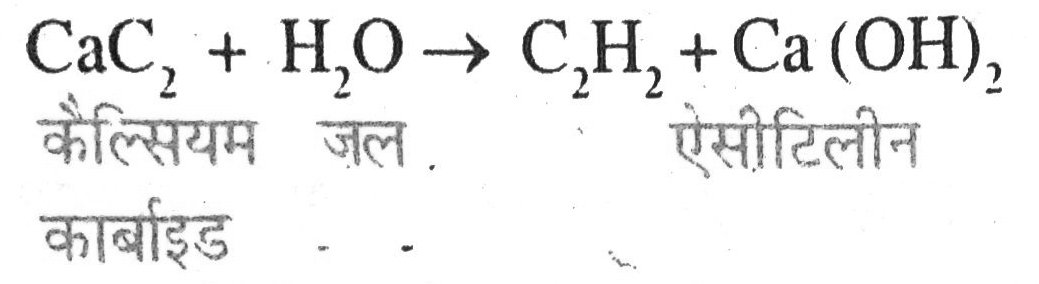
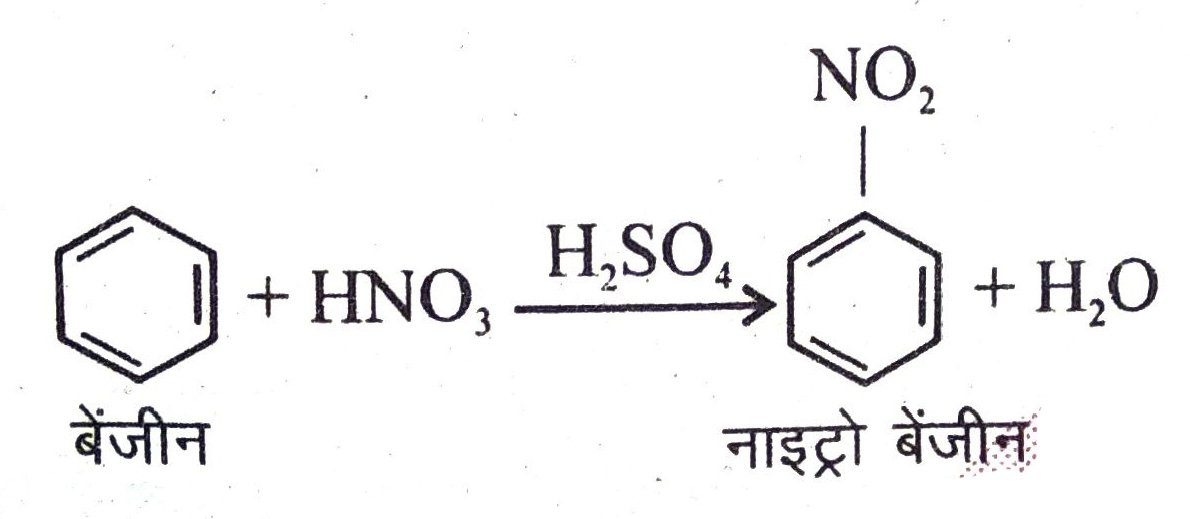
(iii) बेंजीन को सांद्र H2SO4 की उपस्थिति में सांद्र HNO3 से अभिक्रिया- सांद्र सल्फ्यूरिक अम्ल (H2SO4) की उपस्थिति में बेंजीन नाइट्रिक अम्ल (HNO3) से अभिक्रिया कर नाइट्रो बेंजीन बनाता है।
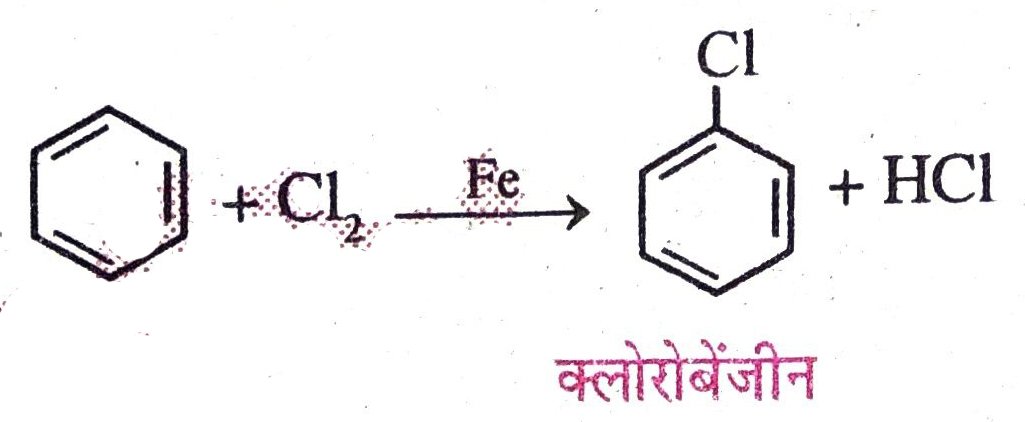
(iv) बेंजीन का Fe (लोहा) की उपस्थिति में Cl2 से अभिक्रिया—लोहा (Fe) की उपस्थिति में बेंजीन क्लोरीन (Cl2) से अभिक्रिया कर क्लोरोबेंजीन बनाता है।
13. साबुनीकरण प्रक्रिया क्या है ? अपमार्जकों ने साबुन का स्थान क्यों लिया है ?
उत्तर – वनस्पति तेल एवं वसा का क्षार द्वारा जल अपघटन की क्रिया के फलस्वरूप साबुन तथा ग्लिसरॉल का बनना साबुनीकरण प्रक्रिया (Saponification Process) कहलाता है।
कठोर जल में कैल्सियम और मैग्नीशियम के विलेय सल्फेट, क्लोराइड, बाइकार्बोनेट लवण उपस्थित रहते हैं। जब साबुन कठोर जल के सम्पर्क में आता है तो साबुन में उपस्थित वसा अम्ल का सोडियम लवण कैल्सियम या मैग्नीशियम लवणों से अभिक्रिया करता है जिसके फलस्वरूप वसा अम्ल का अविलेय (insoluble) कैल्सियम या मैग्नीशियम लवण बनता है जो अवक्षेप के रूप में पृथक हो जाता है। इन अविलेय लवणों के बनने में साबुन व्यर्थ हो जाता है। अविलेय साबुन कपड़ों की छिद्रों में बैठ जाता है जिससे उनकी धुलायी में कठिनाई होती है। इसके निदान के लिये एक अन्य धुलायी सामग्री प्रस्तुत किया गया जिसे अपमार्जक (Detergent) कहते हैं। अपमार्जक की रासायनिक प्रकृति साबुन से भिन्न होती है। यह सफाई के लिये साबुन से अच्छा पदार्थ है, चूँकि यह शीघ्र ही घुल जाता है तथा कठोर जल के साथ अविलेय कैल्सियम अथवा मैग्नीशियम लवण नहीं बनाता। अतः कठोर जल के साथ भी यह खूब झाग देता है। इसलिये अपमार्जकों ने साबुन का स्थान ले लिया है।
14. (i) कार्बनिक यौगिकों में होनेवाली एस्टरीकरण तथा साबुनीकरण अभिक्रियाओं में भेद करें ।
(ii) एक नामांकित आरेख की सहायता से एस्टर बनाने के क्रियाकलाप का वर्णन करें।
उत्तर – (i) कार्बनिक यौगिक में होनेवाली एस्टरीकरण तथा साबुनीकरण अभिक्रियाओं में अन्तर इस प्रकार है-
एस्टरीकरण (Esterification) – सान्द्र H2SO4 की उपस्थिति में ऐसीटिक अम्ल को एथिल ऐल्कोहॉल के साथ गर्म करने पर एथिल ऐसीटेट बनता है जो एक एस्टर श्रेणी का यौगिक है। एस्टर बनने की इस क्रिया को एस्टरीकरण (esterification) कहते हैं।
साबुनीकरण (Saponification)– वनस्पति तेल एवं वसा का क्षार द्वारा जल अपघटन की क्रिया के फलस्वरूप साबुन तथा ग्लिसरॉल का बनना साबुनीकरण प्रक्रिया (Saponification Process) कहलाता है।
(ii) एस्टर बनाने का क्रियाकलाप –एस्टर मुख्य रूप से अम्ल एवं ऐल्कोहॉल की अभिक्रिया से निर्मित होते हैं। एथेनोइक अम्ल किसी अम्ल उत्प्रेरक की उपस्थिति में परिशुद्ध एथेनॉल से अभिक्रिया करके एस्टर बनाते हैं।
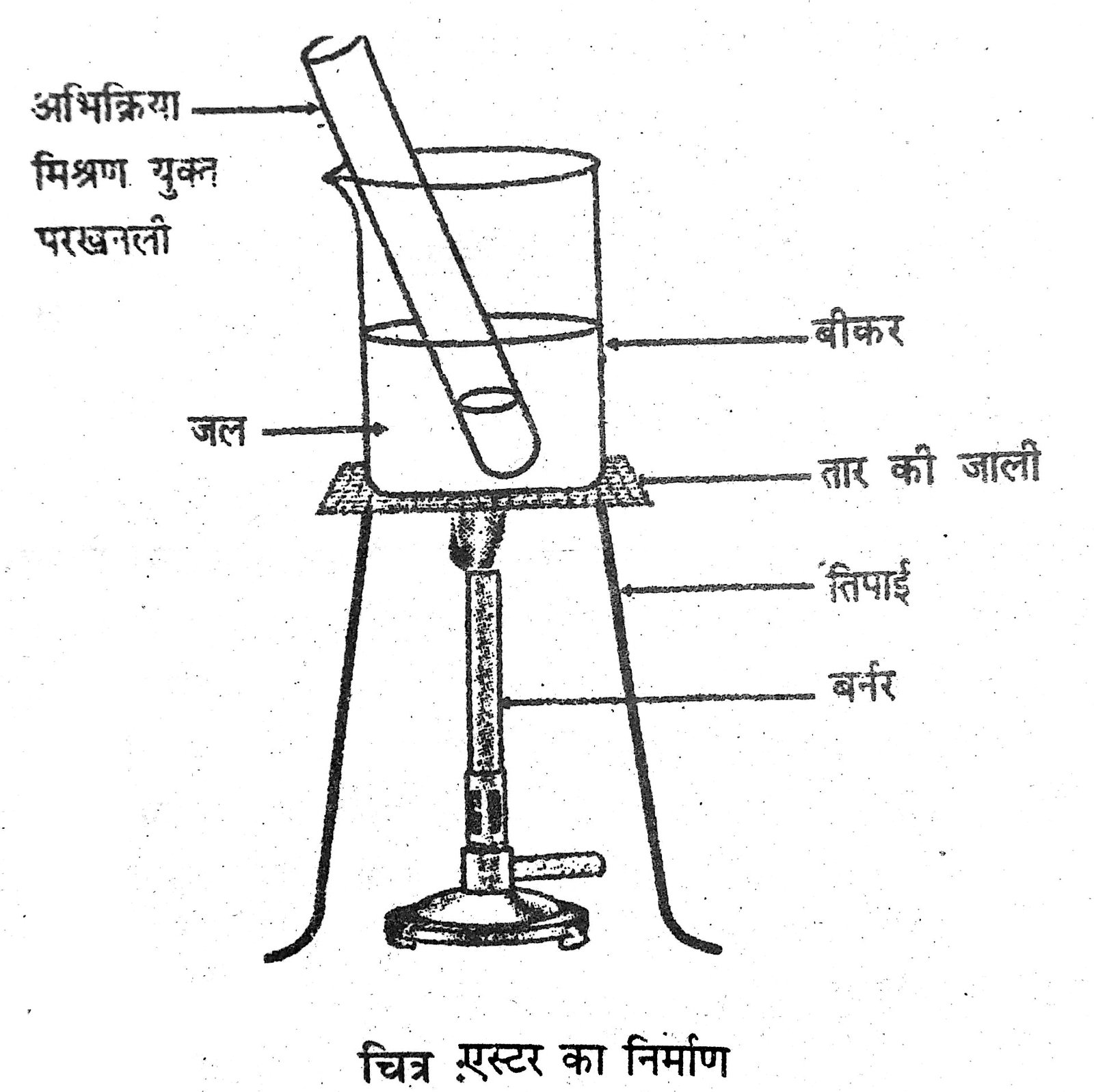
अन्य महत्वपूर्ण प्रश्न एवं उनके उत्तर
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर ( क, ख, ग या घ) लिखें।
1. निम्नांकित में कौन समावयवी है ?
(क) C2H6 और C6H6
(ख) C4H5 और C4H10
(ग) C2H5OH और CH3OCH3
(घ) C5H10 और C6H12
उत्तर – (ग)
2. किसमें विद्युत संयोजक बंधन है ?
(क) HCl
(ख) CCl4
(ग) H2O
(घ) NaCl
उत्तर – (घ)
3. सामान्य सूत्र CnH2n कहे जाते हैं
(क) एल्कीन
(ख) एल्केन
(ग) एल्काइन
(घ) एल्डिहाइड
उत्तर – (क)
4. प्राकृतिक रबर बहुलक है
(क) आइसोप्रीन का
(ख) ब्युटाडाइन का
(ग) ड्यूप्रीन का
(घ) एसिटिलीन का
उत्तर – (क)
5. किसी संतृप्त हाइड्रोकार्बन से प्राप्त एक कार्बनिक यौगिक का अणु CH3CH2X है। सूत्र का भाग X कहलाता है –
(क) संतृप्त हाइड्रोकार्बन समूह
(ख) क्रियाशील समूह
(ग) असंतृप्त हाइड्रोकार्बन समूह
(घ) हाइड्रोकार्बन समूह
उत्तर – (ख)
6. मेथेन किस प्रकार का अणु है ?
(क) द्वि-सहसंयोजक
(ख) त्रि- सहसंयोजक
(ग) एकल- सहसंयोजक
(घ) इनमें से कोई नहीं
उत्तर – (ग)
7. निम्नलिखित में कौन विद्युत का सुचालक है ?
(क) हीरा
(ख) ग्रेफाइट
(ग) अस्थि चारकोल
(घ) कोक
उत्तर – (ख)
8. ऐल्कीन श्रेणी के यौगिकों का सामान्य सूत्र है
(क) CnH2n
(ख) CnH2n+2
(ग) CnH2n-2
(घ) CnH2n+1
उत्तर – (क)
9. पेंसिल बनाने में कार्बन के जिस व्यवहार होता है, वह है –
(क) ग्रेफाइट
(ख) कोक
(ग) चारकोल
(घ) गैस-कार्बन
उत्तर – (क)
10. क्रियात्मक समूह ‘–COO–’ वाले यौगिक कहलाते हैं
(क) अल्कोहल
(ख) एथर
(ग) एस्टर
(घ) एल्डिहाइड
उत्तर – (ग)
11. नैफ्थलीन एक –
(क) क्रियात्मक समूह
(ख) एरोमैटिक हाइड्रोकार्बन है
(ग) संतृप्त हाइड्रोकार्बन है
(घ) असंतृप्त ऐलीफैटिक हाइड्रोकार्बन है
उत्तर – (ख)
12. एल्काइन का सामान्य सूत्र है –
(क) CnH2n+2
(ख) CnH2n
(ग) CnHn
(घ) CnH2n-2
उत्तर – (घ)
13. एल्केन का उदाहरण है
(क) अल्कोहल
(ख) एथेन
(ग) एसीटिलीन
(घ) एथिलीन
उत्तर – (ख)
14. कोयले के भंजक आसवन के पश्चात बना अवशेष कहलाता है –
(क) कोक
(ख) काजल
(ग) ग्रेफाइट
(घ) हीरा
उत्तर – (क)
15. निम्नलिखित में कौन-सा युग्म सजातीय श्रेणी का है ?
(क) मिथाइल अल्कोहल एवं मिथाइल क्लोराइड
(ख) एथेन एवं इथीन
(ग) एथीन एवं इथाइन
(घ) मेथेन एवं एथेन
उत्तर – (घ)
16. क्रियात्मक समूह – C ≡ C – वाले असंतृप्त हाइड्रोकार्बन कहलाते हैं—
(क) एल्केन
(ख) एल्कीन
(ग) एल्काइन
(घ) बेंजीन
उत्तर – (ग)
17. बेकेलाइट एक
(क) रबर है
(ख) काँच है
(ग) प्लास्टिक है
(घ) संश्लिष्ट रेशा है
उत्तर – (ग)
18. इनमें कौन कार्बनिक यौगिकों के स्रोत नहीं है ?
(क) पौधे
(ख) जानवर
(ग) कोयला
(घ) जल
उत्तर – (घ)
19. हीरा एवं ग्रेफाइट के गुणों में अंतर का कारण है
(क) प्राप्ति
(ख) दैनिकजीवन में आवश्यकता
(ग) संरचना
(घ) भौतिक गुण
उत्तर – (ग)
20. कागज है –
(क) प्राकृतिक रेशा
(ख) कार्बन का अपररूप
(ग) सेलुलोज का शुद्ध रूप
(घ) एक प्रकार का प्लास्टिक
उत्तर – (ग)
21. लाह है
(क) कार्बन का अपररूप
(ख) प्राकृतिक रेशा
(ग) सेलुलोज का शुद्ध रूप
(घ) प्राकृतिक प्लास्टिक
उत्तर – (घ)
22. सबसे कठोर पदार्थ है
(क) काला पत्थर
(ख) हीरा
(ग) सिलिकॉन कार्बाइड
(घ) ग्रेफाइट
उत्तर – (ख)
23. निम्नलिखित में कौन-सी गैस अग्निशामक के रूप में व्यवहार की जाती है ?
(क) CO
(ख) CO2
(ग) NH2
(घ) SO2
उत्तर – (ख)
24. निम्नलिखित में कौन-सा पदार्थ एक तत्त्व है ?
(क) ग्रेफाइट
(ख) काँच
(ग) सीमेंट
(घ) बालू
उत्तर – (क)
25. पेट्रोलियम है
(क) हाइड्रोकार्बन का मिश्रण
(ख) हाइड्रोकार्बन का यौगिक
(ग) एक तत्त्व
(घ) एक अधातु
उत्तर – (क)
26. क्रियात्मक समूह > C = C < वाले यौगिक कहलाते हैं –
(क) अल्कोहल
(ख) एल्कीन
(ग) एल्काइन
(घ) एल्केन
उत्तर – (ख)
27. हजामत बनाने वाला साबुन अधिक झाग देता है तथा शीघ्र सूखता नहीं, क्योंकि इसमें रहता है –
(क) रेजिन एवं ग्लिसरॉल
(ख) ईथर
(ग) एथिल अल्कोहल
(घ) एसीटोन
उत्तर – (क)
28. सेलुलोज है
(क) कार्बोहाइड्रेट
(ख) समावयवी
(ग) बहुलक
(घ) अपररूप
उत्तर – (क)
29. यदि अनेक यौगिकों के क्रियाशील समूह समान हों तो इन यौगिकों के –
(क) भौतिक गुण समान होते हैं
(ख) रासायनिक गुण समान होते हैं
(ग) रासायनिक गुण भिन्न होते हैं
(घ) अणुसूत्र समान होते हैं हैं.
उत्तर – (ख)
30. एल्केन प्रतिक्रिया करते हैं –
(क) प्रतिस्थापन
(ख) संयोजन
(ग) बहुलीकरण
(घ) इनमें कोई नहीं
उत्तर – (क)
31. अपररूपता प्रदर्शित करने वाला तत्त्व है
(क) नाइट्रोजन
(ख) कार्बन
(ग) हीलियम
(घ) सोडियम
उत्तर – (ख)
32. फॉर्मेलिन का उपयोग होता है
(क) कीड़ा मारने में
(ख) दुर्गन्ध समाप्त करने में
(ग) जीवों की प्राण रक्षा में
(घ) मृत जीवों को सुरक्षित रखने में
उत्तर – (घ)
33. कार्बन आवर्त सारणी के जिस वर्ग में है उसमें अन्य तत्त्व है
(क) लोहा
(ख) सोना
(ग) चाँदी
(घ) सिलिकॉन
उत्तर – (घ)
34. C12H26 आण्विक सूत्र वाले एक हाइड्रोकार्बन को गर्म करने पर C8H18 वाला एक दूसरा हाइड्रोकार्बन बनता है। इस परिवर्तन में होने वाली आण्विक सूत्र प्रक्रिया को कहते हैं
(क) आसवन
(ख) भंजन
(ग) बहुलीकरण
(घ) दहन
उत्तर – (ख)
35. निम्नलिखित में कौन असंतृप्त हाइड्रोकार्बन नहीं है ?
(क) ब्यूटेन
(ख) एथिलीन
(ग) एसीटिलीन
(घ) प्रोपिलीन
उत्तर – (क)
36. एस्टर (ester) की गंध होती है—
(क) फूल के समान
(ख) ईथर के समान
(ग) किरोसिन तेल के समान
(घ) गंधहीन
उत्तर – (क)
37. निम्नलिखित में प्लास्टिक है –
(क) पोलिएस्टर
(ख) टेफ्लॉन
(ग) रेयॉन
(घ) नियोप्रीन
उत्तर – (ख)
38. पोलिथीन बहुलक है—
(क) एसीटिलीन
(ख) एथिलीन
(ग) प्रोपिलीन
(घ) ब्यूटाडाइन
उत्तर – (ख)
39. मेथेन गैस हवा में जलती है –
(क) पीली लौ के साथ
(ख) नीली लौ के साथ
(ग) हरी लौ के साथ
(घ) लाल लौ के साथ
उत्तर – (ख)
40. साबुन
(क) Na या K लवण है
(ख) Na या K एस्टर है
(ग) एक अम्ल है
(घ) एक भस्म है
उत्तर – (क)
41. साबुन है—
(क) अम्ल
(ख) क्षार
(ग) लवण
(घ) इनमें से कोई नहीं
उत्तर – (ग)
42. कठोर जल में साबुन मलने से उत्पन्न होता है
(क) सोडियम कार्बोनेट
(ख) सोडियम बाइकार्बोनेट
(ग) कैल्सियम स्टियरेट
(घ) कैलिसयम कार्बोनेट
उत्तर – (ग)
43. अपमार्जक बनाने में उपयोग होता है
(क) ईथर
(ख)कास्टिक पोटाश
(ग) अल्कोहल
(घ) नमकाम्ल
उत्तर – (ग)
44. हीरा एवं ग्रेफाइट –
(क) समावयवी
(ख) समस्थानिक हैं
(ग) धातु हैं
(घ) कार्बन के अपररूप हैं
उत्तर – (घ)
45. वाशिंग पाउडर से कपड़ा धोना आसान है, क्योंकि यह-
(क) सस्ता होता है
(ख) आसानी से उपलब्ध होता है
(ग) चूर्ण के रूप में पाया जाता है
(घ) इनमें से कोई नहीं है
उत्तर – (ग)
46. एक से चार कार्बन परमाणु वाले एल्केन सामान्य ताप पर होते हैं
(क) ठोस
(ख) द्रव
(ग) गैस
(घ) अदृश्य
उत्तर – (ग)
47. 6 से अधिक कार्बन परमाणु वाले एल्केन सामान्य ताप पर होते हैं –
(क) ठोस
(ख) द्रव
(ग) गैस
(घ) इनमें से कोई नहीं
उत्तर – (ख)
48. प्राकृतिक बहुलक है –
(क) रबर
(ख) चमड़ा
(ग) प्लास्टिक
(घ) टेरीलिन
उत्तर – (क)
II. रिक्त स्थानों की पूर्ति करें।
1. पेट्रोलियम से भंजन की प्रक्रिया द्वारा प्राप्त हाइड्रोकार्बन को ……… कहते हैं।
उत्तर – एल्कीन
2. आण्विक सूत्र में समानता तथा संरचनात्मक सूत्र में भिन्नता प्रदर्शित करने वाले यौगिकों को ………..कहते हैं।
उत्तर – समावयवी
3. एल्केनों के प्रमुख स्रोत ……… हैं।
उत्तर – प्राकृतिक गैस एवं पेट्रोलियम
4. उच्च अणु द्रव्यमान वाले एल्केन …………… है ।
उत्तर – ठोस
5. छः से अठारह कार्बन परमाणु वाले एल्केन ………. है।
उत्तर – द्रव
6. मेथेन का एक अणु कार्बन डाइऑक्साइड के एक अणु की तुलना में ………… गुना अधिक ऊष्मा अवशोषित करता है।
उत्तर – 20
7. असंतृप्त यौगिक ………. अभिक्रिया में भाग लेते हैं।
उत्तर – योगशील
8. धातु के कार्बाइड अत्यन्त कठोर एवं उच्च गलनांक वाले हैं जिस कारण वे ………… के निर्माण में प्रयुक्त होते हैं।
उत्तर – रॉकेट
9. पोटाशियम डाइक्रोमेट के साथ अभिक्रिया करके एथेनॉल ……….. अम्ल उत्पन्न करता है।
उत्तर – एथेनोइक
10. ……….. मानव द्वारा संश्लिष्ट किया गया पहला रेशा है।
उत्तर – नायलॉन
11. क्लोरोप्रीन के बहुलक का नाम ……… है।
उत्तर – नियोप्रीन
12. टेट्राफ्लोरोएथिलीन के ……….. द्वारा टेफ्लॉन नामक प्लास्टिक बनता है।
उत्तर – बहुलीकरण
13. मेथेन एक ………… हाइड्रोकार्बन है।
उत्तर – एलिफैटिक
14. लाह एक ……….. प्लास्टिक है।
उत्तर – प्राकृतिक
15. नियोप्रीन एक ……… रेशा है।
उत्तर – संश्लिष्ट
16. प्रोपेन एक ………. हाइड्रोकार्बन है।
उत्तर – संतृप्त
17. समस्त अल्कोहलों में से ……… ‘सबसे अधिक उपयोगी है।
उत्तर – एथेनॉल
18. अल्कोहल सोडियम के साथ अभिक्रिया कर ……… गैस बनाते हैं।
उत्तर – हाइड्रोजन
19. …………का उपयोग ऑक्सी एसीटाइलीन ज्वाला प्राप्त करने में होता है
उत्तर – एथाइन
20. सबसे सरल एल्काइन को व्यापारिक स्तर पर ……… कहते हैं।
उत्तर – एसीटिलीन
21. ऐल्केन के अणु में जैसे-जैसे कार्बन परमाणुओं की संख्या बढ़ती जाती है, वैसे-वैसे इसके ………. की संख्या बढ़ती जाती है।
उत्तर – समावयिवों
22. अल्कोहल तथा जल के मिश्रण को ……कहते हैं।
उत्तर – प्रतिहिम
23. एथेनॉल में…. …..मिलाकर विकृत स्पिरिट बनाया जाता है।
उत्तर – मिथेनॉल
24. बेंजीन, एसीटिलीन का ……….है।
उत्तर – बहुलक
25. निकेल की उपस्थिति में वनस्पति तेल हाइड्रोजन से संकलन अभिक्रिया कर ………… में परिणत हो जाते हैं ।
उत्तर – वनस्पति घी
26. उत्प्रेरक की उपस्थिति में संपादित भंजन की क्रिया को ………. कहते हैं।
उत्तर – उत्प्रेरक भंजन
27. बिना उत्प्रेरक के संपादित भंजन की क्रिया को ………. कहते हैं।
उत्तर – तापभंजन
28. असंतृप्त हाइड्रोकार्बन मुख्यतः पेट्रोलियम के ………… से प्राप्त किये जाते हैं।
उत्तर – भजन
29. साठ कार्बन परमाणुयुक्त किसी ऐल्केन के ………… समावयवी हो सकते हैं।
उत्तर – करोड़ों
30. प्रतिहिम का हिमांक जल से…….. होता है।
उत्तर – कम
31. अधिक अणुभार वाले हाइड्रोजन को कम अणुभार वाले हाइड्रोकार्बन में परिवर्तित करने की क्रिया को ……… कहते हैं।
उत्तर – भंजन
32. एस्टरों की गंध …………के समान होती है।
उत्तर – फलों
33. हीरा विद्युत का ………… है।
उत्तर – कुचालक
34. सबसे अधिक सरल हाइड्रोकार्बन ……….. है।
उत्तर – मिथेन
35. मेथेन के अणु की आकृति ……….. होती है।
उत्तर – चतुष्फलक
36. ……….. को मार्श – गैस भी कहते हैं।
उत्तर – मिथेन
37. मवेशियों की आहारनाल में पाये जाने वाले जीवाणु …….. गैस उत्पन्न करते हैं।
उत्तर – मिथेन
38. प्राकृतिक रबर ……… का बहुलक है।
उत्तर – आइसोप्रीन
39. टेट्राफ्लोरोएथिलीन के बहुलीकरण द्वारा टेफ्नॉल नामक ………. बनता है।
उत्तर – प्लास्टिक
40. संकलन अभिक्रिया ………. हाइड्रोकार्बन का एक अभिलाक्षणिक गुण है।
उत्तर – असंतृप्त
III .सही / गलत का चयन करें।
1. एथेनॉल को शर्करा या स्टार्च के किण्वन द्वारा प्राप्त किया जाता है।
उत्तर –सही
2. 9-10% तनु ऐसीटिक अम्ल को सिरका कहा जाता है।
उत्तर –गलत
3. बेंजीन में 15 परमाणु होते हैं।
उत्तर –गलत
4. कोयला एक जीवाश्म ईंधन है।
उत्तर – सही
5. सबसे कठोर पदार्थ ग्रेफाइट है।
उत्तर – गलत
अतिलघु उत्तरीय प्रश्न
1. कार्बन की संयोजकता क्या है ?
उत्तर – 4
2. कार्बन द्वारा बनाए जाने वाले आबंधों की प्रकृति क्या होती है ?
उत्तर – सह – संयोजक
3. भूपर्पटी में कार्बन की प्रतिशत मात्रा क्या है ?
उत्तर – 0.02%
4. कार्बन की परमाणु संख्या क्या है ?
उत्तर – 6
5. कार्बन के बाहरी कोश में कितने इलेक्ट्रॉन होते हैं ?
उत्तर – 4
6. सहभागीयुग्म किसे कहते है ?
उत्तर – दो परमाणुओं के बीच साझेदारी में भाग लेने वाले इलेक्ट्रॉन को सहभागी युग्म कहते हैं।
7. कार्बन का कौन-सा अपररूप विद्युत का सुचालक होता है ?
उत्तर – ग्रेफाइट।
8. नाइट्रोजन (N2) में उपस्थित आबंध का नाम लिखें।
उत्तर – सहसंयोजी त्रिआबंध।
9. ऑक्सीजन परमाणुओं के मध्य उपस्थित बंध का नाम लिखें।
उत्तर – सहसंयोजी द्विआबंध।
10. क्या बनता है जब एथनॉल को तनु क्षारीय KMnO4 के साथ गर्म किया जाता है ?
उत्तर – एथेनॉइक अम्ल ।
11. रेक्टिफाइड स्प्रिट में कितने प्रतिशत ऐल्कोहॉल होता है ?
उत्तर – रेक्टिफाइड स्प्रिट में 95% एथेनॉल होता है।
12. एस्टरीकरण में भाग लेने वाले घटकों के नाम लिखें।
उत्तर – सांद्र सल्फ्यूरिक अम्ल की उपस्थिति में ऐल्कोहॉल और कार्बनिक अम्ल अभिक्रिया कराकर एस्टर बनाया जाता है।
13. किण्वन प्रक्रिया में कौन-सी गैस निकलती है ?
उत्तर – CO2 गैस ।
14. उस प्रक्रिया का नाम बताएँ जिसके द्वारा औद्योगिक रूप से ऐल्कोहॉल उत्पादन “होता है ?
उत्तर – उद्योगों में ऐल्कोहॉल का उत्पादन शोरे के किण्वन द्वारा होता है।
15. एंजाइम क्या है ?
उत्तर – एंजाइम जैविक उत्प्रेरक है।
16. कार्बन परमाणु को अपना अष्टक पूरा करने के लिए कितने इलेक्ट्रॉनों की आवश्यकता होती है ?
उत्तर – 4
17. सभी सजीव रचनाएँ किस तत्व पर निर्भर करती हैं ?
उत्तर – कार्बन।
18. कार्बन चार इलेक्ट्रॉन कैसे प्राप्त कर सकता है ?
उत्तर – C4- ॠणायन बनाकर।
19. कार्बन चार इलेक्ट्रॉन कैसे कम कर सकता है ?
उत्तर – C4+ धनायन बनाकर।
20. कार्बन इलेक्ट्रॉनों की साझेदारी अपने किस कक्षा से करता है ?
उत्तर – बाहरी कक्षा से
21. इलेक्ट्रॉन के सहभाजी युगल हाइड्रोजन के दो परमाणुओं के बीच कौन-सा बंद बनाते हैं ?
उत्तर – एकल बंध।
22. ईंधन के रूप में किस गैस का सबसे अधिक उपयोग होता है ?
उत्तर – मीथेन गैस का।
23. मीथेन किन दो ईंधन गैसों का प्रमुख घटक है ?
उत्तर – बायोगैस, सी. एन. जी. ।
24. CNG का पूरा नाम लिखिए।
उत्तर – कंप्रेस्ड नेचुरल गैस |
25. हीरा और ग्रेफाइट किससे बने होते हैं ?
उत्तर – कार्बन के अणुओं से।
26. हीरे की संरचना कैसी होती है ?
उत्तर – प्रबल त्रिआयामी संरचना।
27. ग्रेफाइट की संरचना कैसी होती है ?
उत्तर – षट्कोणीय।
28. ग्रेफाइट छने में कैसा लगता है ?
उत्तर – चिकना तथा सर्पणशील।
29. शुद्ध कार्बन को हीरे में कैसे बदला जा सकता है ?
उत्तर – अत्यधिक उच्च दाब और ताप पर अनुभूत करके।
30. फुलरेंस क्या है ?
उत्तर – कार्बन अपररूप की एक श्रेणी ।
31. सबसे पहले किस फुलरेंस को पहचाना गया था ?
उत्तर – C-60.
32. C-60 में कार्बन परमाणु किस रूप में व्यवस्थित होते हैं ?
उत्तर – फुटबॉल के रूप में।
33. फुलरेंस दिखने में कैसे लगते हैं ?
उत्तर – अमेरिकी आर्किटेक्ट बकमिंस्टर फुलर द्वारा डिजाइन किए गए जियोडेसिक गुंबद के समान।
34. फुलरेन का नामकरण किस आधार पर किया गया है ?
उत्तर – अमेरिकी आर्किटेक्ट बकमिंस्टर फुलर के नाम के आधार पर।
35. किस तत्व में बड़ी मात्रा में यौगिक तैयार करने का गुण विद्यमान है ?
उत्तर – कार्बन।
36. हाइड्रोकार्बन किसे कहते हैं ?
उत्तर – वे यौगिक जिनमें हाइड्रोजन और ऑक्सीजन निश्चित रूप से विद्यमान होते हैं।
37. कार्बन यौगिकों की लगभग संख्या कितनी है ? ।
उत्तर – लगभग तीन मिलियन
38. कार्बन में वृहद संख्या में यौगिक बचाने की क्षमता किस कारण आई है ?
उत्तर – सहसंयोजी बंध की प्रकृति के कारण।
39. कार्बन के संतृप्त यौगिक किसे कहते हैं ?
उत्तर – जब कार्बन परमाणु केवल एकल बंध से जुड़े होते हैं।
40. असंतृप्त यौगिक किसे कहते हैं ?
उत्तर – जब कार्बन परमाणुओं के बीच युगल या सिरा बंध हों।
41. हेटरोएटम किसे कहते हैं ?
उत्तर – हाइड्रोकार्बन शृंखला में वे तत्व जो एक या अधिक हाइड्रोजन को इस प्रकार प्रतिस्थापित करते हैं कि कार्बन की संयोजकता संतुष्ट रहती है, उन्हें हेटरोएटम कहते हैं।
42. समजातीय श्रेणी किसे कहते हैं ?
उत्तर – यौगिकों की ऐसी श्रृंखला जिसमें कार्बन शृंखला में स्थित हाइड्रोजन को एक ही प्रकार का प्रकार्यक समूह प्रतिस्थापित करता है, उसे समजातीय श्रेणी कहते हैं।
43. संतृप्त हाइड्रोकार्बन किस ज्वाला से जलते हैं ?
उत्तर – स्वच्छ ज्वाला से।
44. असंतृप्त हाइड्रोकार्बन किस ज्वाला से जलते हैं ?
उत्तर – धुयें वाली पीली ज्वाला से ।
45. कौन-से उत्प्रेरकों की उपस्थिति में असंतृप्त हाइड्रोकार्बन हाइड्रोजन जोड़कर संतृप्त हाइड्रोकार्बन देते हैं।
उत्तर – पैलेडियम या निकेल
46. क्षारीय पोटैशियम परमैगनेट या अम्लीकृत पोटैशियम डाइक्रोमेट अम्ल क्या हैं ?
उत्तर – ऑक्सीकरण कारक।
47. वनस्पति तेलों के हाइड्रोजनीकरण में किस उत्प्रेरक का प्रयोग किया जाता है ?
उत्तर – निकेल उत्प्रेरक का
48. फ्लुरीन की संरचना किस प्रकार की होती है ?
उत्तर – इसकी संरचना फुटबॉल की तरह 20 फलकीय होती है।
49. सिरके का एक उपयोग लिखें।
उत्तर – अचार – मुरब्बों के परिरक्षण में सिरके का उपयोग होता है।
50. क्या होता है जब एथेनॉल वायु की उपस्थिति में जलता है ?
उत्तर – एथेनॉल वायु में नीली ज्वाला के साथ जलता है। इस प्रक्रिया में CO2 और जल बनते हैं।
51. एथेनॉइक ऑल का साधारण नाम क्या है ?
उत्तर – ऐसीटिक अम्ल
52. साबुन में उपस्थित किन्हीं दो वसीय अम्लों के नाम लिखें।
उत्तर – स्टीयरिक अम्ल और पामिटिक अम्ल ।
53. साबुनीकरण अभिक्रिया क्या है ?
उत्तर – सोडियम हाइड्रोक्साइड की उपस्थिति में ग्लिसराइडों का जल अपघटन साबुनीकरण कहलाता है।
54. साबुन उद्योग का उपोत्पाद क्या है ?
उत्तर – ग्लिसरॉल या ग्लिीसरीन ।
55. साबुन बनाने में कौन-कौन से कच्चे माल आवश्यक हैं ?
उत्तर – जन्तु या वनस्पति वसा, सोडियम हाइड्रोक्साइड एवं सामान्य लवण (NaCl)।
56. मिसेल क्या होता है ?
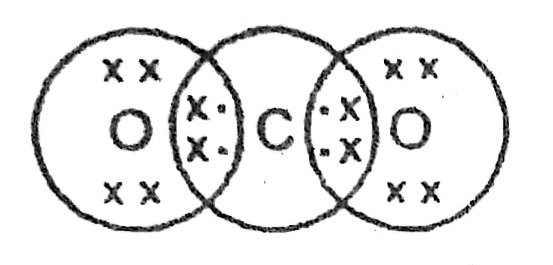
उत्तर – अपमार्जक या साबुन का आयनित अणु मिसेल कहलाता है ।
57. हाइड्रोजनीकरण में किस उत्प्रेरक का उपयोग किया जाता है ?
उत्तर – निकेल उत्प्रेरक ।
58. CO2 सूत्रवाले कार्बन डाइऑक्साइड की इलेक्ट्रॉन बिन्दु संरचना बताएँ।
उत्तर –
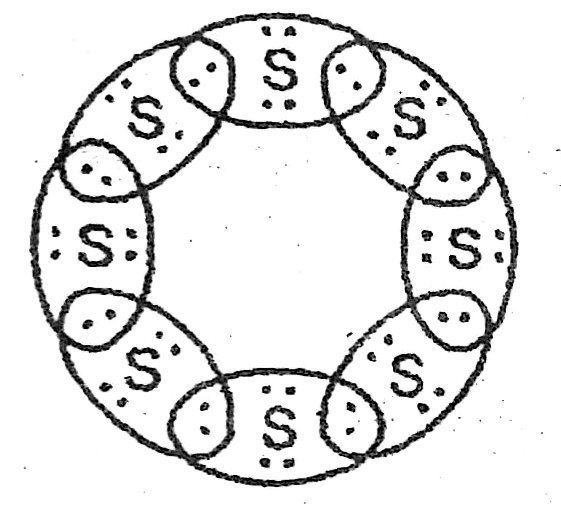
59. सल्फर (S) का इलेक्ट्रॉन बिन्दु संरचना दर्शाएँ।
उत्तर –
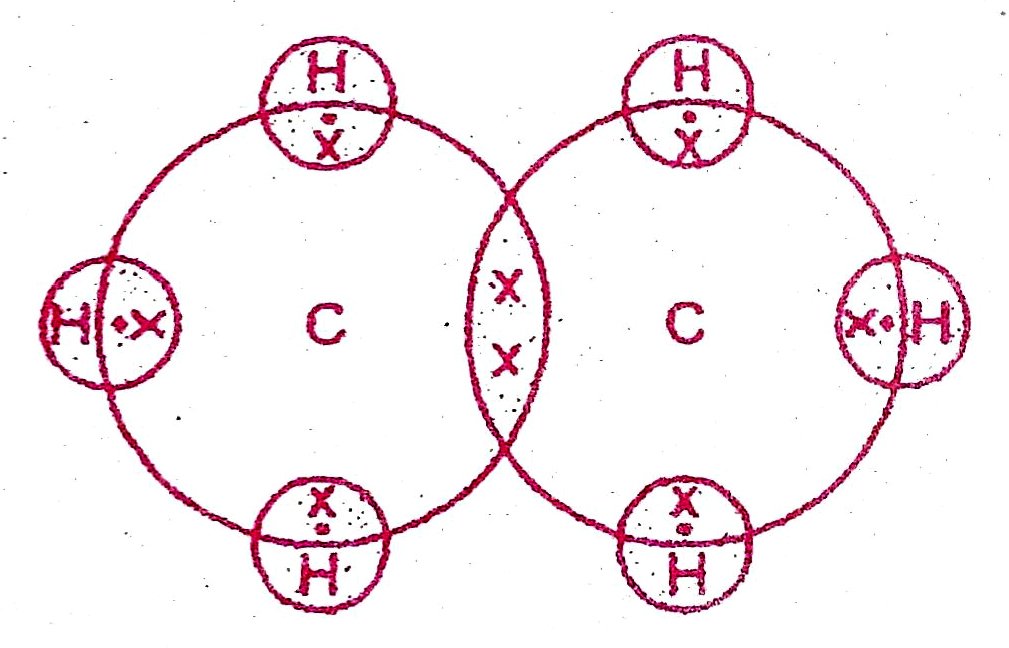
60. एथेन का इलेक्ट्रॉन बिन्दु संरचना दर्शाएँ।
उत्तर –
61. खाना बनाते समय यदि बर्तन की तली बाहर से काली हो रही है तो इसका मतलब है क्या ?
उत्तर – ईंधन पूरी तरह से नहीं जल रहा है ।
62. ऐथेन का आणविक सूत्र – C2H6 है। इसमें कितने सहसंयोजक आबंध है।
उत्तर – 7 सहसंयोजक आबंध है।
63. ब्यूटेनॉन, चतुष्कार्बन यौगिक है जिसका प्रकार्यात्मक समूह है ?
उत्तर – कीटोन।
64. ब्यूटेन के कितने समावयव होते हैं ?
उत्तर – दो।
65. निम्नलिखित में कौन असंतृप्त हाइड्रोकार्बन है ?
C2H4, C4H10, CH4, C6H14.
उत्तर – C2H4
लघु उत्तरीय प्रश्न
1. प्रतिहिम क्या है ?
उत्तर – अल्कोहल और पानी के मिश्रण का हिमांक पानी के हिमांक से बहुत कम होता है । इस मिश्रण को प्रतिहिम कहते हैं।
इसका उपयोग ठंडे प्रदेशों में वाहनों के रेडिएटर में होता है।
2. ऐल्किल समूह क्या है ? एक उदाहरण दें।
उत्तर – कार्बनिक यौगिक में क्रियाशील मूलक के अलावा जो मूलक होता है, उसे ऐल्किल मूलक कहा जाता है।
इसका सामान्य सूत्र CnH2n+1 होता है।
3. कार्बन किस कारण एक सार्वभौमिक तत्त्व है ?
उत्तर – प्रकृति में कार्बन के अत्यधिक यौगिक विस्तृत रूप से पाए जाते हैं, अन्य सभी तत्त्वों के यौगिकों की कुल संख्या लगभग पचास हजार है जबकि सिर्फ कार्बन के यौगिकों की कुल संख्या पाँच लाख से भी अधिक है। इसके अतिरिक्त कार्बन के यौगिकों से हमारे भोजन, वस्त्र निर्मित होते हैं तथा साज-शृंगार एवं युद्ध के सामान भी इन्हीं यौगिकों से बनते हैं। इन्हीं कारणों से कार्बन को एक सार्वभौमिक तत्त्व माना जाता है।
4. साबुन की रासायनिक प्रकृति क्या है ?
उत्तर – साधारण साबुन उच्च वसा अम्लों के सोडियम अथवा पोटैशियम लवण है। पामिटिक अम्ल से बना साबुन सोडियम पामिटेट (C15H31COONa ) है।
5. प्राकृतिक रबर या रबर क्या है ?
उत्तर – प्राकृतिक रबर आइसोप्रीन का बहुलक है, जिसे एक विशेष ढंग के पेड़ से प्राप्त दूध से तैयार किया जाता है।
6. संश्लिष्ट रेशा क्या है ?
उत्तर – संश्लिष्ट रेशा कई सरल अणुओं के संयोग से बना बहुलक है जिसे कृत्रिम तरीके से प्रयोगशाला में तैयार किया जाता है। रेयॉन, नाइलॉन, पॉलिएस्टर आदि प्रमुख कृत्रिम रेशे हैं ।
7. अपमार्जक क्या है ?
उत्तर – अपमर्जाक साबुन से भिन्न प्रकार का रासायनिक पदार्थ है जो सफाई के कार्य में प्रयुक्त होता है। इसे साबुनरहित साबुन भी कहते हैं। यह सफाई के लिए साबुन से अच्छा पदार्थ है। यह शीघ्र ही घुल जाता है तथा कठोर जल के साथ अविलेय कैल्सियम अथवा मैग्नीशियम लवण नहीं बनाता। अतः, कठोर जल के साथ भी अपमार्जक खूब झाग देता है तथा सफाई का कार्य इससे आसानी से किया जा सकता है। अपमार्जक में साबुन से ज्यादा आर्द्रता गुण पाया जाता है। सोडियम लौरिल सल्फेट (C12H25OSO3Na) तथा सोडियम पैराडोडेसिल बेंजीन सल्फोनेट (C12H25C6H4OSO2Na) कुछ प्रमुख अपमार्जक उदाहरण हैं।
8. टेफ्लॉन क्या है तथा इसके उपयोग क्या ?
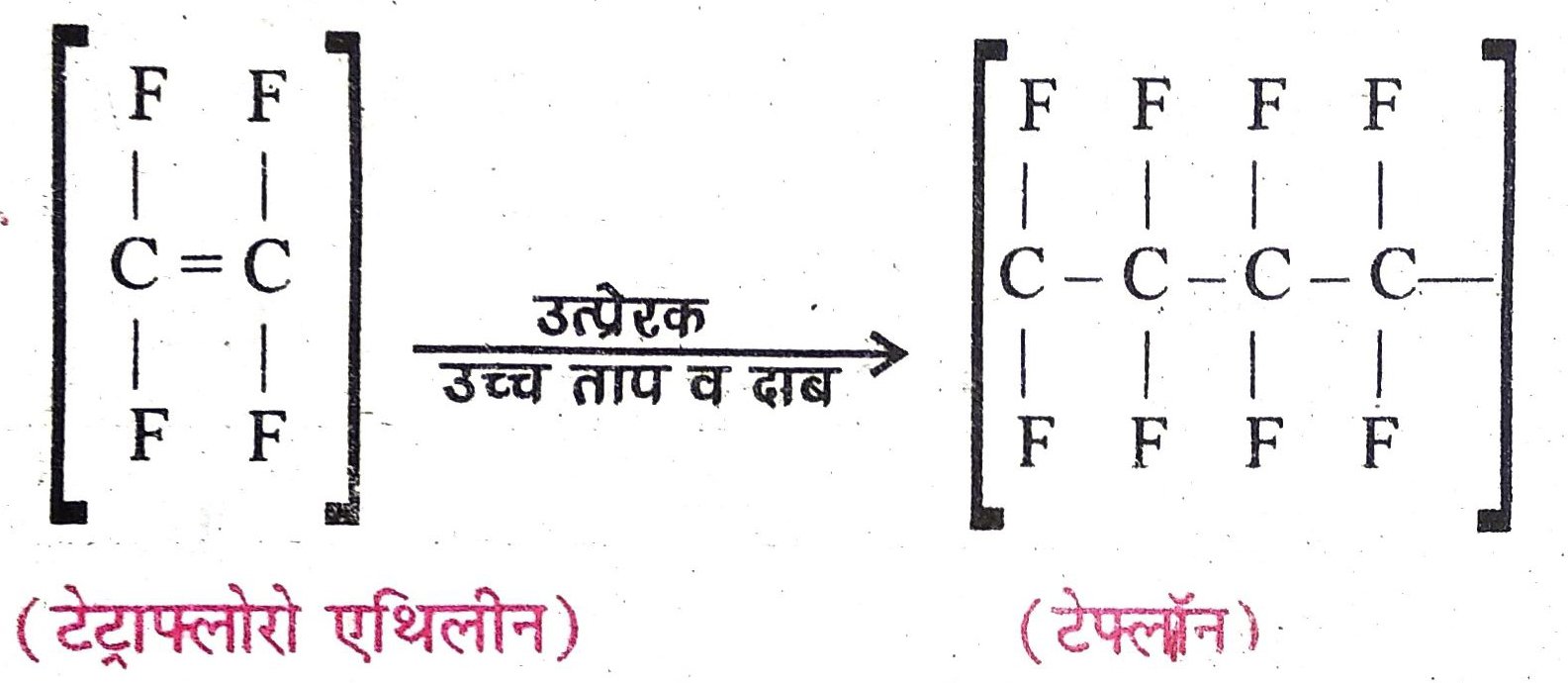
उत्तर – टेफ्लॉन एक अत्यंत उपयोगी प्लास्टिक है। टेट्राफ्लोरोएथिलीन को उत्प्रेरक की उपस्थिति में उच्च ताप एवं दाब पर गर्म करने से उसके अनेक अणु जुड़कर टेफ्लॉन नामक प्लास्टिक बनाते हैं।
9. सहसंयोजी आबंध क्या है ?
उत्तर – दो परमाणुओं के बीच इलेक्ट्रॉन के एक युग्म की साझेदारी के द्वारा बनने वाले आबंध सहसंयोजी आबंध कहलाते हैं ।
10. सहसंयोजी आबंध वाले यौगिकों के लक्षण लिखे।
उत्तर – सहसंयोजी यौगिकों के निम्नांकित लक्षण
(i) इनमें क्वथनांक व गलनांक कम होता है।
(ii) ये सामान्यत: गैस या द्रव अवस्था में होते हैं।
(iii) ये विद्युत के कुचालक होते हैं।
(iv) ये ध्रुवीय और अध्रुवीय यौगिक होते हैं।
11. संतृप्त यौगिक किसे कहते हैं ?
उत्तर – कार्बन परमाणुओं के बीच केवल एक आबंध से जुड़े कार्बन के यौगिक को संतृप्त यौगिक कहते हैं।
12. असंतृप्त यौगिक किसे कहते हैं ?
उत्तर – कार्बन परमाणुओं के बीच द्विआबंध अथवा त्रि-आबंध वाले कार्बन के यौगिक को असंतृप्त यौगिक कहते हैं।
13. हाइड्रोकार्बन क्या है ?
उत्तर – हाइड्रोकार्बन एवं कार्बन से बने यौगिक को हाइड्रोकार्बन कहते हैं ।
जैसे— CH4, C2H6 इत्यादि।
14. संतृप्त (ऐल्केन) या (पैराफिन) हाइड्रोकार्बन किसे कहते हैं ?
उत्तर – वैसे हाइड्रोकार्बन जिनमें कार्बन परमाणु की संयोजकता आपस में एकल बंध के द्वारा जुटी रहती है। उसे संतृप्त हाइड्रोकार्बन कहते हैं।
15. असंतृप्त हाइड्रोकार्बन किसे कहते हैं ?
उत्तर – वैसे हाइड्रोकार्बन जिनमें कार्बन परमाणु की संयोजकता आपस में द्विबंध अथवा त्रिबंध ( के द्वारा जुटी रहती है। उसे असंतृप्त हाइड्रोकार्बन कहते हैं।
16. संरचनात्मक समावयव किसे कहते हैं ?
उत्तर – ऐसे विभिन्न यौगिक जिनका अणुसूत्र समान हो लेकिन संरचना सूत्र भिन्न-भिन्न हो, संरचनात्मक समावयव कहते हैं ।
17. प्रकार्यात्मक समूह या अभिलक्षकीय समूह किसे कहते हैं ?
उत्तर – किसी कार्बनिक यौगिक में उपस्थित वे समूह जिनके ऊपर यौगिक का मुख्य गुण निर्भर करता है, उसे प्रकार्यात्मक समूह कहते हैं।
18. समजातीय श्रेणी किसे कहते हैं ?
उत्तर – कार्बनिक यौगिकों की वह श्रेणी जिसके सभी सदस्यों में एक ही अभिक्रियाशील समूह रहता है और जिसके किसी भी दो क्रमागत सदस्यों के आण्विक सूत्रों के बीच सदा –CH2 — का अंतर रहता है, उसे समजातीय श्रेणी कहते हैं।
जैसे – CH4 तथा C2 H6 में –CH2 – का अन्तर है।
CH2 H6 तथा C3 H8 में –CH2 – का अन्तर है।
19. साइक्लोपेंन्टेन का सूत्र तथा इलेक्ट्रॉन बिन्दु संरचना क्या होंगे ?
उत्तर – साइक्लोपेन्टेन का सूत्र C5H10 की इलेक्ट्रॉन बिन्दु संरचना निम्न है-
20. ऑक्सीकारक किसे कहते हैं ?
उत्तर – वे पदार्थ जिसमें अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है, उन्हें ऑक्सीकारक कहते हैं। जैसे – KMnO4, K2Cr2O7.
21. संकलन अभिक्रिया किसे कहते हैं ?
उत्तर – जब इथीन को निकेल उत्प्रेरक की उपस्थिति में H2 से अभिकृत करवाते हैं तब यह हाइड्रोजन इथीन से संयुक्त एथेन बनाता है। यह एक योगात्मक रासायनिक अभिक्रिया है।
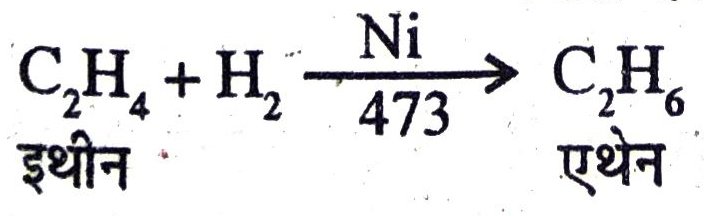
22. उत्प्रेरक किसे कहते हैं ?
उत्तर – उत्प्रेरक वे पदार्थ होते हैं जिनके कारण अभिक्रिया भिन्न दर से आगे बढ़ती है जो अभिक्रिया को प्रभावित नहीं करते हैं।
23. प्रतिस्थापन अभिक्रिया को परिभाषित करें।
उत्तर – संतृप्त कार्बनिक यौगिकों से किसी परमाणु अथवा परमाणु समूह को दूसरे परमाणु या परमाणु समूह द्वारा विस्थापित करने को प्रतिस्थापित कहते हैं। इस प्रकार की अभिक्रिया को प्रतिस्थापन अभिक्रिया कहते हैं।
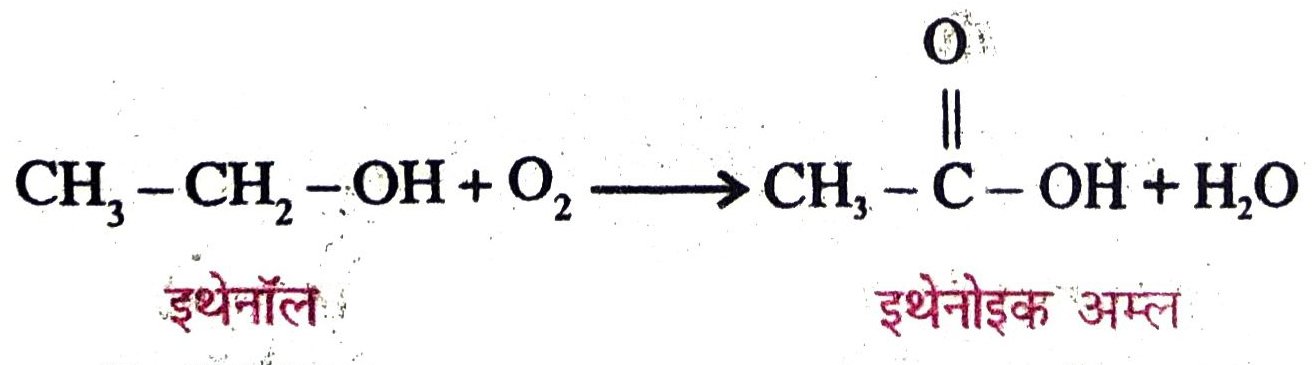
24. एथेनॉल का एथेनॉइक अम्ल में परिवर्तन को ऑक्सीकरण अभिक्रिया क्यों कहते हैं ?
उत्तर – एथेनॉइक अम्ल में एथेनॉल की अपेक्षा एक ऑक्सीजन परमाणु अधिक और दो हाइड्रोजन परमाणु कम होते हैं।
ऑक्सीजन की वृद्धि और हाइड्रोजन की कमी वाली रासायनिक अभिक्रिया ऑक्सीकरण अभिक्रिया कहलाती है।
25. ऑक्सीजन तथा एथाइन के मिश्रण का दहन वेल्डिंग के लिए किया जाता है। क्या आप बता सकते हैं कि एथाइन तथा वायु के मिश्रण का उपयोग क्यों नहीं किया जाता है ?
उत्तर – एथाइन ऑक्सीजन में जलकर ऑक्सी ऐसीटिलीन ज्वाला उत्पन्न करती है जिसका ताप लगभग 3000°C होता है। इसलिए इसका उपयोग वेल्डिंग में किया जाता है। एथाइन को वायु के साथ मिश्रित कर दहन की क्रिया कराने से एथाइन को दहन के लिए पर्याप्त ऑक्सीजन नहीं मिल पाता है क्योंकि वायु में नाइट्रोजन, कार्बनडाइऑक्साइड निष्क्रिय गैसें इत्यादि मिली रहती हैं जो ऑक्सीजन की आपूर्ति को बाधित करती है। अतः एथाइन के दहन के लिए वायु का उपयोग नहीं करते हैं।
26. एथीन से एथेनॉल किस प्रकार बनाया जाता है ?
उत्तर – सल्फ्यूरिक अम्ल (H2SO4) की उपस्थिति में एथीन में जल मिलाकर एथनॉल प्राप्त किया जाता है।

एथनॉल एथनॉल बनाने की उपर्युक्त विधि को औद्योगिक विधि भी कहते हैं।
27. क्या होता है जब KMnO4 और NaOH का जलीय विलयन गर्म एथनॉल में डाला जाता है ?
उत्तर – गर्म एथेनॉल में NaOH द्वारा क्षारीयकृत KMnO4 विलयन डालने पर बैंगनी रंग उड़ जाता है। यह एथेनॉल के ऑक्सीकरण के कारण होता है। जब पूरा ऐल्कोहॉल अभिकृत हो जाता है तब KMnO4 का रंग नहीं उड़ता है।
28. क्या होता है जब एथेनॉल सोडियम के साथ अभिक्रिया करता है ?
उत्तर – एथेनॉल सोडियम से अभिक्रिया कर सोडियम एथॉक्साइड और हाइड्रोजन गैस उत्सर्जित करता है।
2Na + 2CH3CH2OH → 2CH3CH2Na + H2
29. क्या होता है जब एथेनॉल सांद्र सल्फ्यूरिक अम्ल के साथ अभिक्रिया करता है।
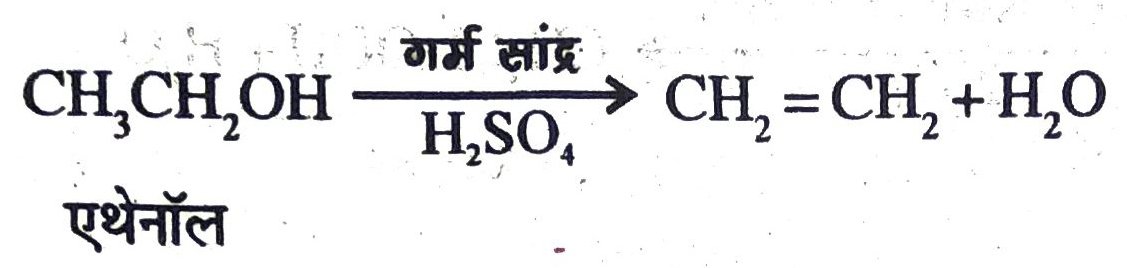
उत्तर – एथेनॉल को 443K ताप पर आधिक्य सांद्र H2SO4 अम्ल के साथ गर्म करने पर एथीन बनता है।
30. सल्फर के आठ परमाणुओं से बने सल्फर के अणु की इलेक्ट्रॉन बिंदु संरचना क्या होगी ? (संकेत : सल्फर के आठ परमाणु एक अंगूठी के रूप में आपस में जुड़े होते हैं।)
उत्तर – सल्फर का परमाणु क्रमांक 16 है।
K L M
2 8 6
सल्फर के बाहरी कक्ष में 6 इलेक्ट्रॉन हैं और इसे अष्टक पूरा करने के लिए 2 इलेक्ट्रॉनो की आवश्यकता होती है।
∴ प्रत्येक सल्फर परमाणु दो इलेक्ट्रॉनों की सहभागिता करेगा।
सल्फर की S8 संरचना मुकुट (Crown) के आकार की होती है।
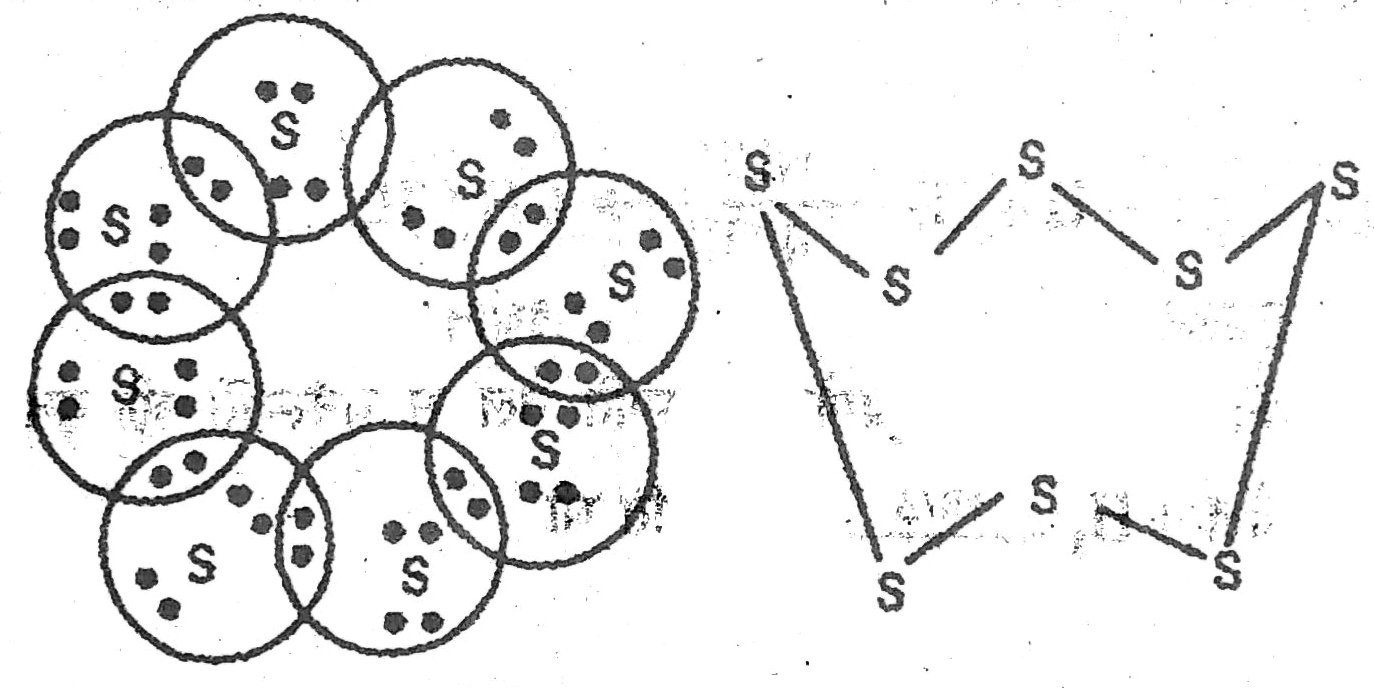
31. इथेनॉल से इथेनोइक अम्ल में परिवर्तन को ऑक्सीकरण अभिक्रिया क्यों कहते हैं ?
उत्तर – दहन करने से कार्बन यौगिकों को सरलता से ऑक्सीकृत किया जा सकता है। रासायनिक क्रिया से ऑक्सीकरण करके यह कार्य किया जा सकता है। एल्कोहल को कार्बोजाइलिक अम्ल में बदला जा सकता है।
ऑक्सीकरण का कार्य एल्कलाइन KMnO4 या अम्लीकृत K2Cr2O7 से किया जा सकता है।
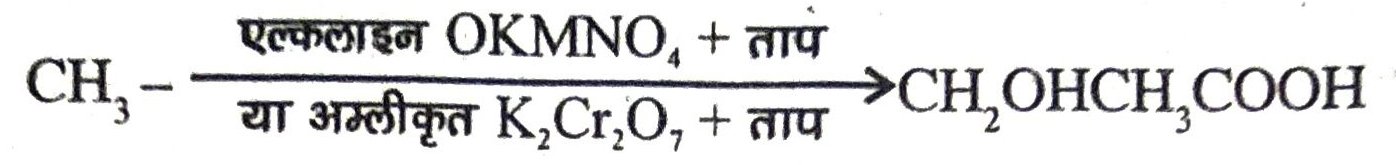
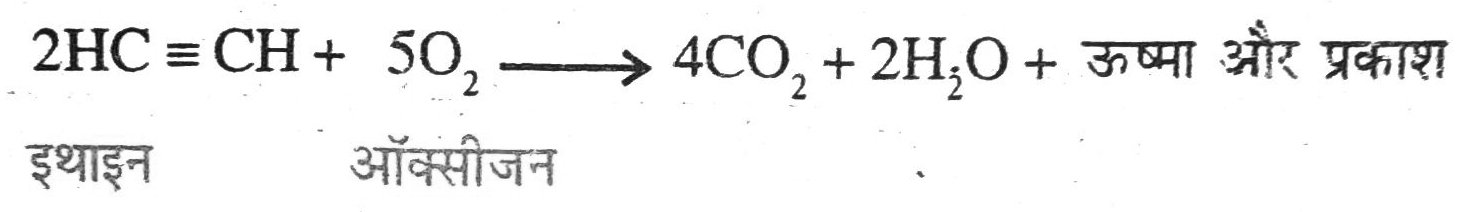
32. ऑक्सीजन तथा इथायन के मिश्रण का दहन वेल्डिंग के लिए किया जाता है। क्या आप बता सकते हैं कि इथायन तथा वायु के मिश्रण का उपयोग क्यों नहीं किया जाता ?
उत्तर – इथाइन असंतृप्त हाइड्रोकार्बन है जो वायु की उपस्थिति में दहन करते समय पीले रंग की ज्वाला और कज्जली धुआँ उत्पन्न करता है । इस धुएँ में कार्बन होता है। अपूर्ण दहन के कारण ऊष्मा ऊर्जा भी कम उत्पन्न होती है। इसलिए वेल्डिंग के लिए आवश्यक ऊष्मा ऊर्जा की प्राप्ति के लिए ऑक्सीजन और इथाइन का प्रयोग किया जाता है।
33. ऑक्सीकारक एजेंट क्या हैं ?
उत्तर – ऑक्सीकारक एजेंट वे पदार्थ हैं जो अन्य पदार्थों को ऑक्सीजन प्रदान करने की क्षमता रखते हैं। उदाहरण के लिए क्षारीय पोटैशियम परमैंगनेट और अम्लीय पोटैशियम डाइक्रोमेट इथेनॉल को इथानोइक अम्ल में बदल सकता है ।
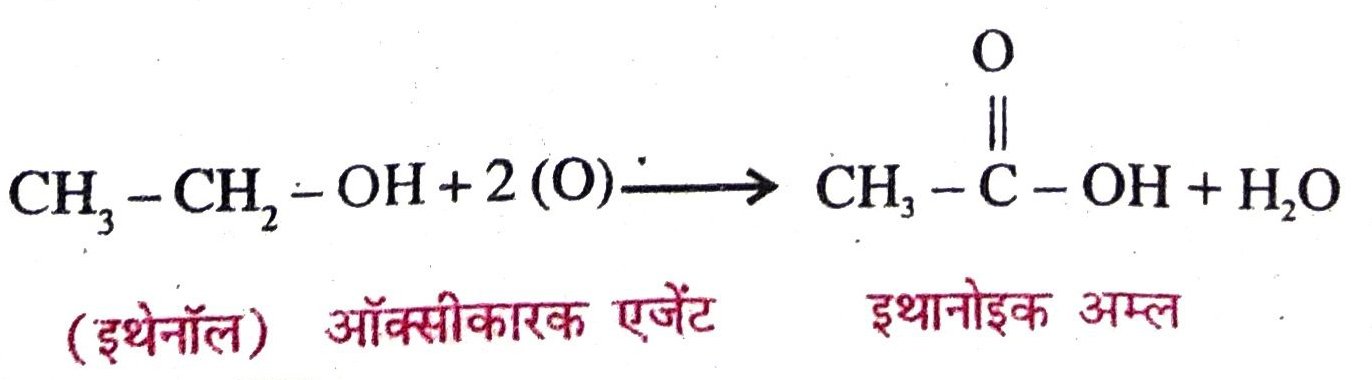
इथेनॉल के एक अणु में ऑक्सीजन का एक परमाणु होता है जबकि इथानोइक अम्ल में ऑक्सीजन के दो परमाणु होते हैं। इथेनॉल में ऑक्सीजन या एक परमाणु मिल जाता है और इथानोइक अम्ल बन जाता है। यह ऑक्सीजन या तो उसे क्षारकीय पोटैशियम परमैंगनेट या अम्लीय पोटेशियम डाइक्रोमेट से प्राप्त होता है। इसलिए ये दोनों पदार्थ ऑक्सीकारक एजेंट हैं।
34. क्या आप डिटरजेंट का उपयोग कर बता सकते हैं कि कोई जल कठोर है या नहीं ?
उत्तर – नहीं, डिटरजेंट कठोर जल के साथ झाग बनाता है। यह कठोर जल के साथ साबुन की तरह सफेद तलछट तैयार नहीं करता है।
35. लोग विभिन्न प्रकार से कपड़े धोते हैं। सामान्यतः साबुन लगाने के बाद लोग कपड़े को पत्थर पर पटकते हैं, डंडे से पीटते हैं, ब्रुश से रगड़ते हैं या वाशिंग मशीन में कपड़े रगड़े जाते हैं। कपड़ा साफ करने के लिए उसे रगड़ने की क्यों आवश्यकता होती है ?
उत्तर – साबुन या डिटरजेंट की लंबी हाइड्रोजन की पूंछ से ग्रीज या गंदगी जुड़ कर कपड़े की सतह और पानी पर आ जाती है। इसके कारण जल का सतही तनाव कम हो जाता है और जल पर गंदगी की तह जम जाती है। इसे कपड़े से हटाने के लिए कपड़े को पत्थर पर पटकना पड़ता है, पीटना पड़ता है, ब्रुश से रगड़ना पड़ता है या वाशिंग मशीन में उसे रगड़ना पड़ता है।
36. भौतिक एवं रासायनिक गुणधर्मों के आधार पर इथेनॉल एक इथेनोइक अम्ल में आप कैसे अंतर करेंगे ?
उत्तर – भौतिक गुणधर्म
1. गंध – इथेनोइक अम्ल की तेज दम घोंटने वाली गंध होती है जबकि इथेनॉल की मधुर गंध होती है।
2. गलनांक – इथेनॉल का गलनांक 156K होता है जबकि इथेनोइक अम्ल का 290K है ।
3. क्वथनांक— इथेनोइक अम्ल का क्वथनांक 391K है जबकि इथेनॉल का 351K
रासायनिक गुणधर्म –
1. सोडियम से क्रिया— इथेनॉल सोडियम से क्रिया कर H2 गैस उत्पन्न करता है लेकि इथेनोइक अम्ल सोडियम से क्रिया नहीं करता।
2Na + 2CH3 CH2OH → 2CH3CH2O–Na+H2
2. कार्बोनेट तथा बाइकार्बोनेट से क्रिया – इथेनॉल सोडियम कार्बोनेट और सोडिय बाइकार्बोनेट से क्रिया नहीं करता जबकि इथेनोइक अम्ल इनसे क्रिया कर CO2 गैस उत्पन्न करता
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
CH3COOH + Na HCO3 → CH3COONa + H2O + CO2
37. जब साबुन को जल में डाला जाता है तो मिसेल का निर्माण क्यों होता है ? क्या इथेनॉल जैसे दूसरे विलायकों में भी मिसेल का निर्माण होगा ?
उत्तर – जब साबुन को जल में डाला जाता है तो इसके अणु के दो सिरे दो भिन्न गुणधर्म, को प्रकट करते हैं। जल में विलयशील हाइड्रोफिलिक और हाइड्रोकार्बन में विलयशील हाइड्रोफोबिका यह जल में घुलनशील नहीं होते। पानी में डालने से साबुन का आयनिक सिरा जल के अंदर होता है जबकि हाइड्रोकार्बन पूँछ (दूसरा सिरा) जल के बाहर होता है। ऐसा अणुओं का बड़ा समूह बनने के कारण होता है जिसमें हाइड्रोफोबिक पूँछ बड़े समूह के भीतरी हिस्से में होता है जबकि उसका आयनिक सिरा बड़े समूह की सतह पर होता है
साबुन इथेनॉल जैसे दूसरे विलायकों में घुल जाता है इसलिए मिसेल का निर्माण नहीं करता।
38. कार्बन एवं उसके यौगिकों का उपयोग अधिकतर कार्यों में ईंधन के रूप में क्यों. किया जाता है ?
उत्तर – जब कार्बन और इसके यौगिकों को अधिक वायु या ऑक्सीजन की उपस्थिति में जलाया जाता है तो बहुत अधिक मात्रा में ऊष्मा और प्रकाश की उत्पत्ति होती है। इन्हें एक बार जला दिए जाने के बाद ये निरंतर जलते रहते हैं। इन्हें अधिक ऊष्मा ऊर्जा न करने की आवश्यकता नहीं होती।
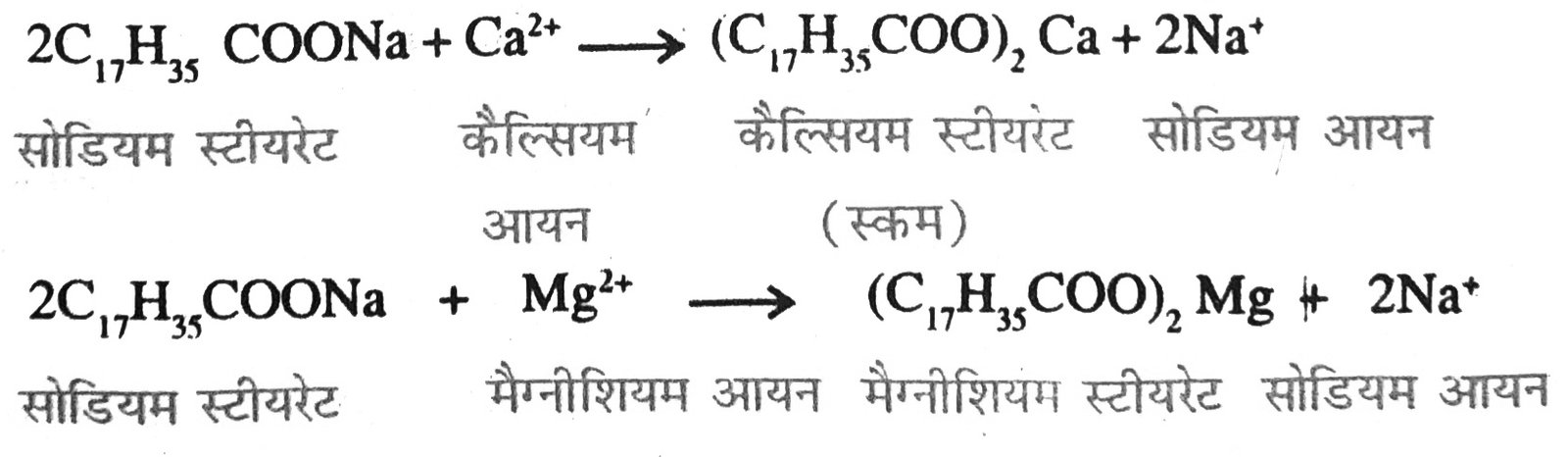
39. कठोर जल को साबुन से उपचारित करने पर मैल के निर्माण को समझाएँ ।
उत्तर – कठोर जल में कैल्सियम और मैग्नीशियम के आयन होते हैं। ये साबुन के अणुओं से जुड़ कर अघुलनशील पदार्थ (स्कम) बनाते हैं।
40. हाइड्रोजनीकरण क्या है ? इसका औद्योगिक उपयोग क्या है ?
उत्तर – असंतृप्त हाइड्रोकार्बन का निकेल या पैलेडियम उत्प्रेरकों की उपस्थिति में हाइड्रोजन का मिलना और संतृप्त हाइड्रोकार्बन में बदलना हाइड्रोजनीकरण कहलाता है।
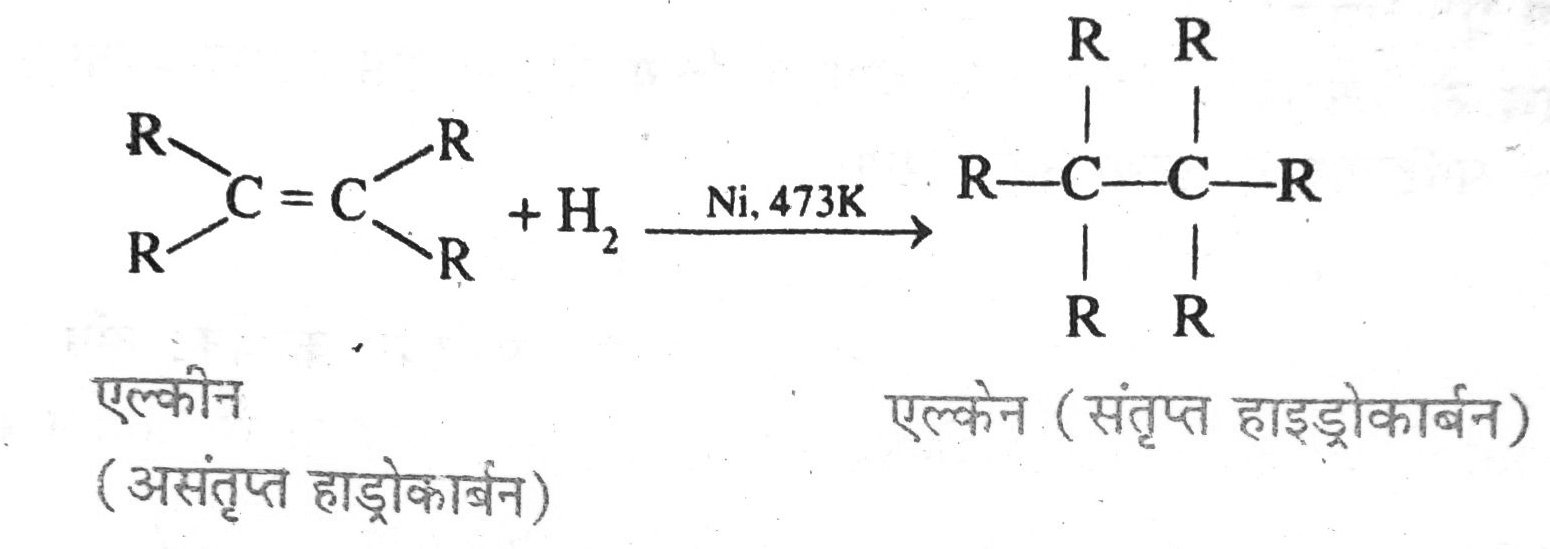
औद्योगिक उपयोग इस प्रक्रिया से वनस्पति तेलों को वनस्पति घी में बदला जाता है।
वनस्पति तेलों में कार्बन परमाणु के दोहरे बंध होते हैं। जब हाइड्रोजन गैस को निकेल उत्प्रेरक की उपस्थिति में 473K पर उनसे गुजारा जाता है तो वे ठोस वसा में बदल जाते हैं।
41. दिए गए हाइड्रोकार्बन – C2H6, C3H8, C3H6, C2H2 एवं CH4 में किस में सकलन अभिक्रिया होती है ?
उत्तर – केवल असंतृप्त हाइड्रोकार्बन ही योग अभिक्रिया को करते हैं। इसलिए C2H6, C3H8, C3H6, C2H2, CH4 में से केवल C3H6 और C2H2 ही योग अभिक्रिया करेंगे।
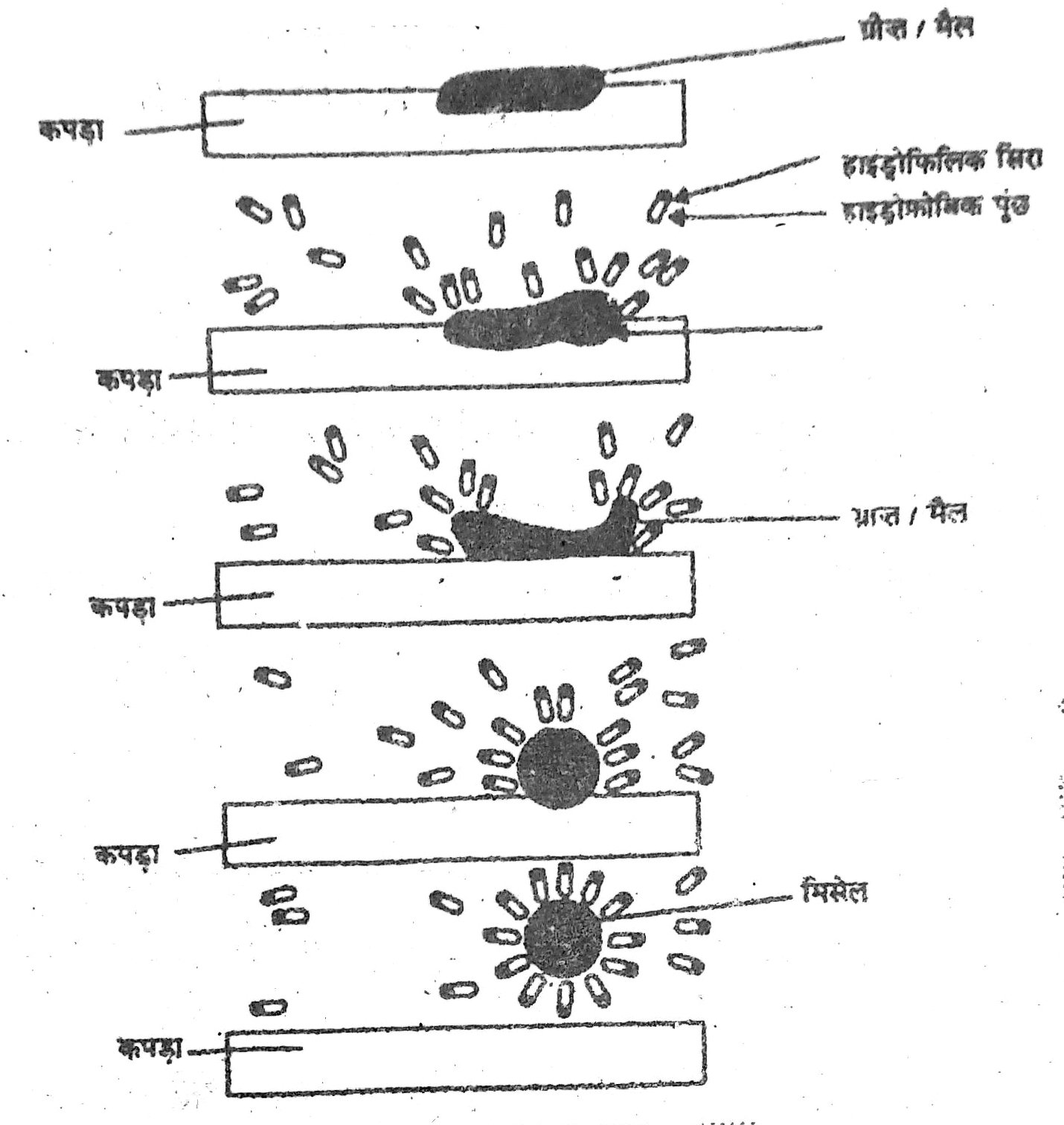
42. साबुन की सफाई प्रक्रिया की क्रिया-विधि समझाएँ ।
उत्तर – साबुन सफाई करने की विशेष प्रणाली पर आधारित होते हैं। इनमें ऐसे अणु होते हैं जिसके दोनों सिरों के विभिन्न गुणधर्म होते हैं। जल में घुलनशील एक सिरे को हाइड्रोफोलिक कहते हैं।

हाइड्रोकार्बन में विलयशील दूसरे सिरे की हाइड्रोफोलिक कहते हैं। साबुन जल की सतह पर होता है तब इसके अणु अपने को ऐसे व्यवस्थित कर लेते हैं कि इसका आयनिक सिरा जल के भीतर होता है जबकि हाइड्रोकार्बन पूँछ (दूसरा छोर) जल के बाहर होता है। जल के अंदर इन अणुओं की विशिष्ट व्यवस्था होती है जिससे इसका हाइड्रोकार्बन सिरा जल के बाहर बना होता है। ऐसा अणुओं का बड़ा समूह (कलस्टर) बनने के कारण होता है। इस हाइड्रोफोबिक पूँछ कलस्टर के भीतरी हिस्से में होता है जबकि उसका आयनिक सिरा कलस्टर की सतह पर होता है। इस संरचना को मिसेल कहते हैं। मिसेल के रूप में साबुन सफाई करने में सक्षम होता है। तैलीय मैल मिसेल के केंद्र में एकत्र हो जाते हैं। मिसेल, विलयन में कोलॉइड के रूप में बने रहते हैं तथा आयन-आयन विकर्षण के कारण वे अवक्षेपित नहीं होते। इस प्रकार मिसेल में तैरते मैल आसानी से हटाये जा सकते हैं। साबुन के मिसेल इससे प्रकाश को प्रकीर्णित कर सकते हैं। जिसके कारण साबुन का घोल बादल जैसा दिखता है।
43. ग्रेफाइट की संरचना लिखिए तथा यह बताइये कि ग्रेफाइट इतना मुलायम क्यों है ?
उत्तर – ग्रेफाइट की संरचना – ग्रेफाइट में प्रत्येक कार्बन परमाणु केवल तीन पड़ोसी कार्बन परमाणुओं से सहसंयोजक बंधों द्वारा जुड़ा होता है तथा षट्कोणीय जाल की परतें बनाता है। हीरे की तुलना में ग्रेफाइट में कार्बन परमाणुओं के बीच की दूरी अधिक होती है।
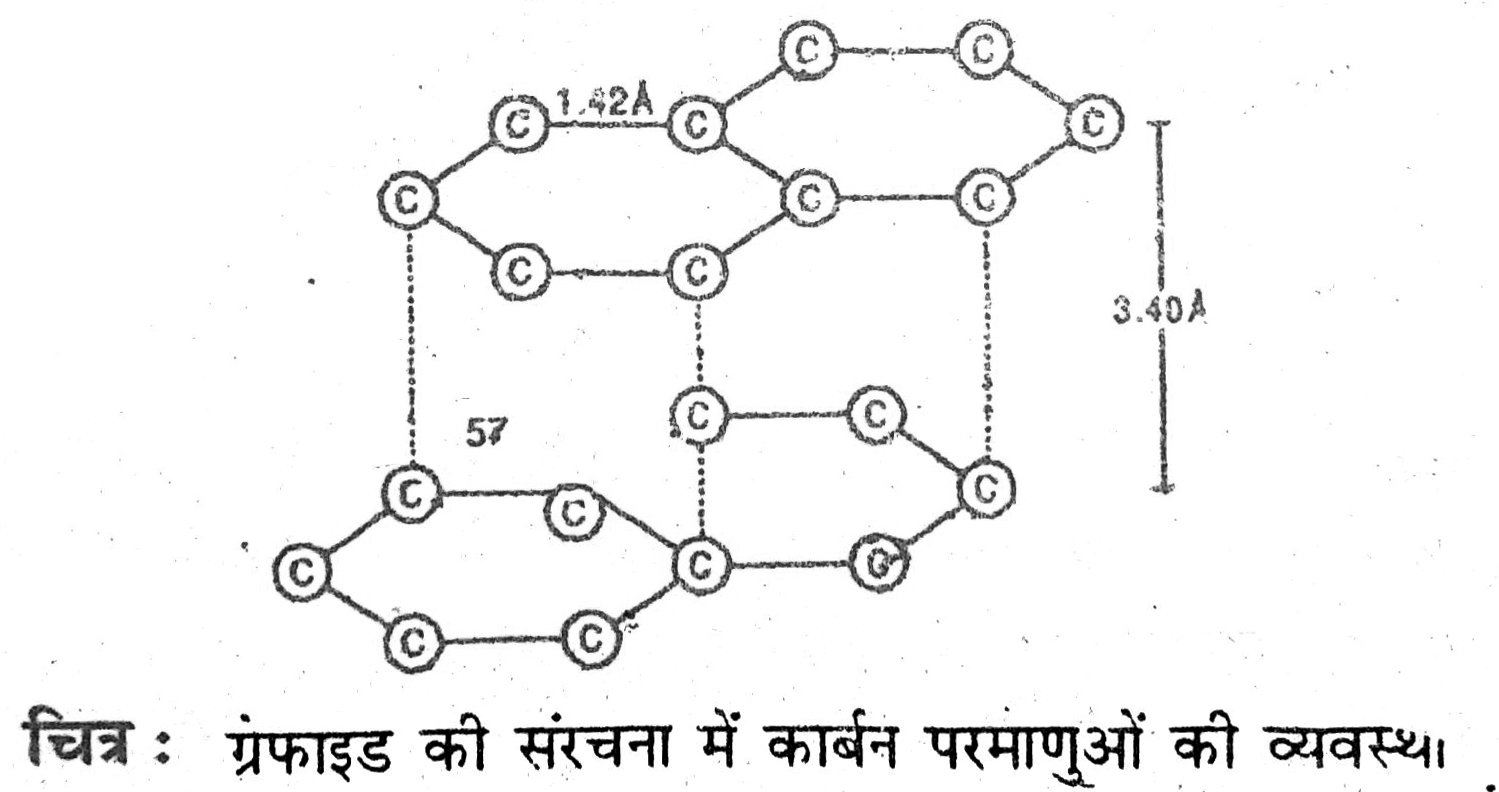
ऊपर नीचे की परतों की इस दूरी के कारण विपरीत परतों में स्थित कार्बन परमाणुओं क मध्य सहसंयोजक बंध बनने की संभावना समाप्त हो जाती है जिससे चौथा इलेक्ट्रॉन स्वतंत्र रह जाता है। ग्रेफाइट की ये परतें एक-दूसरे के ऊपर आसानी से फिसल सकती हैं, जिसके कारण ग्रेफाइट में स्नेहक गुण होते हैं तथा यह स्पर्श करने में मुलायम तथा चिकना लगता है।
44. हीरे तथा ग्रेफाइट के उपयोग लिखिए।
उत्तर – हीरे के – उपयोग-
(i) हीरा सबसे कठोर पदार्थ है इसलिए इसका उपयोग दूसरे पदार्थों को काटने के लिए किया जाता है।
(ii) इसकी अद्वितीय चमक के कारण इसका उपयोग आभूषणों को बनाने में किया जाता है।
(iii) इसका उपयोग पृथ्वी की चट्टानों में छिद्र करने हेतु किया जाता है।
(iv) नुकीले किनारे वाले हीरे शल्य चिकित्सकों को आँखों से मोतियाबिंद हटाने के लिए उत्तम औजार प्रदान करते हैं।
(v) ऊष्मीय विकिरणों के लिए इसकी असाधारण संवेदनशीलता तथा हानिप्रद विकिरणों को तुरंत हटा देने की क्षमता इसमें होती है जिसके कारण इसको अति यथार्थ तापमापी बनाने में प्रयुक्त किया जाता है।
ग्रेफाइट के उपयोग –
(i) यह विद्युत का सुचालक है, इसलिए इसका उपयोग शुष्क सेल, विद्युत आर्क में इलेक्ट्रोड के रूप में होता है।
(ii) इससे पेंसिल, काला रंग, काला पेंट बनाए जाते हैं।
(iii) इसके स्नेहक गुण के कारण इसका उपयोग उच्च ताप पर मशीनों को चिकना रखने में होता है।
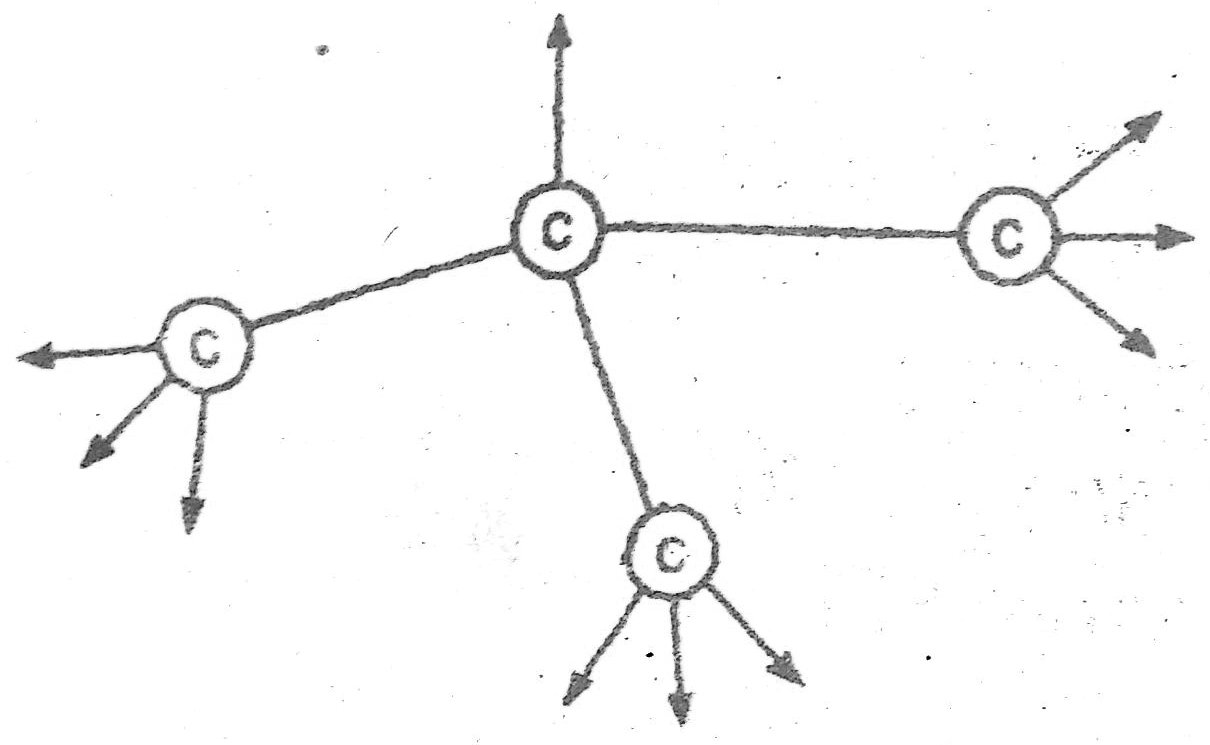
चित्र: हीरे की संरचना में कार्बन परमाणुओं की व्यवस्था
(iv) इसके उच्च गलनांक के कारण ग्रेफाइट की बनी क्रूसीबल कुछ धातुओं को पिघलाने हेतु उपयोग होती है।
45. हीरे के अत्यधिक चमकने के कारण बताइए।
उत्तर – हीरा एक पारदर्शक पदार्थ है जिसका अपवर्तन गुणांक बहुत अधिक होता है। इसमें से गुजरने वाली प्रकाश किरणों का मार्ग से विचलन बहुत अधिक होता है। इसके अनेक प्रतिच्छेदी तलों के अनुरूप उच्चकोटि का विचलन होता है। जब इन प्रतिच्छेदी तलों को पॉलिश कर दिया जाए तो यह हीरे को एक विशेष प्रकार की चमक प्रदान करते हैं। जिससे हीरा अत्यधिक चमकता है।
46. प्राकृतिक तथा कृत्रिम विधि से हीरे किस प्रकार बनते हैं ?
उत्तर – प्रकृति में हीरे पृथ्वी में लगभग 150km की गहराई पर उपस्थित कार्बन से बनते हैं जहाँ 70000 वायुमंडलीय दाब तथा लगभग 1500°C हैं। इस प्रकार बने हुए हीरे कई बार विशिष्ट किंबरलाइट चट्टान के साथ सतह पर आ जाते हैं। कृत्रिम रूप से इसे कुछ विशेष उत्प्रेरकों की उपस्थिति में अत्यधिक उच्च दाब पर ग्रेफाइट को गर्म करने पर हीरे में बदला जा सकता है।
47. हीरे के चार भौतिक गुण लिखें।
उत्तर – (i) हीरा एक पारदर्शक पदार्थ है।
(ii) हीरा कठोरतम पदार्थ है।
(iii) हीरे का घनत्व 3,519 kg/m 3 है ।
(iv) हीरे का अपवर्तनांक 2.45 है।
48. हीरे का प्रयोग आभूषणों में क्यों किया जाता है ? कारण बताएँ।
उत्तर – हीरे का अपवर्तन गुणांक 2.45 है जो संसार में सबसे अधिक है। इतने उच्च अपवर्तनांक के कारण ही यह बहुत अधिक चमकता है। इसका क्रांतिक कोण (critical angle) 24° है। यह काफी कम है। इसी कारण से इससे गुजरने वाली प्रकाश किरणों का अपने मार्ग से विचलन बहुत अधिक होता है। इसलिए इसे थोड़ा बहुत हिलाने-डुलाने पर ही इसके भीतर रंगों का सुंदर दृश्य उत्पन्न हो जाता है। इसके अनेक तलों के अनुरूप उच्च कोटि का विदलन (clevage) होता है। जब इन तलों को पॉलिश कर दिया जाता है तो वह इसको अद्वितीय चमक उत्पन्न करता है। इसी कारण हीरे का प्रयोग आभूषणों में किया जाता है।
49. हीरे का प्रयोग परिशुद्ध तापमापी का में क्यों किया जाता है ?
उत्तर – हीरा ताप का अति सूक्ष्मग्राही है। इस गुण के कारण हीरे प्रयोग परिशुद्ध तापमापी में किया जाता है।
50. ग्रेफाइट के भौतिक गुण लिखिए।
उत्तर – (i) ग्रेफाइट एक चमकदार काला पदार्थ है।
(ii) ग्रेफाइट मुलायम तथा चिकना लगता है।
(iii) यह विद्युत का सुचालक है।
(iv) इसका घनत्व 2250kg/m 3 है।
(v) इसका गलनांक 3700°C है।
51. क्या कारण है कि ग्रेफाइट विद्युत् का सुचालक है?
उत्तर – ग्रेफाइट में प्रत्येक कार्बन परमाणु केवल तीन कार्बन परमाणुओं से सहसंयोजक बंधों द्वारा जुड़ा रहता है तथा जिस कारण इसमें षट्कोणीय जाल की परतें बनाते हैं। इसमें कार्बन परमाणुओं के बीच दूरी अधिक होती है। परतों के मध्य इस दूरी के कारण विपरीत परतों में स्थित कार्बन परमाणुओं के बीच सहसंयोजक बंधों के बनने की संभावना समाप्त हो जाती है और चौथा संयोजन इलेक्ट्रॉन स्वतंत्र छूट जाता है। इसीलिए ग्रेफाइट में इलेक्ट्रॉनों का प्रवाह आसानी से हो जाता है और ग्रेफाइट विद्युत का सुचालक हो जाता है।
52. सजातीय श्रेणी के लक्षण लिखें।
उत्तर – (i) किसी भी सजातीय श्रेणी के सभी सदस्यों को एक सामान्य सूत्र के द्वारा प्रकट किया जा सकता है। जैसे एल्केन सजातीय श्रेणी के सभी सदस्यों को एक ही सामान्य सूत्र CnH2n+2 द्वारा प्रकट किया जाता है।
(ii) किसी भी सजातीय श्रेणी के दो साथ-साथ वाले सदस्यों में ( –CH2) ग्रुप का अंतर होता है।
(iii) किसी भी सजातीय श्रेणी के सभी सदस्य एक जैसे रासायनिक गुण प्रकट करते हैं।
(iv) किसी भी सजातीय श्रेणी के सदस्यों के भौतिक गुणों में अणु भार बढ़ने के साथ-साथ क्रमिक परिवर्तन होता है।
(v) किसी भी सजातीय श्रेणी के सदस्यों को एक सी विधियों द्वारा तैयार किया जा सकता है।
53. उन पदार्थों को जिनमें 60 कार्बन परमाणु एक-दूसरे से जुड़कर अणु बनाते हैं, फुलरीन क्यों कहते हैं ?
उत्तर – जिन पदार्थों में 60 कार्बन परमाणु एक-दूसरे से जुड़कर अणु बनाते हैं उन्हें फुलरीन कहते हैं। अमेरिकी वास्तुकार बकमिंस्टर फुलर ने त्रिविमीय ज्यामिति वाले गुंबदलों की रचना की है जिन्हें दृढ़ता प्रदान करने के लिए पंचकोणीय और षट्कोणीय व्यवस्था का उपयोग किया गया है। फुलरीन अणुओं की संरचना इन गुंबदों से मिलती-जुलती प्रतीत होती है। इसलिए उनके नाम पर इन्हें फुलरीन कहते हैं।
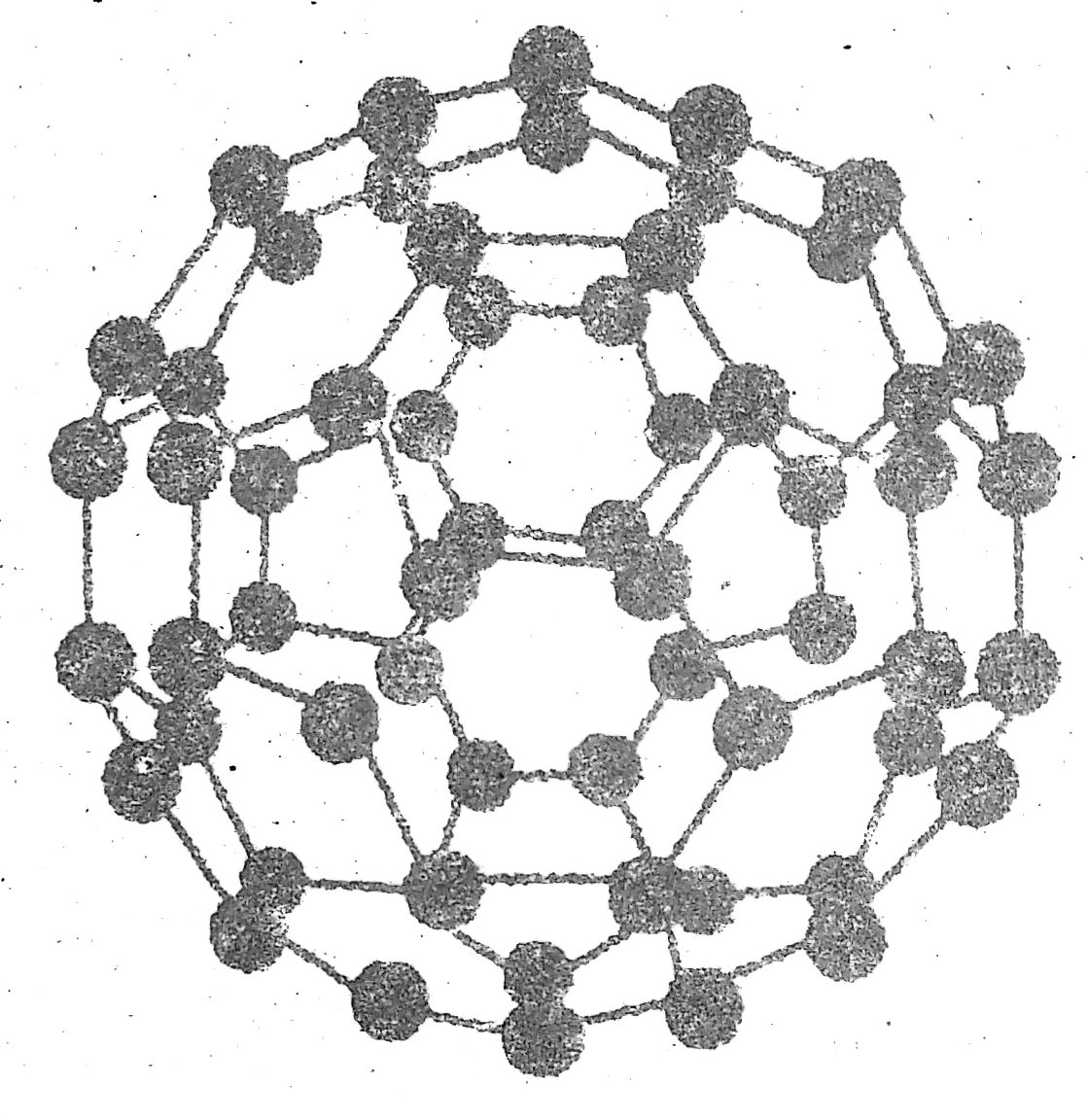
चित्र: फुलरीन के गोलीय C60 के अणु में कार्बन अणुओं की व्यवस्था
54. भविष्य में फुलरीन के कुछ संभावित उपयोग लिखिए।
उत्तर – भविष्य में फुलरीन के संभावित उपयोग अतिचालक, अर्द्धचालक, स्नेहक, उत्प्रेरक, विद्युत् की तारों तथा प्लास्टिक को प्रबचित करने के लिए तंतुओं को बनाने में होंगे। यह खोज भी की जा रही है कि इन पर आधारित यौगिकों से एड्स के वायरस की रोकथाम की जा सके।
55. फुलरीन प्रयोगशाला में कैसे बनाए जा सकते हैं ?
उत्तर – प्रयोगशाला में ग्रेफाइट की वाष्प को हीलियम गैस में अत्यधिक उच्च ताप तक गर्म तथा संपीड़ित कर फुलरीन बनाए जा सकते हैं।
56. एल्कोहल के सामान्य गुण लिखें।
उत्तर – (i) अधिकांश सामान्य ऍल्कोहल द्रव हैं।
(ii) ये वाष्पशील हैं तथा आसानी से जलते हैं।
(iii) ये सोडियम के साथ क्रिया करके हाइड्रोजन बनाते हैं।
(iv) ये एल्कोहल विद्युत् संचालन नहीं करते।
57. एल्कोहल का परीक्षण दीजिए।
उत्तर – (i) एस्टर टेस्ट (Ester Test)– जब एल्कोहल को एसीटिक अम्ल के साथ, गंधक अम्ल की उपस्थिति में गर्म किया जाता है तो मधुर सुगंध वाला ‘एस्टर’ बनता है।
(ii) सोडियम टेस्ट (Sodium Test)— सोडियम धातु के साथ क्रिया करके एल्कोहल सदा हाइड्रोजन गैस बनाते हैं।
58. मिथाइल एल्कोहल किस प्रकार तैयार किया जाता है ?
उत्तर – मिथाइल एल्कोहल को वुड एल्कोहल या वुड स्प्रिट भी कहते हैं। इसे लकड़ी के भंजन से प्राप्त किया गया था। इसे तैयार करने के लिए लकड़ी के छोटे-छोटे टुकड़ों को वायु की अनुपस्थिति में गर्म किया जाता है। मिथाइल एल्कोहल एक उत्पाद के रूप में प्राप्त हो जाता है। आजकल इसे जल गैस तथा हाइड्रोजन के मिश्रण को 300°C तक गर्म करने से प्राप्त किया जाता है।
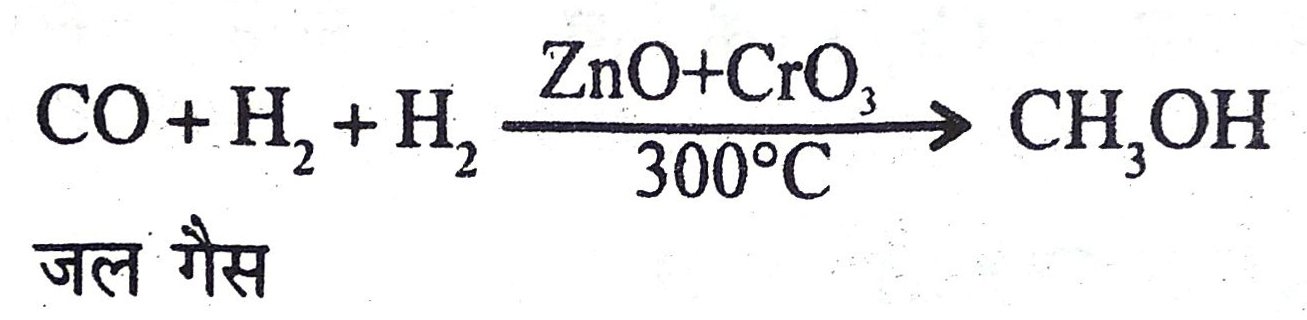
59. मिथाइल एल्कोहल के उपयोग लिखिए।
उत्तर – (i) विकृत स्प्रिट बनाने के लिए।
(ii) स्प्रिट लैंपों में।
(iii) लकड़ी को पॉलिश करने के विलायक रूप में।
(iv) कृत्रिम रेशों तथा सुगंधित पदार्थ तैयार करने में।
60. विकृत स्प्रिट (Denatured Spirit) किसे कहते हैं ? इसके दो उपयोग लिखिए।
उत्तर – मिथाइल एल्कोहल में इथाइल एल्कोहल को मिलाने से बना यौगिक विकृत स्प्रिट कहलाता है।
उपयोग— (i) इसका प्रयोग स्प्रिट लैंपों में होता है।
(ii) फर्नीचर को पॉलिश करने में काम आता है।
61. मिथाइल-एल्कोहल के भौतिक गुण लिखें।
उत्तर – मिथाइल-एल्कोहल के भौतिक गुण
(i) यह रंगहीन तरल है।
(ii) यह जहरीला है।
(iii) यह पूर्ण कारण दीप्त ज्वाला के साथ जलता है।
(iv) इसका क्वथनांक 65°C है।
62. इथाइल एल्कोहल के भौतिक गुण लिखें।
उत्तर – (i) यह एक रंगहीन तरल पदार्थ है।
(ii) यह अत्यधिक ज्वलनशील है।
(iii) 20°C पर इसका घनत्व 0.789 है।
(iv) इसका क्वथनांक 78.3°C है।
63. इथाइल एल्कोहल का परीक्षण किस प्रकार करेंगे ?
उत्तर – आयोडोफार्म परीक्षण (Idoform Test) — जब इथाइल एल्कोहल को आयोडीन तथा कास्टिक सोडे के साथ गर्म किया जाता है तो पीले रंग की रवेदार आयोडोफार्म बनती है जिसकी विशेष सुगंध होती है।
64. इथाइल एल्कोहल के उपयोग लिखिए।
उत्तर – (i) इसका उपयोग बीयर, व्हिस्की तथा अन्य शराबों को बनाने में किया जाता है।
(ii) प्रतिहिम बनाने में प्रयोग किया जाता है।
(iii) पारदर्शी साबुन तैयार करने में प्रयुक्त किया जाता है।
(iv) घावों तथा सिरिंजों को रोगाणुरहित करने में प्रयोग किया जाता है।
(v) ईंधन के रूप में प्रयुक्त होता है।
(vi) कार्बनिक यौगिकों के लिए विलायक का कार्य करता है।
(vii) एस्टर बनाये जाते हैं।
65. कार्बनिक अम्ल किसे कहते हैं ? इन्हें किस प्रकार तैयार किया जाता है ?
उत्तर – जिन अम्लों में कार्बोक्सिलिक ग्रुप (–COOH) होता है, उन्हें कार्बनिक अम्ल कहते हैं जैसे- HCOOH, CH3COOH, C2H5COOH आदि।
इन्हें एल्कोहल के ऑक्सीकरण से बनाया जाता है।
66. कार्बनिक अम्लों के उपयोग लिखिए।
उत्तर – (i) ठंडे पेय पदार्थों के निर्माण में इनका प्रयोग किया जाता है।
(ii) इनका उपयोग हल्के अम्लों के रूप में किया जाता है।
(iii) खाद्य पदार्थों में इनका प्रयोग होता है।
(v) इनसे औषधियाँ तैयार की जाती हैं।
(iv) साबुन उद्योग में ये काम आते हैं।
67. कार्बनिक अम्लों (Organic Acids) का परीक्षण किस प्रकार किया जाता है ?
उत्तर – (i) ये अम्ल नीले लिटमस को लाल कर देते हैं।
(ii) ये अम्ल सोडियम बाइकार्बोनेट (NaHCO3) के घोल के साथ तीव्र क्रिया करके CO2 उत्पन्न करते हैं।
(iii) ये अम्ल सांद्र H2SO4 के साथ गर्म करने पर फलों के समान मीठी सुगंध वाले ‘एस्टर’ बनाते हैं।
68. कार्बनिक अम्लो (Organic Acids) के भौतिक गुण लिखें।
उत्तर – (i) भौतिक अवस्था (Physical State) — पहले दस कार्बनिक अम्ल रंगहीन तरल हैं। लेकिन उच्चतर कार्बनिक अम्ल ठोस है।
(ii) गंध (Smell) – प्रथम तीन कार्बनिक अम्ल की गंध तीखी (Pungent smell) होती है ।
(iii) घुलनशीलता (Solubility) पहले चार अम्ल पानी में सरलता से घुल जाते हैं। लेकिन आण्विक द्रव्यमान बढ़ने के साथ-साथ पानी में घुलनशीलता कम होती रहती है ।
(iv) घनत्व (Density) — आण्विक द्रव्यमान बढ़ने के साथ-साथ घनत्व घटता रहता है।
(v) प्रकृति (Nature) इनकी प्रकृति ‘अम्लीय’ है। इसलिए ये नीले लिटमस को लाल कर देते हैं ।
69. एस्टर किसे कहते हैं ? इन्हें किस प्रकार बनाया जाता है ? इनके दो उपयोग लिखिए।
उत्तर – एस्टर (Easter) —जिन कार्बनिक यौगिकों का अभिलक्षणीय ग्रुप –COO— होता है, एस्टर कहलाते हैं। इनके निर्माण के लिए कार्बनिक अम्लों की सल्फ्यूरिक अम्ल की उपस्थिति में एल्कोहल से क्रिया कराई जाती है ।
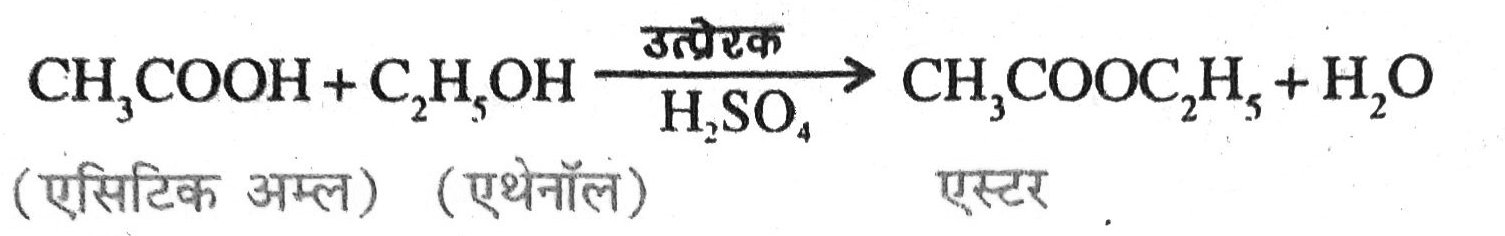
उपयोग — इनकी गंध फलों के समान होती है इसलिए इनका उपयोग ठंडे पेयों, आइसक्रीम, – मिठाइयों तथा परफ्यूमों में होता है। ये फलों में भी पाए जाते हैं।
70. संश्लिष्ट अपमार्जकों का प्रयोग इससे संबंधी समस्याएँ उत्पन्न करता है। कारण लिखिए।
उत्तर – संश्लिष्ट अपमार्जकों की उपस्थिति में जलीय सूक्ष्म जीवाणुओं का अपघटन सरलता से नहीं हो पाता जिससे वे जल में लंबे समय तक विद्यमान रहते हैं जिसके परिणामस्वरूप ऐसा जल जलीय जीवों के लिए उपयुक्त नहीं रहता। जैसे— फॉस्फेट युक्त अपमार्जक में शैवाल (काई) अत्यधिक वृद्धि करते हैं जिससे पानी में मछलियों या अन्य जीवों के लिए ऑक्सीजन की कमी हो जाती है। सामान्य अपमार्जक द्वारा यह समस्या उत्पन्न नहीं होती क्योंकि सामान्य हाइड्रोकार्बनों द्वारा बने अपमार्जक आसानी से विघटित हो जाते हैं जिनसे पर्यावरण पर कोई दूषित प्रभाव नहीं पड़ता।
71. तापदृढ़ प्लास्टिक क्या है ? तापदृढ़ प्लास्टिक के दो उदाहरण दीजिए।
उत्तर – जिन बहुलकों (पॉलीमा) को एक बार गर्म करके जिस आकार में ढाल दिया जाए तो दुबारा गर्म करने पर उनको मुलायम नहीं किया जा सके और न ही उन्हें पिघलाया जा सकें उन्हें ताप दृढ़ बहुलक (प्लास्टिक) कहते हैं। ये प्लास्टिक अनुत्क्रमणीय होते हैं। इस प्रकार के प्लास्टिकों में लम्बी श्रृंखलाएँ होती हैं परन्तु उनमें परस्पर तिर्यक बन्धन भी होते हैं। इन्हीं बन्धनों के कारण गर्म करने पर तापदृढ़ प्लास्टिक जो आकार एक बार प्राप्त कर ले उसे बदला नहीं जा सकता। तापदृढ़ प्लास्टिक के उदाहरण फीनॉल फार्मेल्डिहाइड (बेकेलाइट) तथा मैलामाइन है।
इस प्रकार प्राप्त ग्लिसरॉल को अलग करके साबुन प्राप्त होता है।
72. पेट्रोलियम क्या है तथा इसका निर्माण कैसे हुआ है ? इसका शुद्धिकरण किस विधि द्वारा किया जाता है ?
उत्तर – पेट्रोलियम यह हाइड्रोकार्बनों का मिश्रण है जो तलछट की एवं वनस्पति अवशेषों के विघटन के परिणामस्वरूप बना है। इसे कच्चा तेल या कच्चा पेट्रोलियम भी कहते हैं। कच्चे पेट्रोलियम को पृथ्वी के नीचे कुएँ खोदकर निकाला जाता है।
कुओं से निकाला गया पेट्रोलियम अशुद्ध तथा गाढ़ा होता है जिसे प्रभाजी आसवन द्वारा ) कहते , जिन्हें
अधिक उपयोगी प्रभाजों में पृथक् किया जाता है। इस प्रक्रिया को शुद्धिकरण (refiningहैं। भिन्न-भिन्न क्वथनांक पर संघनित प्रभाज पृथक्-पृथक् एकत्रित कर लिए जाते हैंपेट्रोलियम के उत्पाद कहते हैं।
73. एथिल एल्कोहल से ऐसीटिक अम्ल बनाने की क्रियाएँ लिखें।
उत्तर – (i) एथिल अल्कोहल के ऑक्सीकरण से पहले ऐसिटल्डिहाइड बनता है।
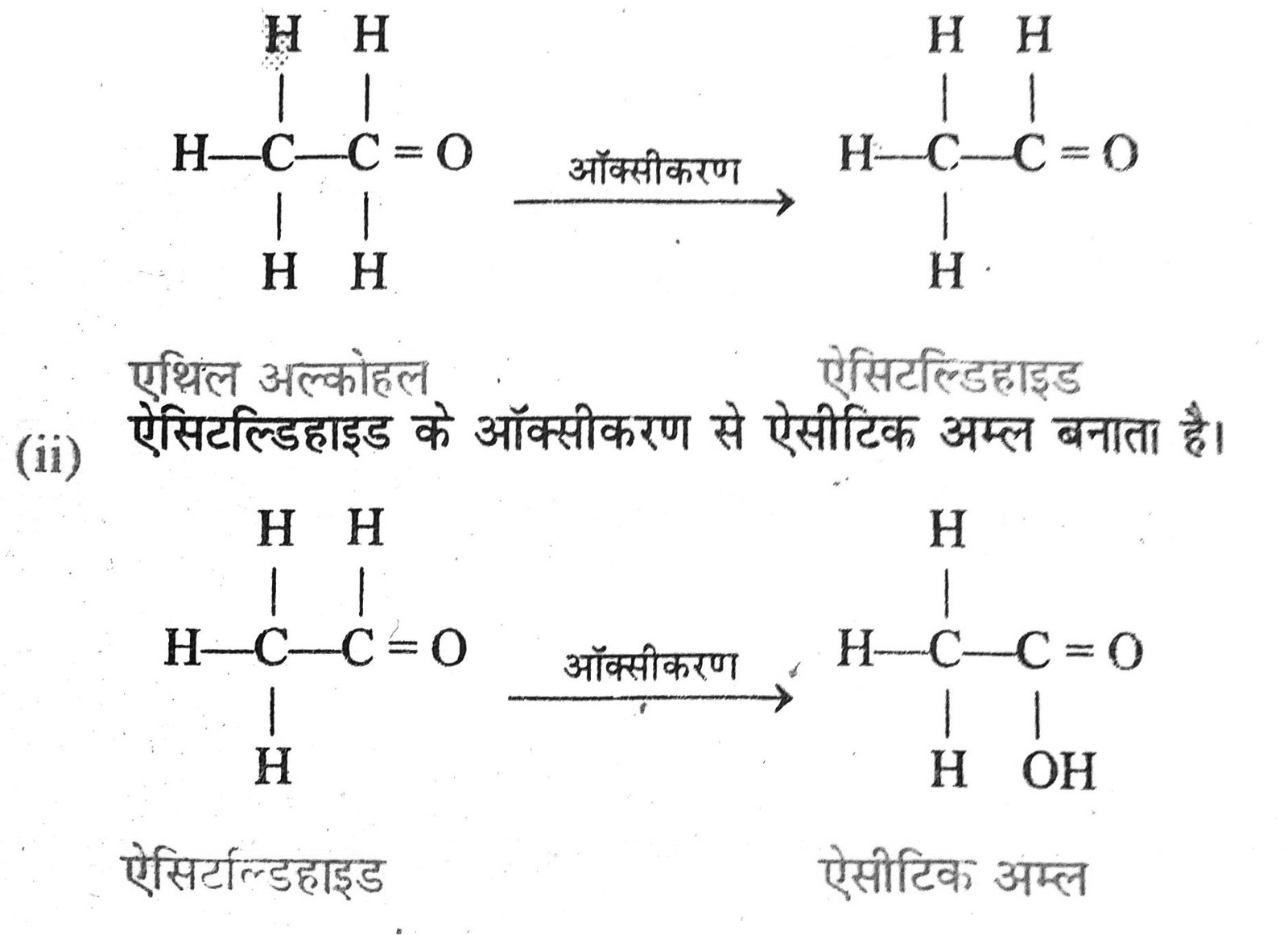
74. वल्कनीकरण किसे कहते हैं ? वल्कनीकृत रबड़ द्वारा क्या-क्या वस्तुएँ, बनाई जाती हैं ? रबड़ की कठोरता कैसे बढ़ाते हैं ?
उत्तर – प्राकृतिक रबड़ को सल्फर के साथ मिलाकर गर्म कर उत्तम गुणों का रबड़ प्राप्त करना वल्कनीकरण कहलाता है तथा प्राप्त रबड़ को वल्कनीकृत रबड़ कहते हैं। सल्फर रबड़ के अणुओं की शृंखलाओं से संयोग करके उनमें परस्पर तिर्यक बन्ध बनाती है जिससे रबड़ का लचीलापन कम हो जाता है।
वल्कनीकृत रबड़ से दस्ताने, रबड़ बैण्ड तथा ट्यूब बनाई जाती है। रबड़ में कार्बन मिलाकर इसकी कठोरता बढ़ाई जा सकती है। कठोर रबड़ का उपयोग ट्यूब टायर तथा संवाहक पट्टे बनाने में किया जाता है।
75. ब्लक क्या है ? किन्हीं दो प्रकार के यौगिकों के नाम लिखिए। जो बहुलक हों।
उत्तर – एक या अधिक ऐसे यौगिक, जिनके न्यून अणु द्रव्यमान होते हैं, बहुत अधिक संख्या में मिलकर बहुलक बनाते हैं। बहुलक के इकाई पदार्थों को एकलक कहते हैं। बहुलक बनने के प्रक्रम को बहुलीकरण कहते हैं। बहुलक दो प्रकार के होते हैं।
(i) प्राकृतिक बहुलक प्रोटीन, चमड़ा, स्टार्च, सेलुलोस आदि प्राकृतिक बहुलक है।
(ii) संश्लिष्ट बहुलक प्लास्टिक, सॅश्लिष्ट रबड़, टेरीलीन आदि सश्लिष्ट बहुलक कहलाते हैं।
76. भंजन क्रिया को एक उदाहरण द्वारा स्पष्ट करें।
उत्तर – अधिक अणुभार वाले हाइड्रोकार्बन को गर्म करने पर वह निम्न अणुभार वाले हाइड्रोकार्बन में टूट जाता है। इस अभिक्रिया को भंजन कहा होता है। जैसे— डीकेन के भंजन से निम्न अणु प्राप्त होता है।
77. आप एथीन को पॉलीथीन में कैसे बदलेंगे ?
उत्तर – एथीन एक असंतृप्त हाइड्रोजन है जो स्वयं से ही संकलन अभिक्रिया करके पॉलीथीन बनाती है। इस प्रकार प्राप्त उत्पाद में हजारों एथीन अणुओं की अनेक शृंखलाएँ होती हैं जिसको पॉलीथीन कहते हैं ।
78. ग्रेफाइट का उपयोग स्नेहक के रूप में क्यों किया जाता है ?
उत्तर – ग्रेफाइट के परमाणु सह-संयोजक बन्धों द्वारा बन्धित रहते हैं तथा षट्कोणीय जाल की परतें बनाते हैं। ये परतें ऊपर-नीचे होती हैं जो आसानी से फिसल जाती हैं। इस कारण ग्रेफाइट में स्नेहक गुण पाया जाता है। यह मुलायम एवं चिकना होता है। इसी गुण के कारण इसका उपयोग स्नेहक के रूप में होता है। इसके अतिरिक्त इसका गलनांक अत्यधिक उच्च है जिसके कारण उन मशीनों में इसका उपयोग होता है जिनमें उच्च ताप के कारण अन्य स्नेहकों का उपयोग करना सुविधाजनक नहीं होता है।
79. हीरे का उपयोग काटने वाले औजार में क्यों किया जाता है ?
उत्तर – हीरा सबसे अधिक कठोर पदार्थ है जिसके कारण इसका उपयोग अन्य पदार्थों को काटने व पीसने में किया जाता है। हीरे में कार्बन का परमाणु अन्य चार परमाणुओं से बन्धित रहता है। इस प्रकार चतुष्फलक व्यवस्था के कारण एक तीन आयामी सुदृढ़ संरचना बन जाती है जिसके फलस्वरूप हीरा एक कठोर तत्त्व है तथा इसका घनत्व अति उच्च है।
80. मेथेन एवं एथेन के संरचनात्मक तथा इलेक्ट्रॉनिक सूत्र लिखिए।
उत्तर – (i) मेथेन — इसका आण्विक सूत्र CH4 है।
81. एथीन तथा एथाइन के संरचनात्मक एवं इलेक्ट्रॉनिक सूत्र लिखें।
उत्तर – एथीन — इसका आण्विक सूत्र C2H4 है।
82. कार्बन तत्त्व एक अद्वितीय तत्त्व है। कैसे ?
उत्तर – सभी ज्ञात तत्त्वों में से केवल कार्बन तत्त्व के परमाणुओं में ही यह क्षमता है कि वे परस्पर संयोग करके लम्बी श्रृंखलाएँ बनाते हैं। प्रत्येक ऐसी श्रृंखला कार्बन परमाणुओं को इस प्रकार का सरल आधार प्रदान करती है जिसमें अन्य परमाणु विभिन्न विधियों द्वारा जुड़ सकते हैं जिसके परिणामस्वरूप कार्बन तत्त्व द्वारा अत्यधिक किस्मों के यौगिक बनाए जा सकते हैं।
82. कार्बन का आवर्त सारणी में स्थान निर्धारित कीजिये तथा इसका इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर – कार्बन का परमाणु द्रव्यमान = 12
परमाणु क्रमांक = 6
∴ इलेक्ट्रॉनों की या प्रोटॉनों की संख्या = 6
∴ न्यूट्रॉनों की संख्या = 6
कार्बन का इलेक्ट्रॉनिक विन्यास 2, 4 है। इसके बाह्यतम कक्षाओं में चार इलेक्ट्रॉन होते हैं। इसलिए इसकी संयोजकता 4 है। इसे आवर्त सारणी में p– ब्लॉक के IVA वर्ग में रखा गया है जिसके अन्तर्गत सिलिकॉन, जर्मेनियम, टिन तथा सीसा आते हैं।
83. यदि आपको ऐल्केन तथा ऐल्कीन के नमूने दिए गए हों तो आप दोनों में अन्तर कैसे ज्ञात करेंगे ?
उत्तर – ऐल्केन तथा ऐल्कीन के अन्तर के लिए निम्न दो परीक्षण किए जाते हैं।
(i) ब्रोमीन जल परीक्षण–दो परखनलियों में दोनों नमूनों में से कुछ मात्रा में पदार्थ लेते हैं तथा इनमें कुछ बूँदें ब्रोमीन जल की डाल कर उन्हें हिलाते हैं। यदि ब्रोमीन का गहरा लाल भूरा रंग समाप्त हो जाए तो वह ऐल्केन ।
(ii) क्षारीय KMnO4 परीक्षण–दोनों नमूनों को अलग-अलग परखनलियों में लेकर उनमें क्षारीय पोटैशियम परमैंगनेट घोल की कुछ बूँदें डालते हैं। यदि विलयन रंगहीन हो जाए तो वह निश्चित रूप से ऐल्कीन होगा। यदि रंग में कोई परिवर्तन न हो तो वह ऐल्केन होगा।
ऐल्केन संतृप्त हाइड्रोकार्बन है तथा ऐल्कीन असंतृप्त हाइड्रोकार्बन । अतः असंतृप्त तथा संतृप्त हाइड्रोकार्बन की पहचान के लिए भी उपरोक्त परीक्षण किये जाते हैं।
84. रेयॉन किस प्रकार बनाई जाती है ? रेयॉन को नवीनीकृत या पुनरुत्पादित रेशा क्यों कहते हैं ?
उत्तर – रेयॉन का निर्माण सेलुलोस से होता है जिसे परिशोधित लम्बे रेशों के रूप में परिवर्तित किया जाता है। रेयॉन को बनाने के लिए सेलुलोस को किसी विलायक में घोलकर इसे गलिंत अवस्था में लाया जाता है। कागज की लम्बी पट्टियों को ठण्डे सोडियम हाइड्रॉक्साइड के घोल में डुबोया जाता है जिससे सेलुलोस अधिक परिशुद्ध हो जाता है। इसके पश्चात् इसमें कार्बन डाइसल्फाइड (CS2) को मिलाते हैं जिससे सेलुलोस का घोल बन जाता है। इस घोल को धातु के किसी सिलिण्डर में बने अत्यन्त सूक्ष्म छिद्रों द्वारा सल्फ्यूरिक अम्ल के तनु घोल में डाला जाता है जिससे लम्बे रेशे वाले सेलुलोस बन जाते हैं इसे विस्कोस रेयॉन कहते हैं।
रेयॉन का निर्माण नवीकरणीय स्रोत से है इसलिए इसको नवीनीकृत रेशा कहते हैं। सेलुलोस प्राकृतिक पदार्थों जैसे लकड़ी या कागज से प्राप्त होता है जो पूर्णतया रासायनिक पदार्थ नहीं है, इसलिए इसे नवीनीकृत रेशा कहते हैं।
85. यदि आप लिटमस पत्र (लाल एवं नीला) से साबुन की जाँच करें तो आपका प्रेक्षण क्या होगा ?
उत्तर – साबुन की प्रकृति क्षारीय होती है। इसलिए यह लाल लिटमस पत्र को नीला कर देता है।
86. कोयले तथा पेट्रोलियम को जीवाश्मी ईंधन क्यों कहते हैं ?
उत्तर – चूँकि कोयला एवं पेट्रोलियम का निर्माण पृथ्वी के नीचे लाखों वर्षों में होता है। अतः ये ऊर्जा का अनवीकरणीय स्रोत हैं। ये तीनों पृथ्वी के धरातल से प्राप्त होने वाले ईंधन हैं इसलिए इन्हें जीवाश्म ईंधन कहते हैं।
87. मक्खन एवं खाना बनाने वाले तेल के बीच रासायनिक अन्तर समझने के लिए परीक्षण बताएँ।
उत्तर – एक मक्खन संतृप्त हाइड्रोकार्बन है जबकि खाद्य तेल असंतृप्त हाइड्रोकार्बन है। इस अंतर को निम्न प्रकार प्रदर्शित किया जा सकता है
(i) थोड़े से मक्खन को गर्म करके उसमें कुछ बूंदें ब्रोमीन जल डालते हैं। ब्रोमीन जल का रंग नहीं उड़ता। इससे यह पता चलता है कि मक्खन संतृप्त कार्बनिक यौगिक है।
(ii) खाद्य तेल में कुछ बूँदें ब्रोमीन जल की डालकर हिलाते हैं। कुछ समय बाद ब्रोमीन जल का रंग उड़ जाता है। इससे यह पता चलता है कि खाद्य तेल असंतृप्त कार्बनिक यौगिक है।
दीर्घ उत्तरीय प्रश्न
1. किसी कार्बनिक यौगिक का नामकरण किस प्रकार किया जाता है ?
उत्तर – (i) यौगिक में कार्बन परमाणुओं की संख्या ज्ञात करते हैं ।
(ii) प्रकार्यात्मक समूह की उपस्थिति में इसको पूर्वलग्न अथवा अनुलग्न के साथ यौगिक के नाम में दर्शाया जाता है।
(iii) यदि प्रकार्यात्मक समूह का नाम पूर्वलग्न के आधार पर दिया जाना हो तो कार्बन शृंखला के नाम से अंत का ‘e’ हटाकर उसमें समुचित अनुलग्न लगाकर संशोधित करते हैं। जैसे—कीटोम समूह की तीन कार्बन वाली शृंखला निम्न विधि से नाम दिया जाएगा ।
Propane – e – = propane + one = Propone
जैसे – द्विआबंध वाली तीन कार्बन की श्रृंखला प्रोपीन कहलाएगी ।
2. संतृप्त एवं असंतृप्त हाइड्रोकार्बन में अन्तर बताएँ।
उत्तर –

3. अपररूपता किसे कहते हैं ? कार्बन के अपररूपों के नाम लिखें। क्या वे रासायनिक दृष्टि से समान हैं ? उनके भौतिक गुणों की तुलना कीजिए।
उत्तर – अपररूपता- जिस गुण के कारण तत्व विभिन्न रूपों में पाए जाते हैं, उसे अपररूपता कहते हैं तथा विभिन्न रूपों को तत्व के अपररूप कहते हैं।
कार्बन के अपररूप- 1. हीरा 2. ग्रेफाइट
रासायनिक दृष्टि से समानता – यदि दोनों अपररूपों की समान मात्रा को वायु में गर्म किया जाए तो दोनों समान मात्रा में ही कार्बन डाइऑक्साइड बनाते हैं और शेष कुंछ नहीं बचता। अतः इस प्रयोग से यह सिद्ध होता है कि दोनों अपररूप रासायनिक दृष्टि से समान हैं :
C + O2 → CO2
(हीरा ग्रेफाइट)
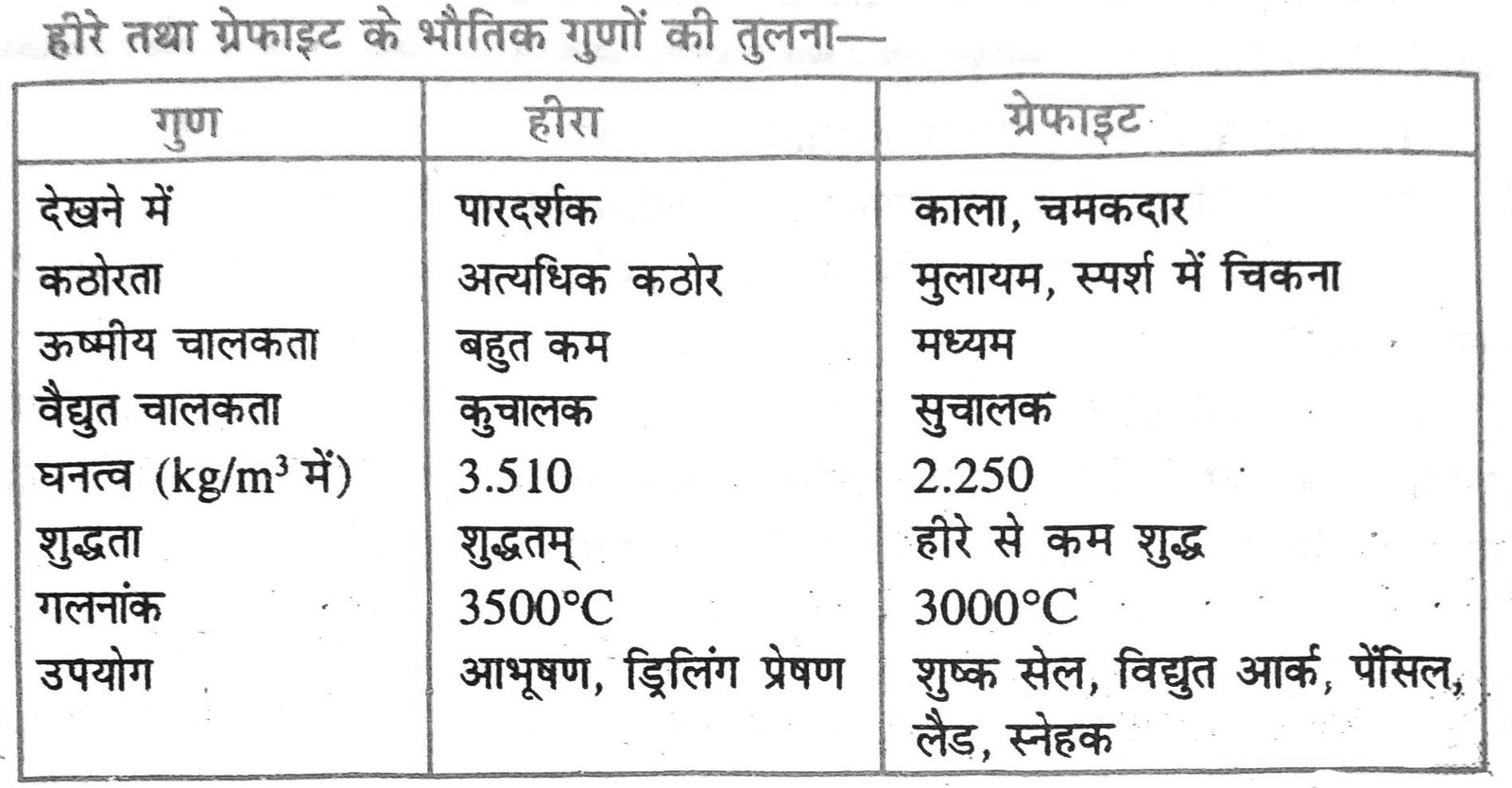
4. मिथेन के प्रथम तीन सजातियों के संरचना सूत्र लिखिए।
उत्तर – मिथेन के प्रथम तीन सजातीय –

5. एल्केन किसे कहते हैं ? इसके प्रमुख सदस्यों के गुण लिखिए। उन गुणों से क्या परिणाम निकलते हैं ?
उत्तर – एल्केन – जिन हाइड्रोकार्बनों का संरचना सूत्र CnH2n+2 हो उन्हें एल्केन कहते हैं। इस प्रकार के सदस्य मिलकर एक सजातीय श्रेणी बनाते हैं। जिनमें एथेन, प्रोपेन तथा ब्यूटेन जैसे हाइड्रोकार्बन अनेक ऐसे कार्बनिक यौगिक बनाते हैं जिनके सम्मिलित रूप को एल्केन कहते हैं। इन यौगिकों में कार्बन तथा हाइड्रोजन परमाणुओं की संख्या एक सदस्य से दूसरे सदस्य में (–CH2) से परिवर्तत होती जाती है। जैसे मिथेन के किसी एक अणु में कार्बन-हाइड्रोजन बंध (C – H) को कार्बन-कार्बन बंध (C – C) द्वारा प्रतिस्थापित कर दें तो सहसंयोजन बंधों में जुड़े दोनों कार्बन परमाणुओं में से प्रत्येक अब हाइड्रोजन परमाणुओं के साथ सहसंयोजन बंध बनाते हैं जिससे एथेन का अणु निर्मित होता है।
एल्केन के गुण –
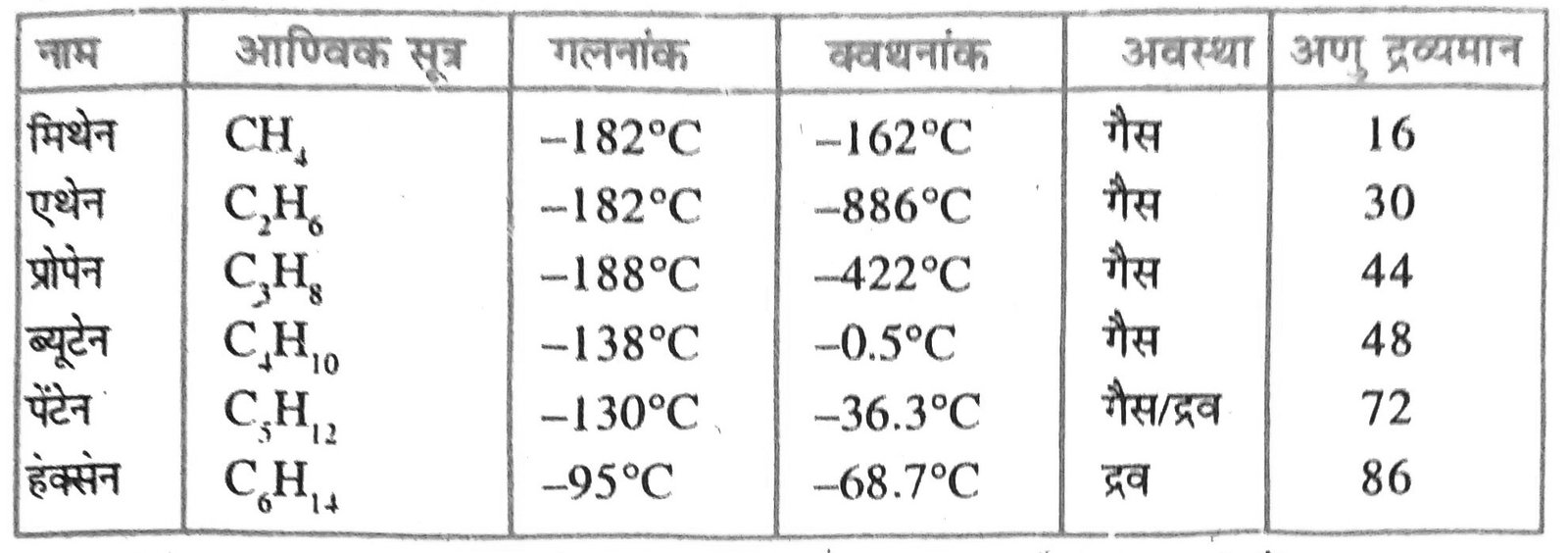
परिणाम – 1. एल्केनों के भौतिक गुण उसके द्रव्यमान पर निर्भर करते हैं।
2. पहले चार एल्केन कक्ष ताप पर गैस अवस्था में हैं तथा छः से अधिक कार्बन परमाणु वाले एल्केन द्रव हैं।
3. उच्च अणु द्रव्यमान वाले एल्केन ठोस हैं।
4. एल्केनों का गलनांक तथा क्वथनांक अणु द्रव्यमान के बढ़ने के साथ-साथ बढ़ता जाता है।
6. समावयवी से क्या अभिप्राय होता है ? उदाहरण देकर स्पष्ट कीजिए।
उत्तर – समावयवी (Isomers) – ऐसे यौगिक जिनका आण्विक सूत्र तो समान हो परंतु अणुओं की संरचनात्मक व्यवस्था भिन्न-भिन्न हो, उन्हें समावयवी कहते हैं तथा इस घटना को समावयव कहते हैं। मिथेन, एथेन, प्रोपेन में कार्बन तथा हाइड्रोजन के परमाणुओं को पुनः व्यवस्थित करने पर भी संरचना में कोई परिवर्तन नहीं आता परंतु जब एल्केन के अणु में कार्बन की संख्या तीन से अधिक हो जाती है तो एक से अधिक व्यवस्थाएँ संभव हो जाती हैं। इनमें से एक में कार्बन परमाणु लंबी श्रृंखला बनाते हैं जबकि दूसरे में शाखाएँ होती हैं। ब्यूटेन में शाखा युक्त श्रृंखला में कम-से-कम कार्बन परमाणु तीन अन्य कार्बन परमाणुओं से बंधित है। इस प्रकार एल्केनों को आइसो-एल्केन कहते हैं। शाखा रहित श्रृंखला में कोई भी कार्बन परमाणु दो से अधिक कार्बन परमाणुओं से बंधित नहीं होता है। इस प्रकार के एल्केनों को सामान्य (नॉर्मल) n- एल्केन कहते हैं।
ब्यूटेन के समावयव –

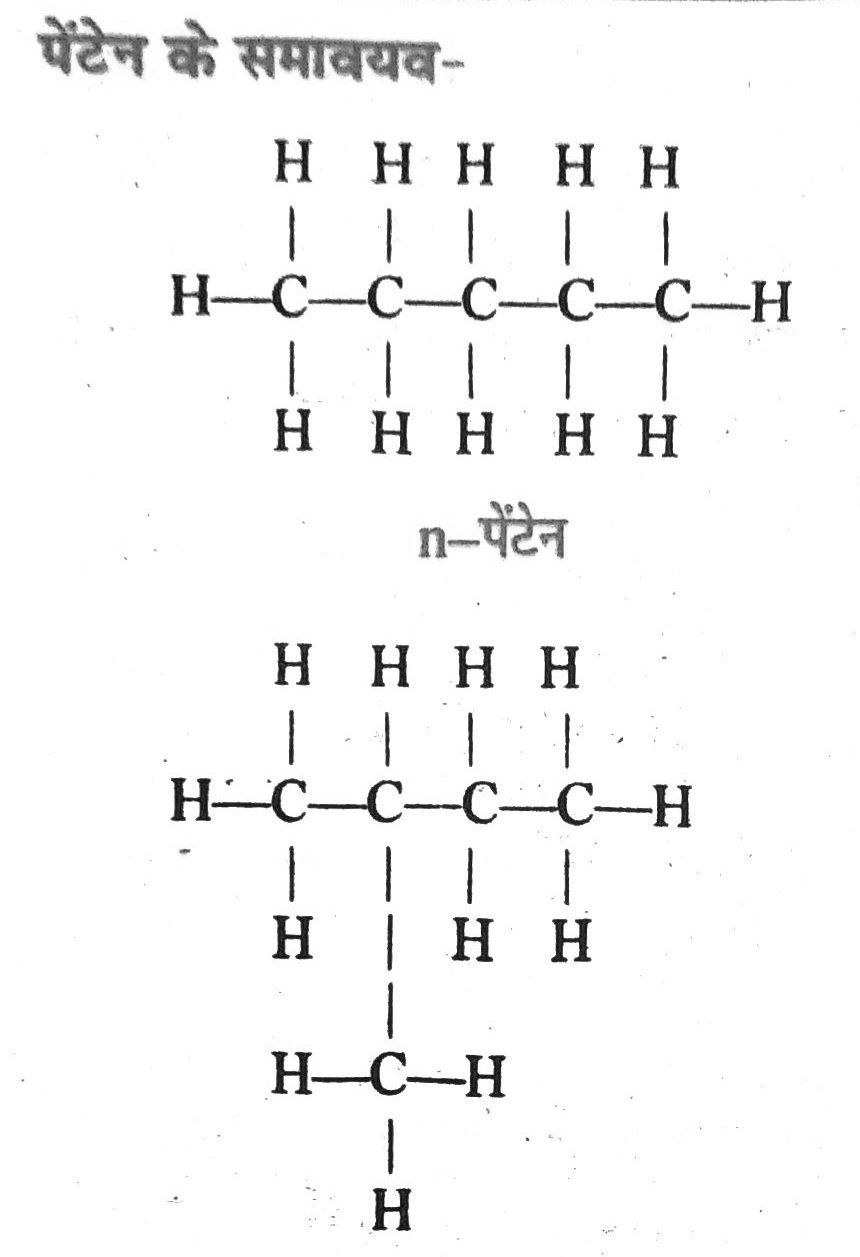

7. सजातीय सीरीज की परिभाषा दें। इसके प्रमुख गुण बताएँ। ऐसी सजातीय सीरीज का नाम बताएँ जो निम्नलिखित सामान्य सूत्रों द्वारा प्रदर्शित होती है—
(i) CnH2n-2 (ii) CnH2n+2 (iii) CnH2n, तथा (iv) CnH2n+1OH
प्रत्येक सीरीज के प्रथम सदस्य का संरचनात्मक सूत्र लिखिए।
उत्तर – सजातीय सीरीज कार्बनिक यौगिकों को एक ही क्रियात्मक समूह वाले, रासायनिक दृष्टि के समान तथा एक ही सामान्य सूत्र से निरूपित किए जा सकने वाले यौगिकों के समूहों में बाँटा जा सकता है। ऐसे प्रत्येक समूह को सजातीय सीरीज कहते हैं। इस श्रेणी में रखे गए निकटतम दो सदस्यों को आण्विक सूत्रों में (—CH2) ग्रुप का अंतर होता है। एक सजातीय श्रेणी के प्रत्येक सदस्य को सजात कहते हैं।
सजातीय सीरीज के प्रमुख गुण—
1. सजातीय सीरीज के सभी सदस्यों को एक सामान्य सूत्र द्वारा दर्शाया जा सकता है।
2. दो संलग्न सदस्यों में 1 कार्बन परमाणु तथा 2 हाइड्रोजन परमाणुओं का अंतर होता है।
3. सजातीय सीरीज के सभी सदस्यों के रासायनिक गुण एक समान होते हैं।
4. सजातीय सीरीज के सभी सदस्यों के भौतिक गुणों में थोड़ा-सा अंतर होता है।
5. दो संलग्न सदस्यों के आण्विक द्रव्यमान में अंतर 14a.m.u. होता है।
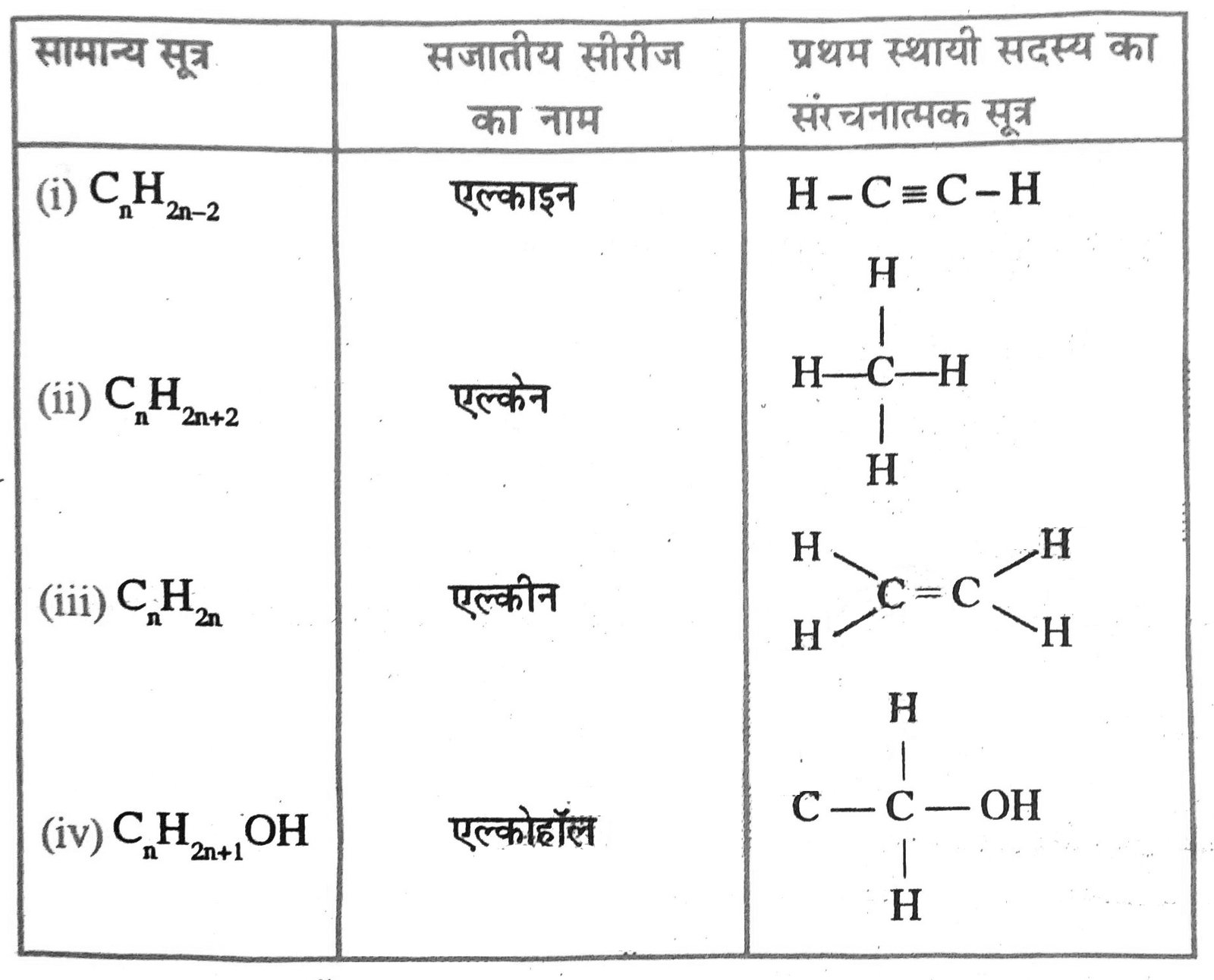
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here