तत्त्वों का आवर्ती वर्गीकरण | Class 10Th Chemistry Chapter – 5 Notes | Model Question Paper | तत्त्वों का आवर्ती वर्गीकरण Solutions
तत्त्वों का आवर्ती वर्गीकरण | Class 10Th Chemistry Chapter – 5 Notes | Model Question Paper | तत्त्वों का आवर्ती वर्गीकरण Solutions
तत्त्वों का आवर्ती वर्गीकरण (Periodical Classification of Elements)
स्मरणीय तथ्य : एक दृष्टिकोण
(MEMORABLE FACTS : AT A GLANCE)
- तत्वों का वर्गीकरण होने से उनके गुणों का अध्ययन नियमित ढंग से किया जाता है।
- डोबरेन के त्रियक नियम के अनुसार तीन-तीन तत्वों को उन तत्वों के परमाणु द्रव्यमान के क्रम में सजाने पर बीचवाले तत्व का परमाणु द्रव्यमान किनारेवाले दोनों तत्वों के परमाणु द्रव्यमानों का औसत होता है।
- लभ्वाजे ने तत्वों का वर्गीकरण धातु और अधातु में किया था।
- न्यूलैट्स के अष्टक नियम के अनुसार, जब तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाता है तो किसी भी तत्व से प्रारंभ करने पर आठ तत्व के गुण पहले तत्व के गुणों के समान होते हैं, जैसा कि संगीत का आठवाँ स्वर पहले स्वर के समान होता है।
- मॅडलीव ने अपने समय तक ज्ञात 63 तत्वों को एक सारणी द्वारा क्रमबद्ध किया जिसे मेंडलीव की आवर्त सारणी कहते हैं।
- मॅडसीव के आवर्त सारणी के अनुसार तत्वों के भौतिक एवं रासायनिक गुण उसके परमाणु द्रव्यमानों के आवर्तफलन होते हैं।
- आवर्त सारणी में खड़ी पंक्तियों को वर्ग या समूह कहते हैं।
- आवर्त सारणी में क्षैतिज पंक्तियों को आवर्त कहते हैं।
- आधुनिक आवर्त नियम तत्वों की परमाणु संख्या पर आधारित है। इस नियम के अनुसार, तत्वों के भौतिक एवं रासायनिक गुण उनकी परमाणु संख्या के आवर्तफलन होते हैं।
- किसी वर्ग के सभी तत्व समान गुणवाले होते हैं।
- किसी वर्ग विशेष के सभी तत्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं; अर्थात् सभी तत्वों के परमाणुओं में संयोजी इलेक्ट्रॉनों की संख्या समान होती है।
- किसी विलगित गैसीय परमाणु में सबसे कमजोर बल से बँधे इलेक्ट्रॉन को निष्कासित करने के लिए आवश्यक ऊर्जा आयनन ऊर्जा कहलाती है। इसे प्रथम आयनन ऊर्जा भी कहते हैं।
- सहसंयोजक बंधन से जुड़े इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की परमाणु की क्षमता को उसकी विद्युत ऋणात्मकता कहते हैं।
- बढ़ती हुई परमाणु संख्या के साथ तत्वों के रासायनिक गुणों की नियमित पुनरावृत्ति रासायनिक आवर्तता कहलाती है।
- ऐक्टिनियम से प्रारंभ होनेवाले संक्रमण तत्वों की श्रेणी ऐक्टिनाइड्स कहलाती है। तत्व रासायनिक दृष्टि से अक्रिय होते हैं।
- ऐक्टिनियम से प्रारंभ होनेवाले संक्रमण तत्वों की श्रेणी ऐक्टिनाइड्स कहलाती है।
- लैथेनम से प्रारंभ होनेवाले संक्रमण तत्वों की श्रेणी लैंथेनाइड्स या लैथेनायड्स कहलाती है।
- परमाणु के नाभिक में सबसे बाहरी शेल की दूरी को परमाणु अर्द्धव्यास या त्रिज्या कहते हैं।
- धातुओं और अधातुओं के मध्यवर्ती गुणवाले तत्व उपधातु या अर्द्धधातु कहलाते हैं।
- आवर्त सारणी के वर्ग 0 या वर्ग 18 वाले तत्व गैस हैं जिन्हें उत्कृष्ट गैस कहते हैं। ये सभी तत्व रासायनिक दृष्टि से अक्रिय होते हैं।
- वर्ग 1 के तत्व क्षार धातु कहलाते हैं।
- वर्ग 2 के तत्व क्षारीय मृदा धातु कहलाते हैं।
- वर्ग 17 के तत्व हैलोजेन्स कहलाते हैं।
- परमाणु के संयोजकता शेल में विद्यमान इलेक्ट्रॉनों की संख्या को संयोजकता इलेक्ट्रॉन कहते हैं।
- वर्ग 1 से 2 के तत्व s-ब्लॉक के तत्व कहलाते हैं।
- वर्ग 13 से 18 तक वाले तत्व p-ब्लॉक के तत्व कहलाते हैं।
- वर्ग 3 से 12 तक वाले तत्व d-ब्लॉक के तत्व कहलाते हैं।
- आवर्त सारणी के नीचे दो कतारों के लैंथेनाइड्स और ऐक्टिनाइड्स f-ब्लॉक के तत्व कहलाते हैं।
अभ्यासार्थ प्रश्न
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर ( क, ख, ग या घ) लिखें।
1. मेंडलीव के आवर्त नियम के अनुसार, तत्वों के गुण आवर्तफलन होते हैं उनके
(क) परमाणु संख्याओं के
(ख) परमाणु द्रव्यमानों के
(ग) परमाणु आयतन के
(घ) घनत्व के
उत्तर – (ख)
2. आधुनिक आवर्त नियम के अनुसार, तत्वों के गुण आवर्तफलन होते हैं उनके
(क) परमाणु द्रव्यमानों के
(ख) परमाणु संख्याओं के
(ग) परमाणु आकार के
(घ) धातुई गुण के
उत्तर – (ख)
3. मेंडलीव ने तत्वों को निम्नलिखित में किसके बढ़ते हुए क्रम में वर्गीकृत किया ?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) रासायनिक सक्रियता
(घ) घनत्व
उत्तर – (ख)
4. ‘अष्टक नियम’ के प्रतिपादक थे
(क) डाल्टन
(ख) डोबरेनर
(ग) मेंडलीव
(घ) न्यूलैंड्स
उत्तर – (घ)
5. त्रियक नियम का प्रतिपादन किस वैज्ञानिक ने किया था ?
(क) लोथर मेयर
(ख) मेंडलीव
(ग) डोबरेनर
(घ) न्यूलैंड्स
उत्तर – (ग)
6. आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर तत्व का धातुई गुण
(क) बढ़ता है
(ख) घटता है
(ग) अपरिवर्तित रहता है
(घ) इनमें कोई नहीं
उत्तर – (क)
7. परमाणु संख्या, न कि परमाणु द्रव्यमान, तत्त्व का अधिक मौलिक गुण है। इस कथन का प्रतिपादन किसने किया था ?
(क) लोथर मेयर
(ख) मोसले
(ग) मेंडलीव
(घ) रदरफोर्ड
उत्तर – (ख)
8. किसी तत्त्व A के क्लोराइड का सूत्र ACl2 है। यह यौगिक उच्च द्रवणांकवाला ठोस पदार्थ है। A आवर्त सारणी के उस वर्ग के अंतर्गत होगा जिसमें है
(क) K
(ख) Ba
(ग) B
(घ) Si
उत्तर – (ख)
9. निम्नलिखित में कौन-सा तत्त्व सबसे अधिक अधातुई गुणवाला है ?
(क) N
(ख) Cl
(ग) P
(घ) S
उत्तर – (ख)
10. सबसे अधिक भास्मिक ऑक्साइड है
(क) K2O
(ख) B2O3
(ग) SO2
(घ) NO2
उत्तर – (क)
11. आवर्त सारणी में वर्ग 1 के तत्त्व कहलाते हैं
(क) संक्रमण तत्त्व
(ख) क्षारीय मृदा धातुएँ
(ग) क्षार धातुएँ
(घ) लैंथेनाइड्स
उत्तर – (ग)
12. मैग्नीशियम आवर्त सारणी के किस वर्ग में है ?
(क) वर्ग 1
(ख) वर्ग 2
(ग) वर्ग 12
(घ) वर्ग 13
उत्तर – (क)
II. रिक्त स्थानों की पूर्ति करें।
1.आवर्त सारणी के उदग्र स्तंभ ………..कहलाते हैं।
उत्तर – वर्ग
2. आवर्त सारणी की क्षैतिज कतारें ………कहलाती हैं।
उत्तर – आवर्त
3. आधुनिक आवर्त सारणी के अनुसार तत्त्वों के गुण उनकी …………के आवर्तफलन होते हैं।
उत्तर – परमाणु संख्या
4. एक तत्त्व का इलेक्ट्रॉनिक विन्यास 2, 8, 7 है। इस तत्त्व की परमाणु संख्या ………. है।
उत्तर – 17
5. आवर्त सारणी में आवर्तों की कुल संख्या ………हैं।
उत्तर – 7
6. वर्ग 17 के तत्त्वों को ……… कहते है ।
उत्तर – हैलोजन्स
7. वर्ग 13 के तत्त्वों की संयोजकता ………… होती है।
उत्तर – 3
8. आवर्त सारणी के प्रथम आवत में तत्त्वों की संख्या ……….. हैं।
उत्तर – 2
9. वर्ग 1 और वर्ग 2 के तत्त्वों के ऑक्साइड ……… होते हैं।
उत्तर – भास्मिक
10. किसी तत्त्व के संयोजी शेल में उपस्थित इलेक्ट्रॉनों की संख्या बताती है कि वह तत्त्व आवर्त सारणी के किस ………में है।
उत्तर – वग
11. एक ही वर्गवाले तत्त्वों के ……… सदृश होते हैं।
उत्तर – गुर्ण
III. सही/गलत का चयन करें।
1. क्लोरीन, ब्रोमीन और आयोडीन डोबरेनर के त्रियक का पालन करते हैं।
उत्तर – सही
2. अष्टक नियम का प्रतिपादन मॅडलीव ने किया था।
उत्तर – गलत
3. आधुनिक आवर्त सारणी में मैडलीव की आवर्त सारणी के अधिकांश दोष दूर हो गए हैं।
उत्तर – सही
4. किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु का आकार बढ़ता है।
उत्तर – गलत
5. सोडियम परमाणु का आकार क्लोरीन परमाणु के आकार से छोटा होता है।
उत्तर – गलत
6. किसी आवर्त में बाएँ से दाएँ जाने पर तत्वों के धातुई गुण बढ़ते जाते हैं।
उत्तर – गलत
7. पोटैशियम के परमाणु की तुलना में ब्रोमीन का परमाणु आसानी से इलेक्ट्रॉन का त्याग कर सकता है।
उत्तर – गलत
8. आवर्त सारणी के वर्ग में ऊपर से नीचे आने पर परमाणुओं के आकार बढ़ते जाते हैं।
उत्तर – सही
अतिलघु उत्तरीय प्रश्न
1. तत्त्वों के अष्टक नियम का प्रतिपादन किसने किया था ?
उत्तर – तत्त्वों के अष्टक नियम का प्रतिपादन न्यूलैण्ड्स ने किया था।
2. आवर्त सारणी के उदग्र स्तंभ क्या कहलाते हैं ?
उत्तर – आवर्त सारणी के उदग्र स्वतंत्र को वर्ग कहते हैं ।
3. आवर्त सारणी की क्षैतिज कतारें क्या कहलाते हैं ?
उत्तर – आवर्त सारणी की क्षैतिज कतारें आवर्त कहलाते हैं ।
4. उस एक तत्त्व का नाम लिखें जिनके आविष्कृत होने के पहले ही मेंडलीव गुणों का पुर्वानुमान कर लिया था ?
उत्तर – स्कैंडियम (Sc) के आविष्कृत होने के पहले ही मेंडलीव ने उसके गुणों का पूर्वानुमान कर लिया था।
5. आवर्त सारणी के दीर्घ रूप में कुल कितने वर्ग और आवर्त हैं ?
उत्तर – आधुनिक आवर्त सारणी में तत्वों को 18 वर्ग 7 आवर्त में व्यवस्थित रखा गया है।
6. एक क्षार धातु और एक क्षारीय मृदा धातु को बताएँ जिनके नाम ‘S’ अक्षर से प्रारंभ होते हैं ?
उत्तर – क्षार धातु सोडियम है तथा क्षारीय मृदा धातु स्ट्रॉन्शियम है।
7. वर्ग 14 के एक तत्व की परमाणु संख्या 14 है। बताएँ कि इस तत्व के गुण धातुई होंगे या अधातुई।
उत्तर – आधुनिक आवर्त सारणी के वर्ग 14 के एक तत्व की परमाणु संख्या 14 है तो वह तत्व के गुण अधातुई होंगे।
8. वर्ग-14 के कार्बन के अतिरिक्त दी तत्वों के नाम लिखें।
उत्तर – वर्ग-14 के कार्बन के अतिरिक्त दो तत्वों के नाम ये हैं—
(i) सिलिकॉन, (ii) जर्मेनियम आदि।
9. एक तत्व का इलेक्ट्रॉनिक विन्यास 2, 8, 7 है। आवर्त सारणी में इस तत्व की संख्या बताएँ। वर्ग
उत्तर – यह तत्व क्लोरीन है जिसकी वर्ग संख्या 17 है।
10. आधुनिक आवर्त सारणी तत्वों के किस गुण पर आधारित है ?
उत्तर – तत्वों को उनके परमाणु द्रव्यमान के आरोही क्रम तथा रासायनिक गुणधर्मों के आधार पर वर्गीकृत हैं।
11. एक कारण देकर बताएँ कि नाइट्रोजन और फास्फोरस को आवर्त सारणी के एक ही वर्ग में क्यों रखा गया है ?
उत्तर – नाइट्रोजन और फास्फोरस के अंतिम कक्षा में पाँच-पाँच इलेक्ट्रॉन हैं। यही कारण है कि नाइट्रोजन (N) और फास्फोरस (P) को आवर्त सारणी के एक ही वर्ग में रखा गया है।
12. किस तत्व के परमाणु में पूर्णतः भरे हुए सिर्फ दो शेल हैं ?
उत्तर – नियॉन में पूर्णतः भरे हुए सिर्फ दो शेल (K – 2, L − 8) है।
13. किसी तत्त्व के समस्थानिकों को आवर्त सारणी के एक ही स्थान में क्यों रखा गया है ?
उत्तर – क्योंकि किसी तत्त्व के सभी समस्थानिकों के परमाणु संख्या समान होता है।
14. मेंडलीफ की मूल आवर्त सारणी में किस वर्ग के तत्व गायब थे ?
उत्तर – बर्ग III के तत्व।
15. यदि किसी तत्व की परमाणु संख्या 1.5 हो, तो क्या आवर्त सारणी में इसे हाइड्रोजन और हिलियम के बीच रखा जा सकता है ?
उत्तर – नहीं, क्योंकि परमाणु संख्या (दशमलव) में नहीं होना चाहिए।
16. आवर्त सारणी में सबसे अधिक धात्विक और सबसे अधिक अधात्विक तत्व के नाम लिखें।
उत्तर – सबसे अधिक धात्विक तत्व = सोडियम सबसे अधिक अधात्विक तत्व= स्टैटिन (At)
लघु उत्तरीय प्रश्न
1. आवर्त सारणा के लघु एवं दीर्घ आवर्त से क्या समझते हैं ? आवर्त सारणी के लघु एवं दीर्घ आवतों की संख्या बताएँ।
उत्तर – द्वितीय एवं तृतीय आवर्त में 8-8 तत्त्व हैं। ये लघु आवर्त कहलाते हैं। चतुर्थ एवं पंचम आवर्त में 18-18 तत्त्व हैं। षष्टम आवर्त में 32 तत्त्व हैं। सप्तम आवर्त में अभी 25 तत्त्व हैं। यह आवर्त अभी अपूर्ण है। चतुर्थ एवं उसके बाद के सभी आवर्त दीर्घ आवर्त कहलाते हैं। लघु आवर्त की संख्या 2 है। दीर्घ आवर्त की संख्या 4 है।
2. आवर्त सारणी के दूसरे आवर्त में आठ ही तत्वों क्यों रखे गये हैं ?
उत्तर – चूँकि बाह्यतम कक्षा की संख्या आवर्त बताता है, अतः दूसरे आवर्त में कक्षा भी दो है। किसी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या सूत्र 2n2 द्वारा निर्धारित होती है, जहाँ n कक्षा की संख्या है। दूसरी कक्षा में इलेक्ट्रॉनों की संख्या 2n2 = 2(2)2 = 8 है। इसी कारण से दूसरे आवर्त में आठ तत्त्व ही रखे गए हैं। –
3. मेडलीव की आवर्त सारणी की मुख्य विशेषताओं का उल्लेख करें।
उत्तर – मेंडलीव की आवर्त सारणी के उपयोग से–(i) तत्त्वों के अध्ययन में सुविधा होती है, (ii) तत्त्वों के परमाणु भार ज्ञात करने में सहायता मिलती है, (iii) संदेहपूर्ण परमाणु भारों को शुद्ध करने में मदद मिलती है, (iv) नए तत्त्वों के आविष्कार में सहयोग मिलता है, (v) परमाणु संरचना का निर्धारण होता है और (vi) अनुसंधान कार्य में सहायता मिलती है।
4. मेंडलीव की आवर्त सारणी की किन्हीं दो त्रुटियों का वर्णन करें
उत्तर – मंडलीव की आवर्त सारणी की दो त्रुटियाँ निम्नलिखित हैं— (i) हाइड्रोजन का स्थान आवर्त सारणी में हाइड्रोजन का स्थान अनिर्णित है। इसके कुछ क्षार धातुओं के सदृश होने के कारण इसे वर्ग IA में क्षार धातुओं (Li, Na, K आदि) के – – गुण साथ रखा गया है। किंतु, इसके कुछ गुण हैलोजेन तत्त्वों के सदृश होने के कारण इसे वर्ग VIIA में हैलोजेन तत्त्वों (F, Cl, Br आदि) के साथ भी रखा जा सकता है। –
(ii) असमान तत्त्वों को साथ रखना बहुत से तत्त्वों के गुणों में भिन्नता होते हुए भी सारणी के एक ही वर्ग में रखे गए हैं; जैसे—Cu, Ag एवं Au को क्षार धातुओं Li, Na, K आदि के साथ एक ही वर्ग में रखा गया है।
5. आधुनिक आवर्त सारणी किसी परमाणु का स्थान उसके इलेक्ट्रॉनिक विन्यास से किस प्रकार संबंधित है ?
उत्तर – किसी वर्ग – विशेष के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं, अर्थात् सभी तत्त्वों के परमाणुओं में संयोजी इलेक्ट्रॉन की संख्या समान होती है।
उदाहरणार्थ, वर्ग 1 के सभी तत्त्वों के परमाणु में संयोजी इलेक्ट्रॉन की संख्या 1 होती है। इसी प्रकार वर्ग 17 के सभी तत्त्वों के परमाणु में संयोजी इलेक्ट्रॉनों की संख्या 7 होती है।
इस प्रकार किसी वर्ग के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं, किंतु वर्ग में ऊपर से नीचे आने पर शेलों की संख्या बढ़ती जाती है। किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों में शेल की संख्या समान होती है, किंतु उसमें क्रमशः एक-एक इलेक्ट्रॉन की संख्या बढ़ती जाती है।
6. निम्नांकित में कौन-कौन-से तत्त्व रासायनिक दृष्टि में सदृश होंगे और क्यों ? इन तत्त्वों की परमाणु संख्याएँ कोष्ठक के अंदर दी गई हैं।
Na(11), F (9), K (19), P (15), Cs (55)
उत्तर – इन तत्त्वों में Na (11), K (19) एवं Cs (55) रासायनिक दृष्टि से सदृश हैं। इसका कारण है कि इनके शेलों में इलेक्ट्रॉनों का वितरण निम्नांकित प्रकार
Na11 — 2, 8, 1
K19 — 2, 8, 8, 1
Cs55 — 2, 8, 18, 18, 8, 1
इससे स्पष्ट होता है कि इनके संयोजकता इलेक्ट्रॉन की संख्या 1 है। अतः ये सभी तत्त्व आवर्त सारणी के वर्ग 1 के सदस्य हैं। किसी एक वर्ग के तत्त्वों के बाह्यतम इलेक्ट्रॉनिक विन्यास समान होने के कारण वे रासायनिक दृष्टि से समान होते हैं ।
7. सदृश गुणों के कारण फ्लुओरीन, क्लोरीन, ब्रोमीन और आयोडीन को आवर्त सारणी के एक ही वर्ग में रखा गया है। इनके किन्हीं दो सदृश गुणों का उल्लेख करें
उत्तर – फ्लुओरीन, क्लोरीन, ब्रोमीन और आयोडीन वर्ग 17 के सदस्य हैं। इनके परमाणु के बाह्यतम शेल में 7 इलेक्ट्रॉन होते हैं, अतः इनमें संयोजी इलेक्ट्रॉनों की संख्या 7 होती है ।ये एकइलेक्ट्रॉन प्राप्त कर अपने निकटतम अक्रिय गैस की स्थायी रचना प्राप्त कर लेते हैं। अतः इनकी संयोजकता 1 होती है। चूँकि ये 1 इलेक्ट्रॉन प्राप्त कर एकल संयोजक ऋणायन बनाते हैं, अतः ये विद्युतऋणात्मक तत्त्व हैं।
8. क्षार धातुओं के नाम लिखें। इन्हें आवर्त सारणी के एक ही वर्ग में क्यों रखा गया है ?
उत्तर – लीथियम (Li), सोडियम (Na), पोटैशियम (K), सीजियम (Cs) एवं फ्रांशियम (Fr) ‘ क्षार-धातु कहलाते हैं
इन सभी धातुओं के परमाणु का बाह्यतम इलेक्ट्रॉनिक विन्यास ns’ है अर्थात बाह्यतम शेल में 1 इलेक्ट्रॉन है। चूँकि आवर्त सारणी के किसी वर्ग के सभी तत्त्वों के परमाणु के बाह्यतम शेल का इलेक्ट्रॉनिक विन्यास समान होता है, अतः सभी क्षार धातुओं को वर्ग 1 में रखा गया है।
9. दूसरे आवर्त में सोडियम (Na) से क्लोरीन (Cl) की ओर बढ़ने पर परमाणु की त्रिज्या क्यों घटती जाती है
उत्तर – जब बाएँ से दाएँ चलते हैं, प्रोटॉनों की संख्या परमाणु संख्या के कारण बढ़ती है। इलेक्ट्रॉन भी बढ़ते हैं पर ये उसी में ही जुड़ते हैं। नाभिकीय आवेश बढ़ने के कारण इलेक्ट्रॉन नाभिक की ओर तेजी से आकृष्ट होते हैं और नाभिक के निकट हो जाते हैं। इसलिए परमाणु का आकार छोटा हो जाता है। यही कारण है कि सोडियम से क्लोरीन की ओर बढ़ने पर परमाणु त्रिज्या घटती जाती है।
10. आवर्त सारणी के वर्ग और आवर्त में तत्त्वों के धातुई गुण में किस प्रकार का परिवर्तन होता है ?
उत्तर – आवर्त सारणी के किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के धातुई गुण घटते जाते हैं। किसी वर्ग में ऊपर से नीचे आने पर तत्त्वों के धातुई गुण बढ़ते जाते हैं।
11. तत्त्वों के वर्गीकरण की आवश्यकता क्यों पड़ी ?
उत्तर – बहुत-से तत्त्वों के आविष्कार के पश्चात उनके गुणों के अलग-अलग अध्ययन करने में कठिनाई महसूस होने लगी। इस कारण से तत्कालीन वैज्ञानिकों ने समान गुणवाले तत्त्वों को समूहों में बाँटने का प्रयास प्रारंभ कर दिया, ताकि किसी विशेष समूह के तत्त्वों में से किसी एक के तत्त्व के गुणों का अध्ययन करके उस समूह के अन्य तत्त्वों के गुणों का पूर्वानुमान किया जा सके।
दीर्घ उत्तरीय प्रश्नन
1. तत्वों के वर्गीकरण के क्षेत्र में हुए कुछ प्रारंभिक प्रयासों का उल्लेख करें।
उत्तर – तत्वों के वर्गीकरण के क्षेत्र में हुए प्रारंभिक प्रयास निम्नलिखित हैं-
- धातु और अधातु में वर्गीकरण (Classification into metals and non-metals)—सर्वप्रथम 18वीं शताब्दी में लभ्वाजे ने तत्वों का वर्गीकरण धातु और अधातु में किया उनके अनुसार, कुछ गुण संभी धातुओं में समान रूप से पाए जाते हैं। उदाहरण के लिए; धातुएँ चमकीली, आघातवर्धनीय तथा तन्य होती हैं। ये ऊष्मा और विद्युत के सुचालक होते हैं तथा इनके ऑक्साइड भास्मिक होते हैं। इसी प्रकार अधातुओं में भी कुछ गुण समान रूप से पाए जाते हैं। उदाहरण के लिए है; अधातुएँ देखने में उदास होती हैं तथा इनमें आघातवर्धनीयता और तन्यता नहीं होती। ये ऊष्मा और विद्युत के कुचालक होती हैं तथा इनके ऑक्साइड अम्लीय होते हैं।
- संयोजकता के आधार पर वर्गीकरण (Classification based on Valency इसके अनुसार, समान संयोजकता वाले तत्वों को एक-साथ रखा गया यथा एकबंधन, द्विबंधन, त्रिबंधन आदि तत्वों को अलग वर्गों में विभाजित किया गया।
- डोबरेनर का त्रियक (Dobereiner’s triad)— 19वीं शताब्दी के प्रारंभ में जर्मन रसायनज्ञ डोबरेनर ने रासायनिक दृष्टि से सदृश तत्वों को तीन-तीन के समूहों में वर्गीकृत किया। ये समूह त्रियक (triads) कहलाते हैं। उन्होंने त्रियक के नियम की घोषणा की जिसके अनुसार, ‘त्रियक के तत्वों को उनके परमाणु द्रव्यमानों के क्रम में सजाने पर मध्यवर्ती तत्व का परमाणु द्रव्यमान किनारेवाले शेष दोनों तत्वों के द्रव्यमानों का औसत होता है।
- न्यूलैंड्स का अष्टक नियम (Nowlands iw of Octaves) 1865-66 में अंगरेज रसायनज्ञ जॉन न्यूलैंड्स ने अपने समय तक आविष्कृत तत्वों को उनके परमाणु द्रव्यमानों के क्रम में सजाकर एक नियम का प्रतिपादन किया जिसे न्यूलैंड्स का अष्टक नियम कहते हैं। इस नियम के अनुसार, यदि तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो किसी भी तत्व से प्रारंभ करने पर आठवें तत्व के गुण पहले तत्व के गुणों के समान होते हैं, जैसा कि संगीत का आठवाँ स्वर पहले स्वर के समान होता है।
यदि सोडियम (Na) से गिनती प्रारंभ की जाए तो आठवाँ तत्व पोटैशियम (K) आता है। इन दोनों तत्वों के गुण समान होते हैं। इसी प्रकार, बेरिलियम (Be) से गिनती प्रारंभ करने पर आठवाँ तत्व मैग्नीशियम (Mg) आता है, जिसके गुण बेरिलियम के गुणों के समान होते हैं।
- मेंडलीव का आवर्त नियम (Mendeleev’s Periodic law)–न्यूलैंड्स के अष्टक नियम से प्रेरित होकर 1869 में रूसी रसायनज्ञ दमित्री मेंडलीव (Dmitri Mendeleev) ने तत्वों के भौतिक और रासायनिक गुणों का गहन अध्ययन करके तत्वों के वर्गीकरण की एक नई प्रणाली विकसित की। तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाकर उन्होंने देखा कि
(a) तत्वों के गुणों में क्रमिक परिवर्तन होता है।(b) तत्वों की एक निश्चित संख्या के बाद लगभग समान गुणवाले तत्व पाए जाते हैं।अपने निष्कर्षों के आधार पर मेंडलीव ने एक नियम का प्रतिपादन किया जिसे मेंडलीव का आवर्त नियम कहते हैं। इस नियम के अनुसार, तत्वों के भौतिक व रासायनिक गुण उनके परमाणु द्रव्यमानों के आवर्तफलन होते हैं। दूसरे शब्दों में, यदि तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो एक निश्चित संख्या के बाद समान गुणवाले तत्व पाए जाते हैं।
2. मेंडलीव का आवर्त नियम क्या है ? इसके आधार पर बनायी गयी आवर्त सारणी की रूपरेखा क्या है ?
उत्तर – मेंडलीव का आवर्त नियम-तत्त्वों के भौतिक एवं रासायनिक गुण उनके परमाणु द्रव्यमानों (या भारों) के आवर्तफलन होते हैं। दूसरे शब्दों में, यदि तत्त्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो एक निश्चित संख्या के बाद समान गुणवाले तत्त्व पाए जाते हैं।
मेंडलीव के समय कुल 63 तत्त्व ज्ञात थे। मेंडलीव (1871) ने अपने आवर्त नियम के आलोक में तत्त्वों की एक सारणी का निर्माण किया, जिसे मेंडलीव की आवर्त सारणी कहते हैं। आवर्त सारणी को उदग्र एवं क्षैतिज कतारों द्वारा दो भागों में बाँटा गया है। उदग्र कतारों को वर्ग (group) तथा क्षैतिज कतारों का आवर्त (periods) कहते हैं। आवर्त सारणी में कुल मिलाकर 9 वर्ग एवं 7 आवर्त हैं। एक से लेकर सात तक के वर्ग में सामान्य तत्त्व हैं। आठवें वर्ग में संक्रमण तत्त्व हैं तथा शून्य वर्ग में निष्क्रिय गैसों को रखा गया है। मेंडलीव की आवर्त सारणी में केवल 8 ही वर्ग थे, क्योंकि उस समय तक निष्क्रिय गैसों का आविष्कार नहीं हुआ था।
3. मेंडलीव की आवर्त सारणी से क्या लाभ है ?
उत्तर – मेंडलीव की आवर्त सारणी की मुख्य लाभ / उपयोगिताएँ निम्नलिखित हैं-
- नियमित अध्ययन में सुविधा- इस सारणी से तत्वों और उनके गुणों का अध्ययन करना काफी आसान हो गया है। किसी वर्ग के किसी विशिष्ट तत्व तथा उसके यौगिकों के गुणों की जानकारी हो जाने पर इस वर्ग के अन्य तत्वों और उनके यौगिकों के गुणों का काफी हद तक पूर्वानुमान लगाया जा सकता है। उदाहरण के लिए, वर्ग IA के सोडियम (Na) का अध्ययन कर लेने से ही उस वर्ग के अन्य तत्वों के गुणों की जानकारी हो जाती है। इसी प्रकार, वर्ग VIIA में क्लोरीन (Cl) का अध्ययन कर लेने से उस वर्ग के अन्य तत्वों के गुणों का अंदाजा लगाया जा सकता है।
- नए तत्वों का पूर्वानुमान मेंडलीव ने अपनी सारणी का निर्माण करते समय कुछ अज्ञात तत्वों के लिए सारणी में कुछ रिक्त स्थान छोड़ दिए थे। किंतु उन्होंने यह स्पष्ट रूप से कहा कि आगे चलकर इन तत्वों का अविष्कार होने पर इन्हें इन रिक्त स्थानों में रखा जायेगा। साथ ही, उन्होंने उन तत्वों और उनके यौगिकों के संभावित मुख्य गुणों की भविष्यवाणी भी कर दी। प्रारंभ में तत्वों के नाम एका-बोरॉन (Eka-boron), एका-सिलिकन (Eka-Silicon) और एका-ऐलुमिनियम (Eka-Aluminium) रखे गए। बाद में ये तत्व वास्तव में आविष्कृत हुए और इनके नाम क्रमशः स्कैंडियम (Sc), जर्मेनियम (Ge) और गैलियम (Ga) पड़े। इन तत्वों को मेंडलीव द्वारा रिक्त छोड़े गए स्थानों में ही रखा गया।
उपरोक्त बातों से यह स्पष्ट है कि गैलियम (Ga) और जर्मेनियम (Ge) के गुण मेंडलीव द्वारा पूर्वानुमान गुणों के अनुरूप ही पाये गए हैं। यह मेंडलीव की दूरदर्शिता का परिचायक है।
- परमाणु द्रव्यमान में सुधार—मेंडलीव के समय कुछ तत्वों के परमाणु द्रव्यमान ग निकाले गए थे। किन्तु मेंडलीव ने अपनी आवर्त सारणी में उनके अन्य गुणों को ध्यान में रखकर उन्हें उचित स्थान पर रखा। बाद में इसी आवर्त सारणी के आधार पर उन तत्वों के ठीक-ठीक परमाणु ज्ञात किए गए।
उदाहरण के लिए, बेरिलियम (Be), इंडियम (In) और गोल्ड (Au) ।
- तत्वों की संयोजकता आवर्त सारणी के किसी वर्ग विशेष के सभी तत्वों की संयोजकता एक ही होती है, और किसी आवर्त में यह क्रमिक रूप से परिवर्तित होती है।
- हाइड्रोजन के सापेक्ष संयोजकता आवर्त सारणी के वर्गों में तत्वों की संयोजकता हाइड्रोजन के सापेक्ष 1 से 4 तक बढ़ती है। पुनः क्रमशः घटते हुए 4 से 1 हो जाती है। विभिन्न वर्गों के तत्वों के हाइड्राइड से इस बात की पुष्टि हो जाती है।
- ऑक्सीजन के सापेक्ष संयोजकता आवर्त सारणी के जिस वर्ग में तत्व होता है, ऑक्सीजन के सापेक्ष उसकी अधिकतम संयोजकता वर्ग की संख्या के बराबर होती है। आवर्त 3 के तत्वों की उच्चतम अवस्था वाले ऑक्साइडों से इस बात की पुष्टि हो जाती है।
- अनुसंधान कार्य में सहायता-आवर्त सारणी में किसी तत्व-विशेष का स्थान देखकर यह निश्चयात्मक रूप से हम यह कह सकते हैं कि इस तत्व का अन्य तत्वां के साथ किस प्रकार का संबंध होगा। अतः रसायनशास्त्र के क्षेत्र में अनुसंधान करनेवाले वैज्ञानिकों के लिए यह सारणी अत्यंत उपयोगिता प्रमाणित हुई है।
4. आधुनिक आवर्त सारणी का उल्लेख करते हुए बताएँ कि इस आधार पर बनी आवर्त सारणी की मुख्य उपयोगिताएँ क्या हैं ?
उत्तर – परमाणु संख्या के आधार पर तत्वों को सजाकर आवर्त सारणी को संशोधित रूप में प्रस्तुत किया गया जिसे आधुनिक आवर्त सारणी कहते हैं। इसे आवर्त सारणी का दीर्घ या वृहत रूष (Long or extended form of the periodic table) भी कहते हैं।
आधुनिक आवर्त सारणी में उपवर्ग A और B को अलग-अलग करके वर्गों की संख्या बढ़ा दी गई है। इस प्रकार आवर्त सारणी में अब 18 वर्ग हो गए हैं।
IUPAC (International Union of Pure And Applied Chemistry) के नवीनतम अनुशंसा के अनुसार, आवर्त सारणी के वर्गों के संख्याओं को अरबी अंकों में (1, 2, 3, 4 से लेकर 18 तक) व्यक्त किया गया है, पुराने प्रचलन में वर्गों को रोमन अंकों (I, II, III, IV…. VIII) में व्यक्त किया गया था।
उपयोगिताएँ — आधुनिक आवर्त सारणी की मुख्य उपयोगिताएँ निम्नलिखित है –
- तत्वों को बढ़ते परमाणु क्रमांक में व्यवस्थित किया गया है।
- इस आवर्त सारणी में 18 ऊर्ध्वाधर स्तंभ है जो कि वर्ग कहलाते हैं।
- वर्ग 3 से वर्ग 12 में संक्रमण तत्व रखे गए हैं।
- आधुनिक आवर्त सारणी में उत्कृष्ट गैसों को वर्ग 18 में व्यवस्थित किया गया है।
- तत्वों के समस्थानिकों को उनके संगत तत्वों के स्थान पर ही रखा गया है क्योंकि उनके परमाणु क्रमांक समान होते हैं।
- रासायनिक रूप से असमान तत्वों को पृथक्-पृथक् वर्गों में रखा गया है।
- इसमें वर्गीकरण का आधार परमाणु क्रमांक है। इस प्रकार मेंडलीव में वर्णित प्रतिलोम क्रम संबंधी दोष को दूर कर दिया है।
5. किन अर्थों में आधुनिक आवर्त सारणी मेंडलीव की आवर्त सारणी से भिन्न है ?
उत्तर – मेंडलीव ने तत्वों को न केवल उनके गुणों के आधार पर वर्गीकरण करने का प्रयास किया, बल्कि किसी ऐसे आधार की खोज करने की कोशिश की जो किसी निश्चित तत्व के बहुत से गुणों की भविष्यवाणी कर सके। परमाणु भार ही एक ऐसा गुण था जिसने उसकी पूर्ण रूप से सहायता की।
चित्र में आवर्त सारणी का आधुनिक रूप दिखाया गया है जिसमें 105 तत्वों को उचित स्थान दिया गया है।

मेंडलीव द्वारा दी गई आवर्त सारणी दोषपूर्ण थी। बहुत से तत्वों के आइसोटोप मिलते थे जिनके परमाणु पुंज भिन्न-भिन्न थे। अतः सारणी में हरेक के लिए अलग-अलग स्थान होना चाहिए। परंतु ऐसा नहीं किया जा सकता था। इसी दौरान मैंडलीव को अपनी त्रुटि का आभास हो गया। इस सारणी की मेंडलीव की आवर्त सारणी से तुलना करने पर आप पायेंगे कि वे तत्व जिनको उसने वर्गीकृत किया, अब भी अपने उसी स्थान पर है। सारणी को देखने पर पता चलता है कि परमाणु क्रमांक एक तत्व से दूसरे तत्व तक बढ़ता जाता है। परमाणु भार में जो अनियमितताएँ थीं, इस दीर्घ सारणी में हल हो गई।
मेंडलीव ने संशोधित आवर्त नियम प्रस्तुत किया, जिसे आधुनिक आवर्त नियम कहा गया है। इस नियम के अनुसार तत्वों के गुणं अपने परमाणु क्रमांकों के आवर्ती फलन (Periodic Functions) हैं।
6. किसी तत्त्व का आधुनिक आवर्त सारणी में स्थान की सहायता से उसके गुणों का पुर्वानुमान कैसे किया जा सकता है ?
उत्तर – आधुनिक आवर्त सारणी में तत्वों को उनकी परमाणु संख्या के बढ़ते क्रम में सजाया गया है। इसकी सहायता से तत्व के परमाणु के गुणों की जानकारी प्राप्त की जा सकती है। आवर्त सारणी में तत्व का स्थान जानकर निम्नलिखित सूचनाएँ प्राप्त की जाती हैं।
- आवर्त सारणी में तत्व के स्थान की संख्या उसकी परमाणु संख्या के बराबर होती है। अतः आवर्त सारणी में तत्व के स्थान से उसकी परमाणु संख्या की जानकारी हो जाती है। परमाणु संख्या तत्व के परमाणु के नाभिक में प्रोटॉनों की संख्या तथा बाह्य कक्षाओं में इलेक्ट्रॉनों की संख्या के बराबर होती है। अत: तत्त्व की परमाणु संख्या से उसकी परमाणु रचना ज्ञात हो जाती है।
- आवर्त सारणी में वर्ग एवं आवर्त की संख्या से क्रमशः उसके संयोजी इलेक्ट्रॉन की संख्या एवं इलेक्ट्रॉन कक्षा की संख्या ज्ञात हो जाती है।
- संयोजी इलेक्ट्रॉनों की संख्या से यह अनुमान लगाना आसान हो जाता है कि तत्व में धातुई गुण है या अधातुई गुण। यदि तत्व के परमाणु में 1, 2 या 3 संयोजी इलेक्ट्रॉन हैं तो वह तत्व धातु होगा। इसके विपरीत, तत्व के परमाणु में 4 या अधिक संयोजी इलेक्ट्रॉन है तो वह तत्व अधातु होगा।
- शेलों (कक्षाओं) की कुल संख्या की जानकारी होने से तत्व के परमाणु के आकार के संबंध में कुछ जानकारी प्राप्त हो जाती है।
- आवर्त सारणी में तत्व के स्थान से उसकी क्रियाशीलता की कुछ जानकारी हो जाती है।
7. मेंडलीव की आवर्त सारणी के रिक्त स्थानों का क्या महत्व है ?
उत्तर – मेंडलीव ने अपनी आवर्त सारणी के कुछ रिक्त स्थानों को छोड़ दिया। इन रिक्त स्थानों को दोष के रूप में देखने के बजाय मेंडलीव ने दृढ़तापूर्वक कुछ ऐसे तत्वों के अस्तित्व का अनुमान किया जो उस समय तक ज्ञात नहीं थे। इनका नामकरण उन्होंने उसी समूह में इससे पहले आने वाले तत्व के नाम में एका (संस्कृति शब्द) उपसर्ग लगाकर किया। जैसे बाद में ज्ञात होने वाले स्कैंडियम (Sc), गैलियम (Ga) और जर्मेनियम (Ge) के गुणधर्म क्रमश: एका – बोरॉन, एका ऐलुमिनियम तथा एका-सिलिकॉन के समान थे।
8. ‘तत्वों के गुण उनकी परमाणु संख्या के आवर्त फलन होते हैं।’ इस कथन का क्या तात्पर्य है ?
उत्तर – कथन- “तत्वों के गुण उनके परमाणुओं के आवर्ती फलन (functions) हैं।” आधुनिक आवर्त नियम कहलाता है।
आवर्तता या आवर्त फलन (Periodic function)-आवर्त फलन का अर्थ है कि जब तत्वों को एक विशेष समूह ऊर्ध्वाधर पंक्ति में उनके परमाणुओं के बढ़ते क्रम में व्यवस्थित किया जाता है, तो उनके गुणों की पुनरावृत्ति होती है। ऊर्ध्वाधर पंक्ति में रखे गए तत्वों के गुणों की 2, 8, 8, 18, 18, 3 परमाणु अंकों के लगातार अंतर से पुनरावृत्ति होती है। इनके अंकों को जादू के अंक (Magic Numbers) कहते हैं।
तत्वों के गुण उनके परमाणु के विभिन्न ऊर्जा स्तरों में इलेक्ट्रॉनों के विभाजन मुख्यतः संयोजक ऊर्जा स्तर में इलेक्ट्रॉनों के विभाजन पर निर्भर करते हैं। उन परमाणुओं को, जिनके संयोजक ऊर्जा स्तुर में इलेक्ट्रॉन विन्यास एक जैसा होता है, एक जैसे गुण प्रदर्शित करते हैं। जब तत्वों को आवर्त सारणी में उनके परमाणु अंकों के बढ़ते क्रम के आधार पर व्यवस्थित किया जाता है तो तत्वों के संयोजकता ऊर्जा स्तर में समान इलेक्ट्रॉन विन्यास की मैजिक अंक 2, 8, 8, 18, 18 और 32 के बाद क्रमश: एक विशेष लंबात्मक पंक्ति (समूह) में पुनरावृत्ति होती है।
9. निम्नलिखित पदों की व्याख्या करें—
(a) वर्ग
(b) आवर्त
(c) सामान्य तत्व और
(d) संक्रमण तत्व
उत्तर – (a) वर्ग (Groups) – आवर्त सारणी की उदग्र स्तंभों को वर्ग कहते हैं। इन्हें रोमन अंकों (I, II, III ….. VIII) द्वारा निरूपित किया जाता है।
(b) आवर्त (Periods) — आवर्त सारणी की क्षैतिज कतारें आवर्त कहलाती हैं। सारणी 1 से लेकर 7 तक कुल सात आवर्त हैं।
(c) सामान्य तत्व – वैसे तत्व जिनकी क्रियाशीलता सामान्य होती है। उन्हें सामान्य तत्व कहा जाता है, जैसे— Na, Sc, Sb
(d) संक्रमण तत्व – – आवर्त सारणी में तत्व के स्थान से उस तत्व की अत्यधिक क्रियाशीलता को संक्रमण तत्व कहा जाता है। जैसे—Cu, Fe, Cr, Co। लैन्थेनम से प्रारंभ होने वाले संक्रमण तत्वों की श्रेणी लैन्थेनाइट्स कहलाती है। साथ ही ऐटीनियम से प्रारंभ होने वाले संक्रमण तत्वों की श्रेणी ऐटीनाइट्स कहलाती है।
10. आवर्त सारणी के वर्ग 1 के तीन तत्वों A, B और C की परमाणु त्रिज्याएँ, के 155pm, 190pm pm और 235 pm हैं। कारण देकर इन तत्वों को वर्ग में बढ़ती हुई परमाणु संख्याओं के क्रम में सजाएँ।
उत्तर – आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर परमाणु का आकार बढ़ता जाता है, क्योंकि प्रत्येक तत्व के बाद वाले तत्व में इलेक्ट्रॉनों का एक नया शेल है। इस प्रकार आवर्त सारणी के वर्ग 1 के तीन तत्वों A, B और C की परमाणु त्रिज्याएँ क्रमश: 155 pm, 190 pm और 235 pm हैं। इन्हें बढ़ती हुई परमाणु संख्याओं के क्रम में सजाने पर निम्नलिखित तालिका प्राप्त होती है—

11. (i) आवर्त सारणी के आधार पर तत्वों के गुणों में आवर्तिता का क्या अर्थ है ?
(ii) एक ही समूह के सभी तत्वों के गुण समरूप क्यों होते हैं ?
(iii) किसी आवर्त में बायीं से दायीं ओर जाने पर परमाणुओं के इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी और क्यों ?
उत्तर – (i) आवर्त सारणी में बढ़ती हुई परमाणु संख्या के साथ तत्वों के रासायनिक गुणों की नियमित पुनरावृत्ति रासायनिक आवर्तिता कहलाती है।
(ii) एक ही समूह वर्ग के सभी तत्व के इलेक्ट्रॉनों की संख्या समान होती है। उदाहरण, वर्ग 17 जो फ्लुओरीन के स्तंभ हैं उस स्तंभ के अंतर्गत आने वाले सभी तत्व जैसे F, Cl, Br, I इनके बाह्यतम कोष में इलेक्ट्रॉन की संख्या 7 होती है। साथ ही यह सभी तत्व अधातुएँ हैं।
(iii) आवर्त के इलेक्ट्रॉन एक-एक करके एक ही ऊर्जा कोश में भरता है। प्रत्येक इलेक्ट्रॉन के भरने के साथ नाभिक आवेश एक यूनिट बढ़ जाता है। परिणामतः इलेक्ट्रॉनों का आकर्षण नाभिक की ओर लगातार बढ़ता जाता है। ऐसा होने से परमाणु त्रिज्या घट जाती है। अर्थात् आवर्त में बाईं ओर से दाईं और जाने पर परमाणु आकार धीरे-धीरे घटता जाता है।
12. नोचे दी गई मॅडलीव आवर्त सारणी के आधार पर निम्नलिखित प्रश्नों के उत्तर लिखें।
(i) उस तत्व का लिखें जो
(क) समूह I तथा आवर्त 3 में है।
(ख) समूह VII तथा आवर्त 2 में है।
(ii) निम्नलित के लिए सूत्र सुझाएँ
(क) नाइट्रोजन का ऑक्साइड
(ख) ऑक्सीजन का हाइड्राइड
(iii) आवर्त सारणी के समूह VIII में कोबाल्ट को, जिसका परमाणु द्रव्यमान 58.93 है, निकेल जिसका परमाणु द्रव्यमान 58.71 है, से पहले क्यों रखा गया
है ?
(iv) गैलियम के अतिरिक्त उन दो अन्य तत्वों के नाम लिखें जिनकी खोज मेंडलीव के अपनी आवर्त सारणी में रिक्त स्थान छोड़ने के बाद हुई ?
(v) Li, Na तथा K के परमाणु द्रव्यमानों का उपयोग करके Liतथा K का औसत परमाणु द्रव्यमान ज्ञात करें और इसकी तुलना Na के परमाणु द्रव्यमान से करें। इस क्रियाकलाप द्वारा निकाले गये निष्कर्ष का उल्लेख करें।
उत्तर – (i) (क) सोडियम (Na), (ख) फ्लुओरीन (F)
(ii) (क) N2O5, (ख) OH2
(iii) आवर्त सारणी व्यवस्थित करते समय मेंडलीव को सारणी में अधिक द्रव्यमान वाले तत्व को कभी-कभी कम द्रव्यमान वाले तत्व से पहले रखना पड़ा। क्रम इसलिए उलटना पड़ा ताकि समान गुणधर्म वाले तत्वों को एक साथ रखा जा सके। यही कारण है कि आवर्त सारणी के समूह VIII में कोबाल्ट को जिसका परमाणु द्रव्यमान 58.93 है, निकेल जिसका परमाणु द्रव्यमान 58.71 है, से पहले रखा गया।
(iv) गैलियम (Ga) के अतिरिक्त स्कैडियम (Sc) तथा जर्मेनियम (Ge) की खोज मेंडलीव सारणी में रिक्त के स्थानों के छोड़ने के बाद हुई। के आवर्त
(v) तत्व परमाणु द्रव्यमान
लिथियम 7
सोडियम 23
पोटैशियम 39
लिथियम और पोटैशियम के परमाणु द्रव्यमानों का औसत 
सोडियम का परमाणु द्रव्यमान = 23 क्योंकि सोडियम का परमाणु द्रव्यमान 23 होता है।
निष्कर्ष – अत: Li और K का औसत परमाणु द्रव्यमान भी 23 है। फलतः हम कह सकते हैं कि लिथियम (Li) + पोटैशियम (K) का औसत परमाणु द्रव्यमान = सोडियम का परमाणु द्रव्यमान ।
अथवा, (i) हम तत्वों का वर्गीकरण क्यों करते हैं
उत्तर – आरंभ में जब बहुत ही कम तत्व ज्ञात थे तब उनके गुणों का अलग-अलग अध्ययन करने में कोई कठिनाई नहीं थी। किंतु जब एक-एक करके बहुत से तत्वों का आविष्कार हुआ तो उनके गुणों का अलग-अलग अध्ययन करने में काफी कठिनाई महसूस होने लगी। इस कारण वैज्ञानिकों ने समान गुणवाले तत्वों को समूहों में दिया ताकि किसी विशेष समूह के किसी एक तद्त्व के गुणों का अध्ययन करके उस समूह के अन्य तत्वों के गुणों का पूर्वानुमान किया जा सके।
(ii) आवर्त सारणी का निर्माण करते समय मेंडलीव द्वारा अपनाए गए दो मापदंड क्या थे ?
उत्तर – आवर्त सारणी का निर्माण करते समय मेंडलीव द्वारा अपनाए गए दो मापदंड निम्नलिखित हैं
(i) तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमान के क्रम में सजाया।
(ii) समान गुण वाले तत्वों को एक समूह में रखने का प्रयास किया।
(iii) मेंडलीव ने अपनी आवर्त सारणी में कुछ रिक्त स्थान क्यों छोड़ दिए थे ?
उत्तर – मेंडलीव ने अपनी आवर्त सारणी में कुछ रिक्त स्थान छोड़ दिए क्योंकि उनमें किसी भी ज्ञात तत्व का समावेश नहीं हो पाता था। बाद में चलकर स्कैडियम (Sc), गैलियम (Ga) और जर्मेनियम (Ge) का आविष्कार होने पर उन्हें इन रिक्त स्थानों में रखा गया।
(iv) मेंडलीव की आवर्त सारणी में हीलियम, निऑन तथा आर्गन जैसी उत्कृष्ट गैसों का उल्लेख क्यों नहीं किया गया था ?
उत्तर – मेंडलीव की आवर्त सारणी में हीलियम (He), निऑन (Ne) तथा आर्गन (Ar) जैसी उत्कृष्ट गैसों का उल्लेख इसलिए नहीं किया गया था कि उस समय तक इन उत्कृष्ट गैसों का आविष्कार नहीं हुआ था।
(v) क्या आप क्लोरीन के दो समस्थानिकों Ci – 35 तथा Cl – 37 को उनके परमाणु द्रव्यमान भिन्न होने के कारण भिन्न-भिन्न स्थानों पर रखना पसंद करेंगे अथवा रासायनिक गुण समान होने के कारण एक ही स्थान पर रखेंगे ? अपने उत्तर की पुष्टि करें।
उत्तर – तत्वों के वर्गीकरण के लिए परमाणु संख्या अधिक उपयोगी मौलिक गुण है परमाणु द्रव्यमान नहीं, यही कारण है कि हम क्लोरीन के दो समस्थानिकों Cl – 35 तथा Cl – 37 को उनके परमाणु द्रव्यमान भिन्न-भिन्न होने के कारण भिन्न-भिन्न स्थानों पर रखना पसंद करते हैं। कारण एक ही स्थान पर रखेंगे क्योंकि दोनों ही समस्थानिकों अथवा रासायनिक गुण समान होने के की परमाणु संख्या एक समान है अतः इन्हें एक ही स्थान पर रखा जा सकता है।
13. तत्वों के गुणों के संदर्भ में तत्व को परमाणु संख्या उसके परमाणु द्रव्यमान की तुलना में अधिक मौलिक गुण है, कैसे ?
उत्तर – 1913 में, मोसले ने बताया कि यदि X– किरणों की कंपनावृत्ति के वर्गमूल और लक्षित तत्व की परमाणु संख्या के बीच लेखाचित्र खींचा जाए तो एक सीधी रेखा प्राप्त होती है। किंतु X– किरणों की कंपनावृत्ति के वर्गमूल और लक्षित तत्व के परमाणु द्रव्यमान के बीच लेखाचित्र खींचने पर सीधी रेखा नहीं प्राप्त होती है। इससे उन्होंने निष्कर्ष निकाला कि परमाणु द्रव्यमान नहीं, बल्कि परमाणु संख्या ही तत्व का अधिक मौलिक गुण है।
अन्य महत्त्वपूर्ण प्रश्न एवं उनके उत्तर
वस्तुनिष्ठ प्रश्न
1. सही उत्तर का संकेताक्षर (क, ख, ग या घ) लिखें।
1. तत्व X, XCl2 सूत्र वाला एक कलोराइड बनता है, जो एक ठोस है और जिसका गलनांक अधिक हैं। आवर्त सारणी में यह तत्व संभवतः किस समूह के अंतर्गत होगा ?
(क) Na f
(ख) Mg
(ग) Al
(घ) Si
उत्तर – (ख)
2. A, B और C डोबेराइनर के त्रिक के तत्व हैं। यदि A का परमाणु द्रव्यमान 7 और का 39 है तो B का परमाणु द्रव्यमान होगा
(क) 32
(ख) 11
(ग) 23
(घ) 46
उत्तर – (ग)
3. आधुनिक आवर्त सारणी में कुल समूह है ?
(क) 18
(ख) 8
(ग) 7
(घ) 10
उत्तर – (क)
4. समूह 13 से समूह 18 तक के तत्वों को कहते हैं ?
(क) s-ब्लॉक तत्व
(ख) d-ब्लॉक तत्व
(ग) f-ब्लॉक तत्व
(घ) p-ब्लॉक तत्व
उत्तर – (घ)
5.आवर्त सारणी के किसी वर्ग में ऊपर से नीचे जाने पर, परमाणुओं का आकार-
(क) बढ़ता है
(ख) घटता है
(ग) समान रहता है
(घ) कोई नहीं
उत्तर – (क)
6. दीर्घ आवर्त सारणी में सभी अधातुएँ वस्तुएँ रखी गई हैं
(क) s-ब्लॉक में
(ख) p-ब्लॉक में
(ग) f-ब्लॉक में
(घ) d-ब्लॉक में
उत्तर – (ख)
7. परमाणु द्रव्यमान-परमाणु आयतन का वक्र किसने बनाया –
(क) न्यूलैंड
(ख) मेंडलीव
(ग) डोबेराइनर
(घ) लोथर मेयर
उत्तर – (घ)
8. मेंडलीव ने बोरॉन तथा ऐल्युमिनियम के बीच में नए तत्व के लिए खाली स्थान छोड़ा था जो बाद में खोजा गया था। यह तत्व है
(क) Na
(ख) Ca
(ग) Ga
(घ) Ba
उत्तर – (ग)
9. आवर्त सारणी के किसी वर्ग के सभी तत्वों में समान होती है
(क) इलेक्ट्रॉनों की संख्या
(ख) संयोजकता इलेक्ट्रॉनों की संख्या
(ग) परमाणु द्रव्यमान
(घ) परमाणु क्रमांक
उत्तर – (ख)
10. मेंडलीव के तत्वों का वर्गीकरण का आधार था
(क) परमाणु आयतन
(ख) परमाणु घनत्व
(ग) परमाणु द्रव्यमान
(घ) परमाणु संख्या
उत्तर – (ग)
11. मेंडलीव की आवर्त सारणी में कितनी क्षैतिज कतारें थीं
(क) 8
(ख) 12
(ग) 6
(घ) 14
उत्तर – (ग)
12. परमाणु के तीसरे कोश में अधिक से अधिक कितने इलेक्ट्रॉन रह सकते हैं ?
(क) 2
(ख) 6
(ग) 8
(घ) 18
उत्तर – (ग)
13. किस आवर्त में सबसे अधिक तत्त्व होते हैं ?
(क) चौथा
(ख) पाँचवाँ
(ग) छठा
(घ) सातवाँ
उत्तर – (ग)
14. कौन शून वर्ग का तत्त्व है ?
(क) Ca
(ख) Br
(ग) He
(घ) Li
उत्तर – (ग)
15. न्यूलैंड ने अष्टक नियम कब दिया था ?
(क) सन् 1893 में
(ख)सन् 1892 में
(ग) सन् 1793 में
(घ) सन् 1883 में
उत्तर – (क)
16. Li, Be, B, Na को बढ़ती आयनन ऊर्जा के क्रम में व्यवस्थित कीजिए।
(क) Na < Li < B < Be
(ख) Na> Li> Be > B
(ग) Na> Li> B> Be
(घ) Na< B< Li< Be
उत्तर – (क)
17. अब तक कितने तत्त्वों का पता लग चुका है ?
(क) 118
(ख) 114
(ग) 104
(घ) 116
उत्तर – (ख)
18. मेंडलीव ने आवर्त नियम कब दिया था ?
(क) सन् 1889 में
(ख) सन् 1899 में
(ग) सन् 1669 में
(घ) सन् 1869 में
उत्तर – (घ)
19. Cl, F, Br, I में इलेक्ट्रॉन-बंधुता सबसे अधिक किसकी है ?
(क) F परमाणु की
(ख) I परमाणु की
(ग) Cl परमाणु की
(घ) Br परमाणु की
उत्तर – (ग)
20. किस रासायनिक परिवार की आयनन ऊर्जा का मान सबसे अधिक होता है ?
(क) निष्क्रिय गैसें
(ख) दोनों
(ग) उत्कृष्ट गैसें
(घ) इनमें से कोई नहीं
उत्तर – (ग)
II. रिक्त स्थानों की पूर्ति करें।
1. वर्ग में ऊपर से नीचे आने पर धातुओं की क्रियाशीलता ……… है।
उत्तर – घटती
2. आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के परमाणु आकार ………… है।
उत्तर – घटते
3. किसी तत्त्व का इलेक्ट्रॉनिक विन्यास 2, 8, 6 है, उसका संयोजी इलेक्ट्रॉन ……. हैं।
उत्तर – 6
4. वर्ग में ऊपर से नीचे आने पर धातुओं की क्रियाशीलता ………. हैं।
उत्तर – बढ़ती
5. आधुनिक आवर्त सारणी का आधार है …………।
उत्तर – परमाणु क्रमांक
6. दीर्घ रूप में आवर्त सारणी में ………… समूह होते हैं।
उत्तर – 18
7. आधुनिक आवर्त सारणी में ………. आवर्त है।
उत्तर – 7
8. परमाणु के दूसरे कोश में अधिकतम ……… इलेक्ट्रॉन हो सकते हैं।
उत्तर – 8
9. तत्त्वों के गुण उनके ……..के आवर्ती फलन होते हैं।
उत्तर – परमाणु संख्या
10. किसी आवर्त में बाईं से दाईं ओर जाने पर अधात्विक गुण ………..0जाते हैं।
उत्तर – बढ़ते
III. सही / गलत का चयन करें।
1.आवर्त-सारणी के किसी वर्ग में बढ़ने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिक होती है।
उत्तर – गलत
2. आवर्त सारणी में आवर्ती की कुल संख्या 7 है।
उत्तर – सही
3. आवर्त सारणी के उदग्र स्तंभ को आवर्त कहते हैं।
उत्तर – गलत
4. वर्ग 1 के तत्व क्षार धातु कहलाते हैं ।
उत्तर – सही
5. आवर्त सारणी के वर्ग 0 या वर्ग 18 वाले तत्व गैस हैं। जिन्हें उत्कृष्ट गैस कहते हैं।
उत्तर – सही
6. अब तक हमें 107 तत्व ज्ञात हो चुके हैं।
उत्तर – गलत
7. मेंडलीव के समय 63 तत्व ज्ञात थे।
उत्तर – सही
8. प्रथम आवर्त में 3 तत्व हैं।
उत्तर – गलत
9. आवर्त सारणी के दाईं ओर धातुएँ स्थित हैं।
उत्तर – गलत
10. किसी वर्ग के सभी सदस्य तत्वों के रासायनिक गुण समान होते हैं।
उत्तर – सही
अतिलघु उत्तरीय प्रश्न
1. आधुनिक आवर्त सारणी में तत्वों के वर्गीकरण का आधार क्या है ?
उत्तर – परमाणु संख्या ।
2. मेन्डेलीफ की आवर्त सारणी में तत्वों के वर्गीकरण का आधार क्या है ?
उत्तर – परमाणु द्रव्यमान ।
3. डॉबेराइनर द्वारा किए गए वर्गीकरण का क्या आधार था ?
उत्तर – परमाणु द्रव्यमान ।
4. डॉबेराइनर के द्वारा बनाए गए तीन तत्वों का समूह का क्या नाम था ?
उत्तर – डॉबेराइनर त्रिक
5. हाइड्रोजन को किस समूह एवं आवर्त में रखना चाहिए ?
उत्तर – प्रथम समूह एवं प्रथम आवर्त ।
6. मेंडलीफ के समय कुल कितने तत्व ज्ञात थे ?
उत्तर – 63
7. प्रथम आवर्त में कितने तत्व रहते हैं ?
उत्तर – 2
8. दूसरे आवर्त में कितने तत्व रहते हैं ?
उत्तर – 8
9. तीसरे आवत में तत्वों की संख्या कितनी है ?
उत्तर – 8
10. आधुनिक आवर्त सारणी में कुल कितने आवर्त्त एवं वर्ग हैं ?
उत्तर – आवर्त – 7, वर्ग- 18
11. आधुनिक आवर्त सारणी में उदग्र स्तम्भों की संख्या कितनी है ?
उत्तर – 18
12. तब X, XCl सूत्र वाला एक क्लोराइड बनाता है, जो एक ठोस है तथा जिसका गलनांक अधिक है। आवर्त सारणी में यह तत्व संभवतः किस समूह के अन्तर्गत होगा ?
(a) Na. (b) Mg. (c) Al, (d) Si
उत्तर – (b) Mg क्योंकि इस समूह के क्लोराइड का अणु सूत्र XCl2 है।
13. आवर्त सारणी के किस ओर धातुएँ स्थित हैं ?
उत्तर – बाईं ओर।
14. आवर्त सारणी के किस और अधातुएँ स्थित हैं ?
उत्तर – दाईं ओर।
15. भेंडलीफ के वर्गीकरण का आधार क्या है ? परमाणु द्रव्यमान या परमाणु क्रमांक ?
उत्तर – परमाणु द्रव्यमान ।
16. परमाणु द्रव्यमान तथा परमाणु क्रमांक दोनों में से कौन सा गुण तत्व का अधिक मौलिक (मूलभूत) गुण है ?
उत्तर – परमाणु क्रमांक ।
17. किसी वर्ग के सभी सदस्य तत्वों के कौन-से गुण के समान होते हैं ?
उत्तर – रासायनिक गुण
18. आवर्त सारणी में क्षारीय मृदा धातुओं का स्थान बताइए।
उत्तर – क्षारीय मृदा धातुएँ आवर्त सारणी में बायीं तरफ II-A वर्ग में स्थित है।
19. IA वर्ग के तत्वों का सामान्य नाम क्या है ?
उत्तर – IA वर्ग के तत्वों को क्षार धातुएँ कहते हैं।
20. आवर्त सारणी में शून्य वर्ग तथा IA वर्ग कहाँ स्थित है ?
उत्तर – आवर्त सारणी में शून्य वर्ग दाहिने तरफ (अन्त में) स्थित है तथा IA वर्ग बायीं तरफ स्थित है।
21. किसी आवर्त में बायीं तरफ से दाहिने तरफ जाने पर तत्वों के धात्विक गुण किस प्रकार बदलते हैं ?
उत्तर – किसी आवर्त में बायीं तरफ से दाहिनी तरफ जाने पर तत्वों का धात्विक गुण घटता है।
22. किसी आवर्त में बायीं तरफ से दाहिनी तरफ जाने पर परमाणु का आकार किस प्रकार परिवर्तित होते हैं ?
उत्तर – किसी आवर्त में बायीं तरफ से दाहिनी तरफ जाने पर परमाणु का आकार घटता जाता है।
23. किसी वर्ग में ऊपर से नीचे आने पर संयोजकता में क्या परिवर्तन होता है ?
उत्तर – एक ही वर्ग के सभी तत्वों की संयोजकता समान होती है।
24. किसी तत्व की संयोजकता एवं आवर्त सारणी में उसकी वर्ग संख्या में क्या सम्बन्ध है ?
उत्तर – क्रिसी तत्व की संयोजकता आवर्त सारणी में उसकी वर्ग संख्या के बराबर होती है।
25. किसी वर्ग में परमाणु का आकार किस प्रकार बदलता है ?
उत्तर – वर्ग में ऊपर से नीचे की ओर आने पर परमाणु का आकार बढ़ता चला जाता है।
26. आधुनिक आवर्त सारणी के पहले दस तत्वों में कौन-से धातु हैं ?
उत्तर – पहले दस तत्व हैं— H, He, Li, Be, B, C, N, O, F तथा Ne इन सब तत्वों में से धातु हैं— Li तथा Be.
27. अब तक कितने तत्वों का पता लग चुका है ?
उत्तर – अब तक 114 तत्त्वों का पता लग चुका है।
28. डॉबेराइनर के त्रिक की क्या विशेषता है ?
उत्तर – इसकी विशेषता है कि त्रिक के मध्य तत्त्व का परमाणु भार अन्य तत्त्वों के परमाणु भार का लगभग माध्य है।
29. न्यूलंड ने अष्टक नियम कब दिया था ?
उत्तर – सन् 1893 में।
30. मेंडलीफ का आवर्त नियम लिखिए।
उत्तर – तत्त्वों के भौतिक और रासायनिक गुण उनके परमाणु भार के आवर्त फलन होते हैं।
31. लघु आवर्त (Short periods) किसे कहते हैं ?
उत्तर – पहले तीन आवत को तत्त्वों की संख्या कम होने के कारण लघु आवर्त कहते हैं ।
32. दीर्घ आवर्त (Long periods) किसे कहते हैं ?
उत्तर – तत्त्वों की संख्या की अधिकता के कारण चौथे से सातवें तक आवर्गों को दीर्घ आवर्त
33. आयनन ऊर्जा कब बढती है ?
उत्तर – किसी आवर्त में बायें से दायें चलने पर तत्त्वों की आयनन ऊर्जा बढ़ती जाती है।
34. मेंडलीव ने आवर्त नियम कब दिया था ?
उत्तर – सन् 1869 में।
35. सोडियम आयन का सकेन एवं इलेक्ट्रॉनिक विन्यास लिखें।
उत्तर – सोडियम आयन का संकेत : Na+
इलेक्ट्रॉनिक विन्यास = 2, 8
36. मेंडलीफ द्वारा तत्त्वों के वर्गीकरण के समय कितने तत्त्व ज्ञात थे ?
उत्तर – मात्र 63 तत्त्व।
37. तीन वैद्युत धनात्मक तत्त्वों का नाम लिखें।
उत्तर – सोडियम (Na), बेरियम (Ba) एवं एल्युमिनियम (Al)।
38. कुछ विद्युत ऋणात्मक तत्त्वों का नाम लिखें।
उत्तर – क्लोरीन (Cl), फ्लोरीन (F), आयोडीन (I) आदि।
39. संयोजी इलेक्ट्रॉन किसे कहते हैं ?
उत्तर – तत्त्वों के बाहरी कक्षा में स्थित इलेक्ट्रॉन को संयोजी इलेक्ट्रॉन कहते हैं।
40. कार्बन वाले वर्ग के अन्य दो तत्वों के नाम लिखें।
उत्तर – सिलिकॉन, जर्मेनियम, टिन आदि।
41. मेंडलीफ के आवर्त्त नियम को लिखें।
उत्तर – तत्त्वों के भौतिक व रासायनिक गुण उनके परमाणु द्रव्यमानों के आवर्त्त फलन होते हैं।
42. दो उत्कृष्ट गैसों के नाम लिखें।
उत्तर – हीलियम (He), नियॉन (Ne)।
43. तीन उपधातुओं के नाम लिखें।
उत्तर – बोरॉन, सिलिकन, जर्मेनियम।
44. ट्रांसयूरेनिक तत्त्व क्या होते हैं ?
उत्तर – जिस तत्त्व को प्रयोगशाला में संश्लेषित किये जाते हैं उसे ट्रांसयूरेनिक तत्त्व कहलाते हैं।
45. लैंथेनाइड्स तथा ऐक्टिनाइड्स को किस वर्ग में रखा गया है ?
उत्तर – इन्हें वर्ग 3 का सदस्य माना गया है।
46. उत्कृष्ट या अक्रिय गैसों को आवर्त सारणी में किस वर्ग में रखा गया है।
उत्तर – वर्ग 18 में।
47. आधुनिक आवर्त्त सारणी को लिखें।
उत्तर – तत्त्वों के भौतिक एवं रासायनिक गुण उनके परमाणु क्रमांकों के आवर्त्त फलन होते हैं।
48. हैलोजन्स समूह क्या है ?
उत्तर – वर्ग 17 के तत्त्वों को हैलोजन्स समूह का तत्त्व कहते हैं।
49. s- ब्लॉक के पाँच तत्त्वों के नाम लिखें।
उत्तर – हाइड्रोजन, लिथियम, सोडियम, मैग्नेशियम, पोटैशियम।
50. p-ब्लॉक में किस समूह या वर्ग के तत्त्व को शामिल किया गया है ?
उत्तर – वर्ग 13 से लेकर 18 तक।
51. लैंथेनाइड्स और ऐक्टिनाइड्स किस ब्लॉक के तत्त्व हैं ?
उत्तर – f-ब्लॉक के तत्त्व
52. d-ब्लॉक में कौन-से तत्त्व आते हैं ?
उत्तर – वर्ग 3 से लेकर 12 तक वाले तत्व d-ब्लॉक में आते हैं।
53. आवर्त्त सारणी को कितने ब्लॉक में बाँटा गया है, उनके नाम लिखें।
उत्तर – चार ब्लॉक s, p, d और f.
54. किस वर्ग के तत्त्व क्षार धातुएँ कहलाते हैं ?
उत्तर – वर्ग-1 के तत्त्व ।
55. क्षारीय मृदा धातुएँ किस वर्ग में आती हैं।
उत्तर – वर्ग-2
56. क्या डॉबेराइनर के त्रिक, न्यूलैंड्स के अष्टक के स्तंभ में भी पाए जाते हैं ? तुलना करके पता कीजिए ?
उत्तर – हाँ, डॉबेराइनर के त्रिक, न्यूलैंड्स के अष्टक के स्तंभ में पाए जाते हैं। उदाहरणLi, Na, K डॉबेराइनर के त्रिक हैं जो न्यूलैंड्स के अष्टक के स्तंभ हैं।
57. डॉबेराइनर के वर्गीकरण की क्या सीमाएँ हैं ?
उत्तर – 1. उस समय ज्ञात सभी तत्वों का वर्गीकरण डॉबेराइनर के त्रिक के आधार पर नहीं हो सका।
2. डॉबेराइनर केवल तीन तत्वों के त्रिक को उस समय पहचान सके।
3. यही कारण है कि डॉबेराइनर के त्रिक को मान्यता प्राप्त नहीं हुई।
58. न्यूलैंड्स अष्टक नियम की क्या सीमाएँ थीं ?
उत्तर – 1. यह नियम केवल Ca तक के परमाणु भार वाले तत्वों को वर्गीकृत कर पाता है। इसके बाद आठवाँ तत्व प्रथम तत्व से समानता प्रदर्शित नहीं करता है ।
2. न्यूलैंड्स ने माना कि केवल 56 तत्व ही संभव हैं, अन्य तत्वों का आविष्कार नहीं हो सकता।
3. न्यूलैंड्स के अष्टक में कुछ ऐसे भी तत्व हैं जिनके गुणों में समानता नहीं पाई जाती है।
59. क्षार धातुओं एवं हैलोजन कुल की समानता को ध्यान में रखते हुए हाइड्रोजन को मेन्डेलीफ की आवर्त सारणी में उचित स्थान पर रखिए।
उत्तर – हाइड्रोजन को मेन्डेलीफ आवर्त सारणी के क्षारीय धातुओं के साथ रखा गया है किंतु इसके कुछ गुण हैलोजन से भी मिलते हैं। आवर्त सारणी में हाइड्रोजन का स्थान उचित है क्योंकि इसके गुण क्षारीय धातुओं के समान ज्यादातर हैं। जैसे यह इलेक्ट्रॉन को त्याग कर विद्युत धनात्मकता के गुण को प्रदर्शित करता है।
60. हाइड्रोजन को किस समूह एवं आवर्त में रखना चाहिए ?
उत्तर – प्रथम समूह एवं प्रथम आवर्त ।
61. मेन्डेलीफ की आवर्त सारणी का उपयोग कर निम्नलिखित तत्वों को ऑक्साइड के सूत्र का अनुमान लिखिए।
K, C, Al, Si, Ba
उत्तर – K – K2O, C – Co, Al – Al2O3, Si – SiO2, Ba – BaO.
62. आपके अनुसार उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया ?
उत्तर – अक्रिय या उत्कृष्ट गैसों को अलग समूह में रखा गया क्योंकि –
(क) ये गैसें बहुत ही अक्रियाशील होती हैं एवं इनकी खोज बहुत बाद में हुई।
(ख) इन गैसों को एक नये समूह में बिना आवर्त सारणी को छेड़-छाड़ किए हुए रखा गया।
63. आधुनिक आवर्त सारणी में विभिन्न तत्वों के समस्थानिकों का स्थान कैसे सुनिश्चित किया गया है ?
उत्तर – सभी समस्थानिकों की परमाणु संख्या एक समान होती है। अतः सभी समस्थानिकों को उस तत्व के साथ आधुनिक आवर्त सारणी में एक ही जगह (स्थान) प्राप्त है।
64. क्या 1.5 परमाणु संख्या वाले किसी तत्व को हाइड्रोजन एवं हीलियम के मध्य रखा जा सकता है ?
उत्तर – नहीं। यह संभव नहीं है क्योंकि परमाणु संख्या सदैव पूर्ण संख्या होती है।
65. आपके अनुसार आधुनिक आवर्त सारणी में हाइड्रोजन को कहाँ रखना चाहिए ?
उत्तर – हमारे अनुसार हाइड्रोजन का आवर्त सारणी में उचित स्थान है।
66. आधुनिक आवर्त सारणी के समूह 1 में उपस्थित तत्वों के नाम बताइए।
उत्तर – हाइड्रोजन (H), लिथियम (Li), सोडियम (Na), पोटैशियम (K), रूबिडियम (Rb), सीजियम (Cs) तथा फ्रॉन्सियम (Fr), ये सभी तत्व समूह 1 के हैं।
67. समूह 1 के पहले तीन तत्वों के इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर – 1. H → 1s1 = 1
2. Li → 1s2, 2s1 = 2, 1
3. Na → 1s2, 2s22p6, 3s1 = 2, 8, 1
68. इन तत्वों के इलेक्ट्रॉनिक विन्यास में क्या समानता है ?
उत्तर – इनकी अंतिम कक्षा में एक इलेक्ट्रॉन है।
69. इन तीनों तत्वों में कितने संयोजी इलेक्ट्रॉन हैं ?
उत्तर – एक संयोजी इलेक्ट्रॉन
70. आवर्त सारणी में धातुओं की स्थिति क्या है ?
उत्तर – वे आवर्त सारणी में बायीं और स्थित हैं।
71. क्या इन सभी तत्वों के भी संयोजकता इलेक्ट्रॉनों की संख्या एक समान है ?
उत्तर – नहीं।
72. क्या इनके कोशों की संख्या समान है ?
उत्तर – हाँ।
नोट – एक ही आवर्त के तत्वों में कोशों की संख्या समान होती है किंतु संयोजी इलेक्ट्रॉनों की संख्या असमान होती है।
73. किसी तत्व के इलेक्ट्रॉनिक विन्यास से आप उसकी संयोजकता का परिकलन कैसे करेंगे ?
उत्तर – 1 धातुओं की संयोजकता = संयोजी इलेक्ट्रॉनों की संख्या ( 1, 2, 3)
2. अधातुओं की संयोजकता = 8 संयोजी इलेक्ट्रॉनों की संख्या
74. परमाणु संख्या 12 वाले मैग्नीशियम तथा परमाणु संख्या 16 वाले सल्फर की संयोजकता क्या है ?
उत्तर – Mg – 2, 8, 2 (धातु) संयोजकता = 2
S – 2, 8, 6 (अधातु) संयोजकता = 8 – 6 = 2
75. निष्क्रिय तत्व क्या है ?
उत्तर – निष्क्रिय तत्व वे होते हैं, जो अन्य तत्वों से संयोजित होने के लिए सक्रिय नहीं होते। ऐसे तत्व के संयोजकता शेल अर्थात् सबसे बाहरी शेल में 8 इलेक्ट्रॉन विद्यमान होते हैं।
76. आवर्त सारणी क्या है ?
उत्तर – तत्वों का विधिवत् वर्गीकरण आवर्त सारणी प्रस्तुत करती है। आधुनिक नियम के अनुसार किसी तत्व के गुण उसकी संख्या का फलन है।
77. वर्गों के गुण लिखिए।
उत्तर – 1. परमाणु की संख्या का निश्चित अंतराल 2. इलेक्ट्रॉनों की संरचना 3. संयोजकता 4. परमाणु आकार 5. रासायनिक गुण 6. धात्विक प्रकृति ।
78. वर्ग IA के सदस्यों को क्षारीय धातुएँ क्यों कहते हैं ?
उत्तर – वास्तव में ये पानी के साथ संयोजित होकर धात्विक हाइड्रोक्साइड बनाते हैं। हाइड्रोक्साइडों को क्षार भी कहते हैं। इसलिए IA वर्ग के सभी सदस्यों को क्षारीय धातुएँ कहते हैं।
79. बृहत् आवर्त सारणी का आधार क्या है ?
उत्तर – परमाणु संख्या और इलेक्ट्रॉन का वितरण ।
80. हैलोजन परिवार में कितने संयोजकता इलेक्ट्रॉन होते हैं ?
उत्तर – इसमें सात संयोजकता इलेक्ट्रॉन होते हैं ।
81. निष्क्रिय तत्व आवर्त सारणी के किस वर्ग में हैं ?
उत्तर – सभी निष्क्रिय तत्व आवर्त सारणी के शून्य वर्ग में हैं।
82. दीर्घ आवर्त सारणी के क्या दोष हैं ?
उत्तर – इसमें हाइड्रोजन की स्थिति निश्चित नहीं है तथा परमाणुओं में इलेक्ट्रॉनों का वितरण पदार्थ नहीं दिखाती।
83. धात्विक अभिलक्षण का क्या तात्पर्य है ?
उत्तर – किसी तत्व के धात्विक अभिलक्षण का तात्पर्य उस परमाणु के द्वारा इलेक्ट्रॉन निकालने की प्रवृत्ति है। यह धन आयन उत्पन्न करता है।
84. परमाणु के आकार में कब कमी आती है ?
उत्तर – जब नाभिक में बढ़ा धन आवेश इलेक्ट्रॉनों को नाभिक की ओर आकृष्ट करता है तब परमाणु के आकार में कमी आती है।
85. किस तत्व की आयनन ऊर्जा सबसे कम होती है ?
उत्तर – हीलियम की।
86. किस रासायनिक परिवार की आयनन ऊर्जा का मान सबसे अधिक होता है ?
उत्तर – उत्कृष्ट गैसें (Noble Gases)।
87. निष्क्रिय गैसों में इलेक्ट्रॉन बंधुता शून्य क्यों होती है ?
उत्तर – निष्क्रिय गैसों का विन्यास स्थायी है और ये कोई भी इलेक्ट्रॉन ग्रहण करने में अयोग्य है।
88. वैद्युत् ऋणात्मकता किसे कहते हैं ?
उत्तर – किसी परमाणु के द्वारा इलेक्ट्रॉन आकर्षित करने की प्रवृत्ति उसकी वैद्युत ऋणात्मकता कहलाती है।
89. Li, Be, B, Na को बढ़ती आयनन ऊर्जा के क्रम में व्यवस्थित कीजिए।
उत्तर – Na<Li<B < Be.
90. आवर्त सारणी के IA ग्रुप में तीन तत्व A, B, C की आयनिक त्रिज्याएँ 1.33 Å, 0.95 Å तथा 0.60 Å हैं। इन्हें ग्रुप में बढ़ते परमाणु संख्या के क्रम में व्यवस्थित कीजिए।
उत्तर – C< B<A.
91. प्रथम समूह के तत्व क्षारीय धातुएँ क्यों कहलाती हैं ?
उत्तर – प्रथम समूह के तत्व पानी के साथ क्रिया कर क्षार उत्पन्न करते हैं ।
92. धातुओं के ऑक्साइडों की क्या प्रकृति होती है ?
उत्तर – क्षारीय प्रकृति ।
93. अधातुओं के ऑकी क्या प्रकृति होती है ?
उत्तर – अम्लीय प्रकृति
लघु उत्तरीय प्रश्न
1. तत्वों का वर्गीकरण से आप क्या समझते हैं ?
उत्तर – समान गुण वाले तत्वों को एक वर्ग में सजाने की क्रिया को तत्वों का वर्गीकरण कहा जाता है।
2. डॉबराइनर के विक नियम क्या हैं ?
उत्तर – यदि समान गुण वाले तीन-तीन तत्वों को परमाणु द्रव्यमानों के बढ़ते क्रम में सजाया जाए तो बीच वाले तत्व का परमाणु द्रव्यमान, शेष दो तत्वों के परमाणु द्रव्यमान के औसत के लगभग बराबर होता है।
3. क्या डॉबेराइनर के त्रिक, न्यूलैंड्स के अष्टक के स्तम्भ में भी पाए जाते हैं। तुलना करें।
उत्तर – हाँ, डॉबेराइनर के त्रिक न्यूलैंड्स के अष्टक के स्तम्भ में पाए जाते हैं। जैसे – Li, Na, K डॉबेराइनर के त्रिक हैं जो न्यूलैंड्स के अष्टक के स्तम्भ हैं ।
4. डॉबेराइनर के वर्गीकरण की सीमाएँ निम्नलिखित हैं
उत्तर – (i) उस समय ज्ञात सभी तत्वों का वर्गीकरण डॉबेराइनर के त्रिक आधार पर नहीं हो सका।
(ii) यह त्रिक नियम कुछ ही तत्वों तक सीमित रहा।
(iii) उस समय तक ज्ञात तत्वों में केवल तीन त्रिक ही ज्ञात हो सका।
5. न्यूलैंड्स के अष्टक सिद्धान्त की क्या सीमाएँ हैं ?
उत्तर – न्यूलैंड्स के अष्टक सिद्धान्त की निम्नलिखित सीमाएँ हैं –
- यह सिद्धान्त केवल हल्के तत्व कैल्सियम (Ca) तक ही लागू होता है |
- अक्रिय गैस के निर्माण के बाद आठवें तत्व का गुणधर्म पहले तत्व के समान न होकर नौवें तत्व का गुणधर्म पहले तत्व के समान होने लगा।
- दो – दो तत्वों को एक साथ रखा गया है। जैसे—CO और Ni, Ce और La
- असमान तत्वों को एक साथ रखा गया एवं समान तत्वों को अलग-अलग रखा गया है। जैसे— Co तथा Ni को F, Cl तथा H के साथ रखा गया और Fe को Co तथा Ni से दूर रखा गया है।
6. न्यूलैंड के अष्टक नियम का उल्लेख करें।
उत्तर – यदि विभिन्न तत्वों को उनके परमाणु द्रव्यमानों के बढ़ते क्रम में व्यवस्थित किया जाए तो प्रत्येक आठवें तत्व के गुणधर्म, उस श्रृंखला के पहले तत्व के गुणधर्म के समान होते है।
7. मेंडलीफ का आवर्त्त नियम क्या ?
उत्तर – मेंडलीफ के आवर्त्त नियम के अनुसार-तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु भार के आवर्त्त फलन होते हैं। अर्थात, यदि तत्वों को उनके बढ़ते हुए परमाणु भार के क्रम में सजाया जाए तो एक निश्चित अंतराल के बाद समान गुणवाले तत्व पाए जाएँगे।
8. मेन्डलीफ की आवर्त सारणी का उपयोग कर निम्नांकित तत्वों को ऑक्साइड के सूत्र का अनुमान लिखें –
K, C, Al, Si, Ba
उत्तर – K – K2O, C – CO2, Al – Al2O3, Si – SiO2, Ba – BaO.
9. गैलियम के अतिरिक्त अब तक कौन-कौन से तत्वों का पता चला है जिसके लिए मेन्डलीफ ने अपनी आवर्त सारणी में खाली जगह छोड़ दी थी। दो उदाहरण दें।
उत्तर – (a) स्कैंडियम, (b) जरमेनियम।
10. आपके अनुसार उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया ?
उत्तर – अक्रिय या उत्कृष्ट गैसों को अलग समूह में रखा गया क्योंकि
(a) ये गैसें बहुत ही अक्रियाशील होती हैं एवं इनकी खोज बहुत बाद में हुई।
(b) इन गैसों को एक नये समूह में बिना आवर्त सारणी को छेड़-छाड़ किए हुए रखा गया।
11. आधुनिक आवर्त्त नियम क्या है ?
उत्तर – आवर्त्त नियम – मोसले के अनुसार– “तत्वों के भौतिक एवं रासायनिक गुण, उनके परमाणु क्रमांक के आवर्त्त फलन होते हैं ।।
इस नियम के अनुसार तत्वों को उनके बढ़ते परमाणु क्रमांक के क्रम में सजाने पर एक निश्चित अंतराल के बाद समान गुणवाले तत्व उपस्थित होते हैं।
12. समूह तथा आवर्त्त को परिभाषित करें।
उत्तर – समूह (Group) — तत्वों की आवर्त्त सारणी की ऊर्ध्वाधर कतारों को समूह कहते हैं। इनकी संख्या 18 है।
आवर्त (Period) – तत्वों की आवर्त्त सारणी की क्षैतिज कतारों को आवत कहते हैं। इनकी संख्या 7 है।
13. परमाण्वीय त्रिज्या की परिभाषा लिखें।
उत्तर – किसी विलगित परमाणु के नाभिक के केन्द्र से उनके बाह्यतम कोश के बीच की दूरी को परमाण्वीय त्रिज्या कहते हैं । है
14. एक तत्व के परमाणु के इलेक्ट्रॉनिक विन्यास 2, 8, 7 है –
(i) इस तत्व की परमाणु क्या है ?
(ii) N (7), F (9), P (15), Ar (18) इन तत्वों में से कौन-सा तत्व इसके समान गुणधर्म प्रदर्शित करेगा ? (कोष्ठकों में परमाणु संख्या दी गई है)
उत्तर – (i) इस तत्व को परमाणु संख्या = 17
(ii) दिए गए चार तत्वों में से F (9) ऐसा तत्व है, जो इलेक्ट्रॉनिक विन्यास 2, 8, 7 वाले तत्व के समान गुणधर्म प्रदर्शित करेगा क्योंकि F(9) का इलेक्ट्रॉनिक विन्यास 2, 7 होगा। इनकी संयोजकता 1 (8-7) है।
15. आधुनिक आवर्त सारणी द्वारा किस प्रकार से मेन्डेलीफ आवर्त सारणी की विविध विसंगतियों को दूर किया गया ?
उत्तर – (i) हाइड्रोजन विद्युत धनात्मक तत्त्व है और इसका गुणधर्म क्षार धातुओं (समूह I) के गुणधर्म से अधिक मिलता है। अतः आधुनिक आवर्त सारणी में हाइड्रोजन को प्रथम आवर्त एवं प्रथम समूह में रखा गया।
(ii) तत्त्वों को परमाणु-संख्या के बढ़ते हुए क्रम से सजाया गया जिससे तत्त्व के समस्थानिकों को तत्त्व के साथ उसी स्थान पर आवर्त सारणी में रखा गया, क्योंकि एक तत्व के सभी समस्थानिकों की परमाणु- संख्या समान होती है।
(iii) तत्त्वों को परमाणु-संख्या के बढ़ते हुए क्रम में सजाने पर अधिक परमाणु द्रव्यमान वाले तत्त्व जो कम परमाणु द्रव्यमान वाले तत्त्व के पहले आ गये थे, उसमें स्वतः संशोधन हो गया।
(iv) अक्रिय (उत्कृष्ट) गैसों को 18वें समूह में अलग रखा गया।
(v) मेंडलीव आवर्त सारणी में समूह VIII में तीन-तीन तत्वों को जो एक साथ रखा गया था, वह आधुनिक आवर्त सारणी में परमाणु संख्या के आधार पर स्वतः अलग-अलग समूह में चले गये।
16. मैग्नीशियम की तरह रासायनिक अभिक्रियाशीलता दिखाने वाले दो तत्वों के नाम लिखें।
उत्तर – कैल्सियम (Ca) एवं बेरियम (Ba)
क्योंकि — (a) ये दोनों तत्व मैग्नीशियम समूह के हैं। (b) इन दोनों तत्वों के मैग्नीशियम की तरह 2 संयोजी इलेक्ट्रॉन हैं।
17. आवर्त सारणी में इनके स्थान के आधार पर इनमें से किस तत्व में सबसे अधिक धात्विक अभिलक्षण की विशेषता है- Ga, Ge, As, Sc, Be.
उत्तर – Be में अधिकतम धात्विक लक्षण हैं क्योंकि शेष अन्य तत्व आवर्त सारणी में दाईं ओर रखे गए हैं। बाईं तरफ वाले तत्व धातु एवं दाईं तरफ वाले तत्व अधातु होते हैं।
18. निम्न के नाम बताएँ
(a) तीन तत्वों जिनके बाहरी कोश में एक इलेक्ट्रॉन हो ।
(b) दो तत्व जिनके सबसे बाहरी कोश में दो इलेक्ट्रॉन उपस्थित हों।
(c) तीन तत्व जिनका बाहरी कोश पूर्ण हो ।
उत्तर – (a) Li, Na, K (लिथियम, सोडियम, पोटैशियम)
(b) Mg, Ca (मैग्नीशियम, कैल्सियम )
(c) He, Ne, Ar ( हीलियम, नियॉन, आर्गन) ।
19. (a) लिथियम, सोडियम, पोटैशियम ये सभी धातुएँ जल से अभिक्रिया कर हाइड्रोजन गैस मुक्त करती है क्या इन तत्वों के परमाणुओं में कोई समानता है ?
(b) हीलियम एक अक्रियाशील गैस है जबकि निऑन की अभिक्रियाशीलता अत्यन्त कम है। इनके परमाणुओं में कोई समानता है ?
उत्तर – (a) हाँ, क्योंकि तीनों तत्व जल के साथ समान अभिक्रिया करते हैं। अतः तीनों एक ही समूह के तत्व हैं। इसलिए तीनों के बाहरी कक्षा में समान इलेक्ट्रॉन होंगे।
(b) हीलियम (He) एवं निऑन (Ne) दोनों अभिक्रियाशील गैसें हैं अर्थात् दोनों समूह 18 के तत्व हैं। इसलिए दोनों के बाहरी कक्षा पूर्णतः इलेक्ट्रॉन से भरे हैं।
20. आधुनिक आवर्त सारणी के पहले दस तत्त्वों में कौन-से धातु हैं ?
उत्तर – आधुनिक आवर्त सारणी में पहले 10 तत्वों में लीथियम (Li) एवं बेरिलियम (Be) दो धातुएँ हैं, बोरॉन (B) उपधातु है और शेष सात हाइड्रोजन (H), हीलियम (He), कार्बन (C), नाइट्रोजन (N), ऑक्सीजन (O), फ्लोरीन (F) एवं निऑन (Ne) अधातुएँ हैं।
21. किस तत्व में-
(a) दो कोश हैं तथा दोनों इलेक्ट्रॉनों से पूर्ण हैं |
(b) इलेक्ट्रॉनिक विन्यास 2, 8, 2 है।
(c) कुल तीन कोश हैं तथा संयोजकता कोश में चार इलेक्ट्रॉन हैं।
(d) कुल दो कोश हैं तथा संयोजकता कोश में तीन इलेक्ट्रॉन हैं।
(e) दूसरे कोश में पहले कोश से दोगुने इलेक्ट्रॉन हैं ।
उत्तर – (a) नियॉन (Ne) (2, 8)
(b) मैग्नीशियम (Mg ) (2, 8, 2)
(c) सिलिकॉन (Si) (2, 8, 4)
(d) बोरॉन (B) (2, 3)
(e) कार्बन (C) (2, 4)
22. आवर्त सारणी में तीन तत्व A, B तथा C की स्थिति निम्न प्रकार है –
समूह 16 समूह 17
……………… ………………
……………… A
……………… ………………
B C
अब बताएँ कि –
(a) धातु है या अधातु ।
(b) A की अपेक्षा C अधिक अभिक्रियाशील है या कम।
(c) C का साइज B से बड़ा होगा या छोटा ?
(d) तत्व A, किस प्रकार आयन, धनायन या ऋणायन बनाएगा ?
उत्तर – (a) अधातु, (b) कम, (c) छोटा, (d) ऋणायन
23. (a) आवर्त सारणी में बोरॉन के स्तम्भ के सभी तत्वों के कौन-से गुणधर्म समान हैं ?
(b) आवर्त सारणी में फलुओरीन के स्तंभ के सभी तत्वों के कौन-से गुण धर्म समान हैं ?
उत्तर – (a) सभी तत्व धातुएँ हैं और उनके गुणधर्म हैं
(i) सभी विद्युत के सुचालक होते हैं।
(ii) ये आघातवर्ध्य होते हैं।
(b)ये सभी अधातुएँ हैं और उनके गुणधर्म हैं
(i) सभी विद्युत के अचालक होते हैं।
(ii) ये सभी भंगूर होते हैं।
24. तत्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्व की स्थिति से क्या संबंध है ?
उत्तर – आधुनिक आवर्त सारणी तत्वों की परमाणु संख्या पर आधारित है। परमाणु-संख्या, तत्व के परमाणु में उपस्थित प्रोटॉनों की संख्या के बराबर होती है। प्रोटॉनों की संख्या, इलेक्ट्रॉनों की संख्या के बराबर होती है। तत्वों के वर्गीकरण में परमाणु संख्या का महत्व तत्वों का उनके इलेक्ट्रॉनिक विन्यास के अनुसार रखने में सहायता करता है। अतः तत्वों के वर्गीकरण का वर्तमान आधार उनका इलेक्ट्रॉनिक विन्यास है। इलेक्ट्रॉनिक विन्यास में कोश की संख्या आवर्त को दर्शाता है और बाहरी कोश के इलेक्ट्रॉन समूह की संख्या को दर्शाता है। इस प्रकार तत्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्व की स्थिति से संबंधित है।
25. आवर्त सारणी का आधुनिक रूप क्या है ? कुछ ऐसे तथ्यों को बताएँ जो वर्गीकरण के इस रूप से उचित सम्बन्ध रखते हैं ?
उत्तर – आवर्त सारणी का आधुनिक रूप बोर (Bohr) ने ज्ञात तत्वों को परमाणु क्रमांकों के बढ़ते क्रम में रखकर एक सारणी बनाई जिसे आवर्त सारणी का दीर्घ रूप या आधुनिक रूप कहते हैं।
इस वर्गीकरण से उचित सम्बन्ध रखने वाले तथ्य निम्नलिखित हैं
(i) इस सारणी का आधुनिक रूप परमाणु क्रमांकों पर आधारित है जो परमाणु का मौलिक गुण है।
(ii) इस सारणी में तत्वों का वर्गीकरण उनके इलेक्ट्रॉनिक विन्यास पर आधारित है। समान गुण वाले तत्वों को आवर्त सारणी के एक ही वर्ग में रखा गया है क्योंकि उनके बाह्यतम ऊर्जा स्तर में इलेक्ट्रॉनों की संख्या समान है।
26. स्पष्ट करें कि परमाणु द्रव्यमान की अपेक्षा परमाणु क्रमांक अधिक महत्वपूर्ण है।
उत्तर – मेण्डलीफ ने तत्वों के वर्गीकरण का आधार परमाणु भार माना था जिसके कारण उनकी आवर्त सारणी में अनेक त्रुटियाँ रह गई थीं। परमाणु क्रमांक के आविष्कार के बाद तत्वों के वर्गीकरण का आधार परमाणु क्रमांक को ही माना गया और इसके आधार पर एक आवर्त नियम का प्रतिपादन किया गया तथा देखा गया कि यदि तत्वों को उनके बढ़ते हुए परमाणु क्रमांक (संख्या) के अनुसार सजाया जाए तो एक निश्चित अन्तराल के बाद समान गुण वाले तत्व आ जाते हैं।
अतः परमाणु द्रव्यमान की अपेक्षा परमाणु क्रमांक अधिक महत्वपूर्ण है।
27. मेण्डलीफ की आवर्त सारणी की किन्हीं दो विशेषताओं का उल्लेख करें।
उत्तर – (i) मेण्डलीफ की आवर्त सारणी से तत्वों के अध्ययन में सुविधा होती है, क्योंकि किसी उपवर्ग के एक तत्व के गुणों के बारे में जानकारी रहने पर उस उपवर्ग के अन्य तत्वों के गुणों के बारे में जानकारी हो जाती है। प्रत्येक तत्व के गुणों का अध्ययन अलग-अलग नहीं करना पड़ता है।
(ii) मेण्डलीफ की आवर्त सारणी के आधार पर तत्वों के संदेहपूर्ण परमाणु भारों को संशोधन किया गया है।
28. मेण्डलीफ की आवर्त सारणी की दो विसंगतियों को लिखें।
उत्तर – मेण्डलीफ की आवर्त सारणी की दो विसंगतियाँ निम्नलिखित हैं –
(i) आवर्त सारणी में हाइड्रोजन का स्थान विवादपूर्ण है के साथ वर्ग IA में तथा हैलोजन तत्वों के साथ वर्ग क्योंकि हाइड्रोजन को क्षार धातुओं के साथ IA में तथा हैलोजन तत्वों के साथ वर्ग VIIB में भी रखा गया है।
(ii) समस्थानिकों के लिए कोई स्थान सुरक्षित नहीं है।
29. संक्रमण धातु किसे कहते हैं तथा इनका क्या गुण है ?
उत्तर – वैसे तत्व जिनका d-उपकक्ष अधूरा भरा हो, संक्रमण तत्व कहलाते हैं। इनके मुख्य गुण इस प्रकार हैं
(i) ये सभी परिवर्तनशील संयोजकता दर्शाते हैं।
(ii) ये सभी रंगीन लवण बनाते हैं।
(iii) ये सभी जटिल यौगिक का निर्माण करते हैं।
30. आवर्त सारणी के आवर्त तथा वर्ग में तत्वों के धात्विक गुण किस प्रकार परिवर्तित हैं ?
उत्तर – आवर्त सारणी के आवर्त में बायें से दायें जाने पर तत्वों का धात्विक गुण घटता जाता है। आवर्त सारणी के वर्ग में ऊपर से नीचे जाने पर तत्वों का धात्विक गुण बढ़ता जाता है।
31. किसी वर्ग के सभी सदस्य तत्वों के रासायनिक गुण समान क्यों होते हैं ?
उत्तर – हम जानते हैं कि किसी वर्ग के सभी सदस्यों के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या अर्थात् संयोजकता इलेक्ट्रॉनों की संख्या समान होती है। चूँकि तत्वों के रासायनिक गुण संयोजकता इलेक्ट्रॉनों पर निर्भर करते हैं। इसी कारण वर्ग के सभी तत्वों के रासायनिक गुण समान होते हैं।
32. तत्वों के उन दो गुणों के नाम लिखिए जिनका परिमाण आवर्त सारणी से किसी वर्ग में ऊपर से नीचे की ओर बढ़ता है।
उत्तर – (i) परमाणु का आकार आवर्त सारणी के किसी वर्ग में ऊपर से नीचे की ओर जाने पर परमाणु का आकार बढ़ता जाता है।
(ii) धात्विक गुण – किसी वर्ग में ऊपर से नीचे की ओर जाने पर धात्विक गुण बढ़ता जाता है।
33. एक परमाणु का इलेक्ट्रॉनिक विन्यास 2.8, 7 है
(a) इस तत्व की परमाणु संख्या कम है ?
(b) निम्न में किस तत्व के साथ इसकी रासायनिक समानता होगी ? (परमाणु संख्या कोष्ठक में दी गई है।)
N (7)
F (9)
P (15)
Ar (18)
उत्तर – (a) परमाणु संख्या = 17
(b) F (9) के साथ इसकी रासायनिक समानता होगी।
34. नाइट्रोजन (परमाणु संख्या 7) तथा फॉस्फोरस (परमाणु संख्या 15) आवर्त सारणी के समूह 15 के तत्व हैं । इन दोनों तत्वों का इलेक्ट्रॉनिक विन्यास लिखिए। इनमें से कौन-सा तत्व अधिक ऋण विद्युत होगा एवं क्यों ?
उत्तर – नाइट्रोजन अधिक विद्युत ऋणात्मक तत्व होगा, क्योंकि फॉस्फोरस एवं नाइट्रोजन दोनों अधातुएँ हैं। फॉस्फोरस समूह में नाइट्रोजन से नीचे आता है। अतः नाइट्रोजन की विद्युत ऋणात्मकता फॉस्फोरस से ज्यादा होगी। समूह में ऊपर से नीचे आने पर तत्व की विद्युत ऋणात्मकता घटती है। इनके इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं –
नाइट्रोजन – 2,5
फॉस्फोरस– 2, 8, 5
35. आधुनिक आवर्त सारणी में कैल्सियम ( परमाणु संख्या 20) के चारों ओर 12, 19, 21 तथा 38 परमाणु वाले तत्व स्थित हैं। इनमें से किन तत्वों के भौतिक एवं रासायनिक गुणधर्म कैल्सियम के समान हैं ?
उत्तर – परमाणु संख्या 12 वाले तत्व का भौतिक एवं रासायनिक गुणधर्म एक समान हैं क्योंकि Ca(2) एवं परमाणु संख्या 12 एवं 18 वाले तत्वों के अंतिम कोश में केवल 2 इलेक्ट्रॉन हैं। किन्तु अन्य परमाणु संख्याओं की स्थिति में ऐसा नहीं है
परमाणु संख्या इलेक्ट्रॉनिक विन्यास
Ca (20) — 2, 8, 8, 2
12 — 2, 8, 2
19 — 2, 8, 8, 1
21 — 2, 8, 9, 2 (संक्रमण धातु)
18 — 2, 8, 18, 8, 2
36. आधुनिक आवर्त सारणी एवं मेन्डेलीफ की आवर्त सारणी में तत्वों की व्यवस्था की तुलना कीजिए |
उत्तर – 1. मेन्डेलीफ की आवर्त सारणी तत्वों के परमाणु द्रव्यमान पर आधारित हैं एवं आधुनिक आवर्त सारणी परमाणु संख्या पर आधारित है।
2. मेन्डेलीफ की आवर्त सारणी में अक्रिय गैसों का कोई स्थान नहीं था किंतु आधुनिक आवर्त सारणी में अक्रिय गैसों को 18वें समूह में रखा गया है।
3. आधुनिक आवर्त सारणी में मेन्डेलीफ की आवर्त सारणी के सारे दोषों को हटा दिया गया है।
4. मेन्डेलीफ की आवर्त सारणी में 8 समूह हैं जबकि आधुनिक आवर्त सारणी में 18 समूह हैं।
37. किस कारण से वैज्ञानिकों को तत्वों के वर्गीकरण की आवश्यकता हुई ?
उत्तर – उन्नीसवीं शताब्दी के प्रारंभ में कुछ ऐसे तत्वों की जानकारी हुई जिनके गुण आपस में समान थे। जैसे—F, Cl, Br, I इत्यादि । इस कारण वैज्ञानिकों ने तत्वों को उनके गुणों के आधार पर उनके वर्गीकरण की आवश्यकता समझी।
38. तत्वों के गुणों में किस प्रकार की समानता न्यूलैंड्स ने पाई थी ?
उत्तर – तत्वों के गुणों का अध्ययन करते समय न्यूलैंड्स ने पाया कि जिस प्रकार संगीत में 8वाँ सुर प्रथम सुर के समान होता है। ठीक उसी प्रकार यदि तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमान के क्रम में सजाएँ तो आठवें तत्व के गुण प्रथम तत्व के गुण के समान होते हैं।
39. मेन्डेलीफ की आवर्त सारणी बाद में कैसे परिवर्तित हो गई ?
उत्तर – मेन्डेलीफ की आवर्त सारणी में त्रुटियों के कारण यह माना गया कि तत्वों का वर्गीकरण परमाणु द्रव्यमान के आधार पर यथोचित नहीं था। मोसले के कार्यों के बाद यह साबित हुआ कि तत्वों के गुण परमाणु संख्या के आवर्त फलन होते हैं अर्थात् परमाणु संख्या परमाणु द्रव्यमान से अत्यधिक उपयुक्त मौलिक गुण है। अतः बाद में मेन्डेलीफ की आवर्त सारणी को बदलना पड़ा।
40. आवर्त सारणी के विशिष्ट लक्षणों को लिखिए।
उत्तर – आवर्त सारणी के विशिष्ट गुण इस प्रकार हैं
(क) पहले की तुलना में तत्वों को विशेष प्रकार से समूहों एवं आवत में रखा गया।
(ख) इस प्रकार के वर्गीकरण से बहुत सारे तत्वों के गुण का अनुमान लगाया गया।
(ग) बहुत-से तत्वों के परमाणु द्रव्यमानों में संशोधन किया गया। (जैसे— Pt, Au)
(घ) नये तत्वों की खोज की संभावना बढ़ी एवं नए तत्वों की खोज भी हुई।
41. तत्वों के गुणों में आवर्तता का क्या कारण है ?
उत्तर – तत्वों की परमाणु संख्या बढ़ने से एक निश्चित अन्तराल के बाद बाह्यतम कक्षा में इलेक्ट्रॉन की समान संख्या वाले तत्वों की पुनरावृत्ति होती है। चूँकि तत्वों के गुण अंतिम कक्षा में उपस्थित इलेक्ट्रॉन की संख्या पर निर्भर करते हैं। अतः तत्वों के गुणों में पुनरावृत्ति होती है।
उदाहरण- प्रथम समूह के तत्वों के लिए
Li – 2,1
Na – 2, 8, 1
K – 2, 8, 8, 1
यहाँ सभी तत्वों की अंतिम कक्षा में 1 इलेक्ट्रॉन है। अतः इनके गुणों में समानता पाई जाती है।
42. “आधुनिक आवर्त सारणी तत्वों के परमाणु संरचना के आधार पर आधारित हैं।” इस कथन की पुष्टि करें।
उत्तर – आधुनिक आवर्त सारणी तत्वों के परमाणु संख्या पर आधारित है। परमाणु संख्या बढ़ने से समान तरह की परमाणु संरचना की पुनरावृत्ति होती है। अर्थात् अंतिम कक्षा में समान इलेक्ट्रॉन वाले तत्व प्राप्त होते हैं। अतः हम कह सकते हैं कि आधुनिक आवर्त सारणी परमाणु संरचना पर आधारित है।
43. आधुनिक आवर्त सारणी में कितने आवर्त हैं ? विभिन्न आवतों में तत्वों की संख्या किस प्रकार से न्यायसंगत है ?
उत्तर – आधुनिक आवर्त सारणी में 7 आवर्त हैं। इन आवर्ती में क्रमश: 2, 8, 18, 18, 32 तत्व हैं एवं 7वाँ आवर्त अधूरा है।
किसी आवर्त में तत्वों की संख्या संगत कक्षा संख्या में अधिक इलेक्ट्रॉनों की अधिकतम संख्या के बराबर होती है। उदाहरण-
प्रथम कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या = 2
तत्वों की संख्या = 2
दूसरी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या = 8
तत्वों की संख्या = 8
इसी प्रकार तीसरी कक्षा में 8 इलेक्ट्रॉन हो सकते हैं यद्यपि इसमें इलेक्ट्रॉन को रखने की क्षमता 8 से ज्यादा है।
44. मेंडलीव की आवर्त सारणी तथा आधुनिक आवर्त सारणी में दो अंतर लिखें।
उत्तर –

45. एक तत्व A का इलेक्ट्रॉनिक विन्यास 2 2, 8, 8, 2 है –
(क) तत्व A की वर्ग संख्या क्या है ?
(ख) तत्व A की आवर्त संख्या क्या है ?
उत्तर – (क) वर्ग संख्या = 2
(ख) आवर्त संख्या = 4
46. नीचे A, B और C तीन तत्वों की परमाणु त्रिज्याओं के मान दिए गए हैं। प्रत्येक .तत्व के बाह्यतम शेल में n इलेक्ट्रॉन हैं।
तत्व A B C
परमाणु त्रिज्या(pm) 155 190 235
अब, निम्नलिखित के उत्तर दें—(1) इन तत्वों की संयोजकताएँ समान होंगी या भिन्न-भिन्न ? (ii) किस तत्व की परमाणु संख्या सबसे अधिक होगी ?
उत्तर – (i) सभी तत्वों के परमाणु के बाह्यतम शेल (संयोजी शेल) में इलेक्ट्रॉनों की संख्या समान है। अतः ये सभी तत्व आवर्त सारणी के एक ही वर्ग में रहेंगे और इनकी संयोजकताएँ भी समान होंगी।
(ii) किसी वर्ग में ऊपर से नीचे आने पर तत्व की परमाणु त्रिज्या का मान बढ़ता है। प्रश्न में दिए आँकड़े के अनुसार ऊपर से नीचे की ओर तत्वों का क्रम होगा A, B और C हमलोग जानते हैं कि किसी वर्ग में ऊपर से नीचे आने पर परमाणु संख्या सबसे अधिक होगी।
47. कैल्सियम और क्लोरीन के बीच अभिक्रिया होने पर एक यौगिक बनता है जिसका सूत्र CaCl2 है। मैग्नीशियम और क्लोरीन के संयोग से बने यौगिक का सूत्र बताए –
उत्तर – आवर्त सारणी में मैग्नीशियम और कैल्सियम एक ही वर्ग 2 में हैं। अतः यौगिक का सूत्र MgCl2 होगा।
48. बताएँ कि निम्नलिखित तत्वों में कौन-कौन सामान्य तत्व और कौन-कौन संक्रमण तत्व हैं।
Na, Cu, S, Se, Fe, Cr, Sb, Co
उत्तर – सामान्य तत्व : Na, S, Se, Sb
संक्रमण तत्व : Cu, Fe, Cr, Co
49. आवर्त सारणी में तत्व के स्थान को जानकर उसके परमाणु-रचना का निर्धारण किस प्रकार किया जाता है ?
उत्तर – आधुनिक आवर्त सारणी में तत्व को परमाणु संख्या के बढ़ते क्रम में सजाए गए हैं। अतः किसी तत्व की परमाणु संख्या आवर्त सारणी में उसके स्थान की संख्या से ज्ञात हो जाती है। अब हम जानते हैं कि किसी तत्व के परमाणु के नाभिक में स्थित प्रोटॉनों की संख्या एवं कक्षाओं में घूमनेवाले इलेक्ट्रॉनों की संख्या अलग-अलग उस तत्व की परमाणु संख्या के बराबर होती है। इस प्रकार किसी तत्व के परमाणु में विद्यमान प्रोटॉनों एवं इलेक्ट्रॉनों की संख्या ज्ञात कर उस तत्व की परमाणु-रचना को ज्ञात कर सकते हैं।
50. इसी प्रकार पहले 20 तत्वों की संयोजकता ज्ञात कीजिए।
| तत्व | संयोजी इलेक्ट्रॉन | संयोजकता |
|
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
|
1
2
1
2
3
4
5
6
7
8
9
2
3
4
5
6
7
8
1
2
|
1
2
1
2
3
4
8 – 5 = 3
8 – 6 = 2
8 – 7 = 1
8 – 8 = 0
1
2
3
4
8 – 5 = 3
8 – 6 = 2
8 – 7 = 1
8 – 8 = 0
1
2
|
51. आधुनिक आवर्त नियम क्या है ?
उत्तर – परमाणु संरचना के अध्ययन के क्रम में मोसले (1911) ने तत्वों के एक नए गुण, परमाणु संख्या का पता लगाया। किसी तत्व के लिए परमाणु संख्या मान स्थिर होता है तथा किसी भी दो तत्वों की परमाणु संख्या समान नहीं होती। इसलिए कहा जाता है कि परमाणु संख्या ही किसी तत्व का मौलिक गुण है न कि परमाणु भार । अतः बाद में परमाणु संख्या को आधार मानकर तत्वों का वर्गीकरण हुआ, आधुनिक आवर्त नियम इसी परमाणु संख्या पर आधारित है। इस नियम के अनुसार, तत्वों के भौतिक एवं रासायनिक गुण उनकी परमाणु संख्या के आवर्त फलन होते हैं। आधुनिक आवर्त सारणी में तत्वों को इसी नियम के अनुसार उनकी परमाणु संख्या के बढ़ते क्रम में सजाया गया है।
52. आधुनिक आवर्त सारणी में कितने वर्ग एवं आवर्त हैं ?
उत्तर – आधुनिक आवर्त सारणी में कुल 9 वर्ग हैं—I, II, III, IV, V, VI, VII, VIII एवं शून्य (0) तथा कुल 7 आवर्त हैं— 1, 2, 3, 4, 5, 6 एवं 7 वर्ग VIII एवं शून्य को छोड़कर शेष सभी वर्ग दो उपवर्ग (A एवं B) में विभाजित है। इस तरह आधुनिक आवर्त सारणी में कुल 16 वर्ग एवं 7 आवर्त हैं।
53. आवर्त सारणी का दीर्घ रूप क्या है ?
उत्तर – आधुनिक आवर्त सारणी ही आवर्त सारणी का दीर्घ रूप है। इसमें तत्वों को परमाणु संख्या के ही बढ़ते क्रम में सजाया गया है जिसके कारण उपवर्ग A एवं B अलग-अलग हो गए हैं। वर्ग VIII भी तीन वर्गों में बँट गया है। इस प्रकार आवर्त सारणी के दीर्घ रूप में कुल 18 वर्ग एवं 7 आवर्त हो जाते हैं। इसमें वर्गों को 1, 2, 3, 4…18 द्वारा व्यक्त किया गया है।
54. धातुओं में इलेक्ट्रॉन त्याग कर धन आयन बनाने की प्रवृत्ति होती हैं, क्यों ?
उत्तर – धातुओं में इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति होती है अर्थात वे विद्युत धनात्मक होती है।
इसका कारण है कि धातु परमाणुओं के बाह्यतम शेल में 1.2 या 3 इलेक्ट्रॉन होते हैं। ये अपने बाह्यतम शेल के इलेक्ट्रॉन को त्यागकर अपने-अपने निकटतम अक्रिय गैस की स्थायी रचना प्राप्त करना चाहते हैं। इलेक्ट्रॉन त्यागने के फलस्वरूप इनके परमाणु में प्रोटॉनों की संख्या इलेक्ट्रॉनों की संख्या से अधिक हो जाती है । फलतः धातुएँ इलेक्ट्रॉन त्याग कर धन आयन प्रदान करती हैं।
उदाहरणार्थ –सोडियम परमाणु में 11 प्रोटॉन और II इलेक्ट्रॉन है। इसका इलेक्ट्रॉनिक विन्यास K–2, L−8, M−1 है। यह अपने बाह्यतम शेल के इलेक्ट्रॉन को त्यागकर निऑन का स्थायी इलेक्ट्रॉनिक की संख्या 10 हो जाती है जिसके कारण यह सोडियम धनायन Na+ प्रदान करता है।
दीर्घ उत्तरीय प्रश्न
1. एक वर्ग में सत्व निश्चित अंतराल में अलग-अलग किए गए हैं। इनकी परमाणु संख्या 8, 18, 18, 32 है। इन अंतरालों को क्या कहते हैं ? तत्वों के गुणों पर इन निश्चित अंतरालों का क्या प्रभाव पड़ता है ?
उत्तर – परमाणु संख्या 8, 18, 18, 32 के अंतरालों को जादुई संख्याएँ कहते हैं। लोग सोचते हैं कि परमाणु संख्याओं का यह अंतराल एक प्रकार का जादू पैदा करता है। परिणामस्वरूप एक वर्ग के तत्व एक समान गुण प्रदर्शित करते हैं, परंतु वास्तव में ऐसा कोई जादू नहीं होता। एक ही वर्ग में व्यवस्थित तत्वों के जो एक निश्चित अंतराल अलग होते हैं, संयोजकता इलेक्ट्रॉनों की संख्या समान होती है। उदाहरणस्वरूप, क्षारीय मृदा धातुओं के परिवार (वर्ग II A) पर विचार करें।

2. मेंडलीव के आवर्त्त सारणी के दोषों की विवेचना करें।
उत्तर – मेंडलीव की आवर्त सारणी में निम्नलिखित दोष हैं –
1. हाइड्रोजन का स्थान– आवर्त सारणी में हाइड्रोजन का स्थान अनिर्णित है। हाइड्रोजन के कुछ गुण क्षार धातुओं के सदृश होने के कारण इसे वर्ग IA में क्षार धातुओं (Li, Na, K आदि) के साथ रखा गया है। किन्तु इसके कुछ गुण हैलोजन तत्वों से भी समानता रखते हैं, अतः इसे वर्ग VIIA में हैलोजन तत्वों (F, Cl, Br आदि) के साथ भी रखा जा सकता है।
क्षार धातुओं एवं हाइड्रोजन के गुणों में समानता-

हैलोजन और हाइड्रोजन के गुणों में समानता-

2. दुष्प्राप्य मृदा तत्वों का स्थान-दुष्प्राप्य मृदा तत्वों की दो श्रेणियाँ हैं जो लैंथेनाइड्स (Lanthanides) और ऐक्टिनाइड्स (actinides) कहलाती हैं। (परमाणु संख्या 57 से लेकर 71 तकवाले तत्व लैंथेनाइड्स एवं परमाणु संख्या 90 से लेकर 103 तक वाले तत्व ऐक्टिनाइड्स कहलाते हैं।) लैंथेनाइड्स आवर्त सारणी के वर्ग III B के अंतर्गत आवर्त 6 के सदस्य हैं। यदि इन्हें इनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में रखा जाए तो यह असंगत प्रतीत होता है और संपूर्ण आवर्त सारणी की उपयोगिता समाप्त हो जाती है। इसीलिए इन्हें आवर्त सारणी के नीचे एक अलग कतार में रखा गया है।
इसी प्रकार, ऐक्टिनाइड्स को भी, जो आवर्त सारणी के वर्ग III B और आवर्त 7 के सदस्य हैं, आवर्त सारणी के नीचे एक अलग कतार में रखा गया है।
3. तत्त्वों का असंगत युग्म मेंडलीव की आवर्त सारणी में तत्त्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया गया है। किन्तु कुछ तत्त्वों के लिए इस पद्धति का पालन नहीं किया गया है। (i) ऑर्गन (Ar) का परमाणु द्रव्यमान 40 और पोटैशियम (K) का परमाणु द्रव्यमान 39 होता है। किन्तु आवर्त सारणी में आर्गन (वर्ग 0) को पोटैशियम (वर्ग I) के पहले स्थान दिया गया है। (ii) कोबाल्ट (Co) और निकेल (Ni) के स्थान भी उचित क्रम में नहीं है । कोबाल्ट (परमाणु द्रव्यमान = 58.9) को निकेल (परमाणु द्रव्यमान = 58.6) के पहले रखा गया है। (iii) टैल्यूरियम (परमाणु द्रव्यमान = 127.6) को आयोडीन (परमाणु द्रव्यमान = 126.9) के पहले रखा गया है। (iv) थोरियम (परमाणु द्रव्यमान = 232.12) को प्रोटऐक्टिनियम ( परमाणु द्रव्यमान = 231) के पहले स्थान दिया गया है।

4. कुछ समान तत्त्वों को अलग-अलग एवं कुछ असमान तत्त्वों को एक साथ रखा जाना – आवर्त सारणी में समान गुणवाले कुछ तत्त्वों को अलग-अलग रखा गया है। उदाहरण के लिए, कॉपर (Cu) एवं मरकरी (Hg) लगभग समान गुणवाले तत्त्व हैं, लेकिन आवर्त सारणी में ये दोनों अलग-अलग वर्गों में रख दिए गए हैं। सिल्वर (Ag) और थैलियम (Ti) भी समान गुणवाले तत्त्व हैं, किन्तु इन दोनों को आवर्त सारणी में अलग-अलग वर्गों में स्थान दिया गया है। यही स्थिति बेरियम (Ba) और लेड (Pb) के साथ भी है।
इसके विपरीत, असमान गुणवाले कुछ तत्वों को आवर्त सारणी के एक ही वर्ग में स्थान दे दिया गया है।
उदाहरण के लिए, कॉपर (Cu), सिल्वर (Ag) और गोल्ड (Au) । इनके गुण क्षार धातुओं साथ ही वर्ग I में रखा गया है। इसी प्रकार, मैंगनीज (Mn) को भी वर्ग VII के अंतर्गत हैलोजन के साथ रखा गया है।
5. समस्थानिकों का स्थान—आवर्त सारणी में समस्थानिकों (isotopes) के लिए कोई स्थान निश्चित नहीं है।
6.आठवें वर्ग में तीन-तीन तत्त्वों को एक साथ रखा जानां – आठवें वर्ग में तीन-तीन तत्त्वों को एक ही स्थान में रखा गया है; यथा –

इससे सारणी में अनियमितता आ जाती है ।
मेंडलीव की आवर्त सारणी की उपर्युक्त त्रुटियों को ध्यान में रखकर इस क्षेत्र में कार्यरत वैज्ञानिक इस निष्कर्ष पर पहुँचे कि तत्त्वों के वर्गीकरण का आधार परमाणु द्रव्यमान नहीं हो सकता है। तत्त्वों में अवश्य कोई ऐसा गुण है जो तत्त्वों के वर्गीकरण का आधार बन सकता है।
3. आधुनिक आवर्त सारणी की विशेषताओं को विस्तार से लिखें।
उत्तर – आवर्त सारणी की विशेषताएँ- इसकी विशेषताएँ अग्रलिखित हैं-
वर्गों की विशेषताएँ- आवर्त सारणी को देखने से पता चलता है कि
(i) किसी एक वर्ग के तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होने के कारण उनके गुण समान होते हैं।
(ii) किसी वर्ग में ऊपर से नीचे आने पर तत्त्वों के गुणों में क्रमिक परिवर्त्तन होता है। इसका कारण यह है कि परमाणु के नाभिक और उसके बाह्य संयोजी इलेक्ट्रॉनों के बीच आकर्षण क्रमिक रूप से परिवर्तित होता है।
अब हम किसी वर्ग में तत्त्वों के गुणों पर विचार करें।
1. इलेक्ट्रॉनिक विन्यास – किसी वर्ग – विशेष के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं; अर्थात, सभी तत्त्वों के परमाणुओं में संयोजी इलेक्ट्रॉनों की संख्या समान होती हैं। उदाहरण के लिए, वर्ग 1 के सभी तत्त्वों के परमाणु में संयोजी इलेक्ट्रॉन की संख्या 1 होती है। इसी प्रकार, वर्ग 17 के सभी तत्त्वों के परमाणु में संयोजी इलेक्ट्रॉनों की संख्या 7 होती है
वर्ग 1 और 17 के तत्त्वों के इलेक्ट्रॉनिक विन्यास
वर्ग 1 वर्ग 17
लिथियम (Li) 2, 1 फ्लुओरिन 2, 7
सोडियम (Na) 2, 8, 1 क्लोरीन 2, 8, 7
पोटैशियम (K) 2, 8, 8, 1 ब्रोमीन 2, 8, 18, 7
रूबीडियम (RB) 2, 8, 18, 8, 1 आयोडीन 2, 8, 18, 18, 7
इस प्रकार, किसी वर्ग के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं, किन्तु वर्ग में ऊपर से नीचे आने पर शेलों की संख्या बढ़ती जाती है।
2. संयोजकता—किसी वर्ग के सभी तत्वों की संयोजकता समान होती है। किसी तत्त्व की संयोजकता उसके परमाणु के संयोजी शेल में उपस्थित इलेक्ट्रॉनों की संख्या द्वारा निर्धारित होती है। अतः वर्ग 1 और 2 के तत्त्वों की संयोजकताएँ क्रमशः 1 और 2 होती हैं।
किसी तत्त्व के परमाणु का अन्य परमाणुओं के साथ संयोग होने पर उस तत्त्व के परमाणु का अन्य परमाणुओं के साथ संयोग होने पर उस तत्त्व के परमाणु द्वारा व्यक्त या प्राप्त इलेक्ट्रॉन की संख्या द्वारा भी उस तत्त्व की संयोकजता निर्धारित की जाती है। उदाहरण के लिए, वर्ग 17 के तत्त्वों का प्रत्येक परमाणु संयोग करनेवाले अन्य परमाणु से एक इलेक्ट्रॉन प्राप्त कर स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करता है। अतः वर्ग 17 के तत्त्वों की संयोजकता 1 होती है।

3. परमाणु का आकार या त्रिज्या – किसी परमाणु के बाह्यतम शेल और उसके नाभिक के केन्द्र के बीच की दूरी को परमाणु त्रिज्या कहते हैं। किन्तु परमाणु के बाह्यतम शेल का स्थान नियत नहीं है, अतः परमाणु त्रिज्या का ठीक-ठीक मान निर्धारित करना कठिन है। फिर भी, एक ही तत्त्व के किसी सहसंयोजक अणु में दो आसन्न परमाणुओं के केंद्र के बीच की दूरी के औसत को परमाणु का आकार या त्रिज्या कहते हैं। उदाहरण के लिए, क्लोरीन अणु के दोनों बंधित कों के बीच की दूरी 198 pm होती है। अतः क्लोरीन की सहसंयोजक त्रिज्या = 198/2 = 99pm. आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर परमाणु का आकार 2 4 बढ़ता जाता है, क्योंकि प्रत्येक तत्त्व के बाद वाले तत्त्व में इलेक्ट्रॉनों का एक नया शेल है। इसे सारणी V में दिखाया गया है।
4. आयनन ऊर्जा – किसी विलगित गैसीय परमाणु में सबसे कमजोर बल से बँधे इलेक्ट्रॉनों को निष्कासित करने के लिए आवश्यक ऊर्जा आयनन ऊर्जा कहलाती है। इसे प्रथम आयनन ऊर्जा भी कहते हैं।
एक ही इलेक्ट्रॉन नहीं, बल्कि पहले इलेक्ट्रॉन के निकल जाने के पश्चात दूसरे और तीसरे इलेक्ट्रॉन भी परमाणु से निष्कासित किए जा सकते हैं इनके लिए आवश्यक ऊर्जाएँ क्रमशः द्वितीय और तृतीय आयनन ऊर्जा कहलाती हैं।

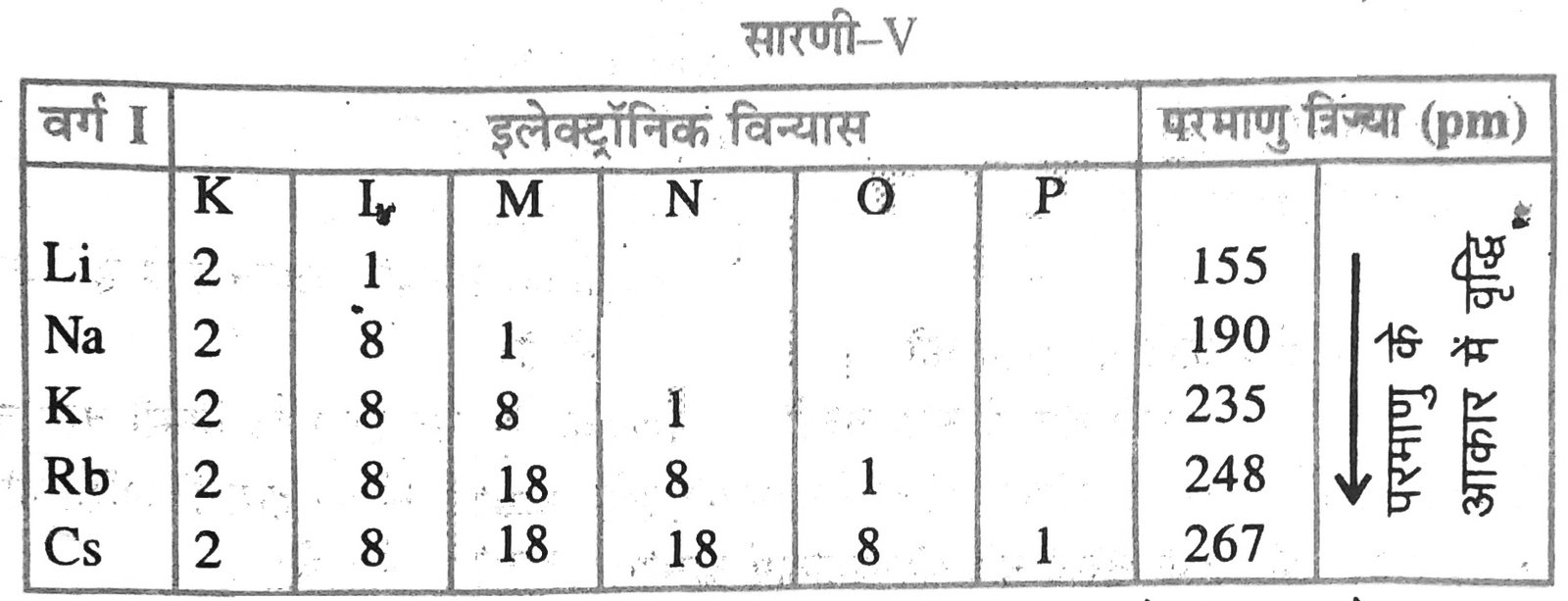
E1,E2 और E3 क्रमश: प्रथम, द्वितीय और तृतीय आयनन ऊर्जा हैं जो 1, 2 और 3 इलेक्ट्रॉनों को एक-एक करके निष्कासित करने के लिए आवश्यक होती है।
द्वितीय आयनन ऊर्जा का मान प्रथम आयनन ऊर्जा के मान से अधिक होता है। इसका कारण यह है कि एक इलेक्ट्रॉन के निकल जाने से परमाणु पर इकाई धन आवेश उत्पन्न हो जाता है जिससे धन आवेशित परमाणु दूसरे इलेक्ट्रॉन को अपनी ओर खींचे रहता है। अत: दूसरे इलेक्ट्रॉन को निष्कासित करने के लिए अतिरिक्त ऊर्जा की आवश्यकता होती है। अतः,
E2 > E1
इसी प्रकार, E3 > E2
∴ E1 > E2 > E1
आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर परमाणु का आकार बढ़ते जाता है। अतः, संयोजी इलेक्ट्रॉन नाभिक से दूर होते जाता है जिससे नाभिक और संयोजी इलेक्ट्रॉन के बीच का आकर्षण-बल कमजोर होते जाता है। अतः, परमाणु अधिक आसानी से अपना संयोजी इलेक्ट्रॉन खोकर धनायन में परिवर्तित हो सकता है। अतः आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर आयनन ऊर्जा का मान घटते जाता है; अर्थात, तत्त्व का विद्युतधनात्मक गुण बढ़ते जाता उदाहरण के लिए, Li की आयनन ऊर्जा Na से अधिक होती है; अर्थात, Na, Li की तुलना में अधिक विद्युतधनात्मक तत्त्व है।
वर्ग 1 के तत्वों की प्रथम आयनन ऊर्जा –
| वर्ग 1 | आयनन ऊर्जा (eV में) |
|
Li
Na
K
Rb
Cs
|
5.4
5.1
4.3
4.2
3.9
|
5. धातुई गुण – किसी वर्ग में ऊपर से नीचे आने पर तत्त्व को धातुई गुण बढ़ने लगता है। वर्ग के सबसे निचले तत्त्व का धातुई गुण सबसे अधिक होता है। उदाहरण के लिए, वर्ग 15 का पहला तत्त्व नाइट्रोजन (N) है जो स्पष्टतः एक अधातु है, जबकि अंतिम तत्व विस्मथ (Bi) में धातुई गुण स्पष्ट हो जाता है।
आवर्त सारणी में सोडियम (Na), मैग्नीशियम (Mg), कैल्सियम (Ca) आदि धातु सारणी के बायीं ओर है।
6. विद्युत ऋणात्मकता – सहसंयोजक बंधन से जुड़े इलेक्ट्रॉन-युग्म को अपनी ओर आकर्षित करने की परमाणु की क्षमता को उसकी विद्युत ऋणात्मकता कहते हैं।
आवर्त सारणी के किसी वर्ग के ऊपर से नीचे आने पर तत्वों की विद्युत ऋणात्मकता क्रमशः घटती जाती है। उदाहरण के लिए, वर्ग 17 के हैलोजेन के तत्वों में फ्लुओरीन सबसे अधिक विद्युत ऋणात्मक होता है, जबकि आयोडीन सबसे कम विद्युत ऋणात्मक होता है।
7. रासायनिक क्रियाशीलता आवर्त सारणी के किसी वर्ग के सभी तत्वों के इलेक्ट्रॉनिक विन्यास एक जैसे होते हैं। अतः उनके रासायनिक गुणों में भी समानता होती है। फिर भी, वर्ग में ऊपर से नीचे आने पर तत्वों की रासायनिक क्रियाशीलता में नियमित क्रमबद्धता पायी जाती है।
(i) वर्ग में ऊपर से नीचे आने पर धातुओं की क्रियाशीलता बढ़ती है। उदाहरण के लिए, वर्ग 1 का लिथियम (Li) सबसे कम क्रियाशील है, जबकि फ्रॉसियम (Fr) सबसे अधिक क्रियाशील होता है।
क्षार धातुओं और क्षारीय मृदा धातुओं की क्रियाशीलताओं का क्रम निम्नलिखित होता है-
वर्ग 1 की क्षार-धातुएँ : Li < Na < K < Rb < Cs < Fr
वर्ग 2 की क्षारीय मृदा धातुएँ : Be < Mg < Ca < Sr < Ba < Ra
(ii) वर्ग में ऊपर से नीचे आने पर अधातुओं की क्रियाशीलता घटती जाती है। उदाहरण के लिए, वर्ग 17 के हैलोजेन तत्त्वों की क्रियाशीलता का क्रम निम्नलिखित होता है-
F > Cl > Br > I
8. भौतिक गुण-
(i) किसी वर्ग में ऊपर से नीचे आने पर धातुई तत्त्वों के भौतिक गुण (द्रवणांक, क्वथनांक आदि) क्रमशः घटते जाते हैं, किन्तु घनत्व में बढ़ने की प्रवृत्ति होती है।

(ii) वर्ग में ऊपर से नीचे आने पर अधातुओं के भौतिक गुण क्रमश: बढ़ते जाते हैं।

आवर्ती की विशेषताएँ इनकी विशेषताएँ इस प्रकार हैं –
1. संयोजी इलेक्ट्रॉन–किसी आवर्त में बाएँ से दाएँ जाने पर संयोजी इलेक्ट्रॉनों की संख्या क्रमश: 1 से 8 तक बढ़ती है। प्रथम आवर्त में यह वृद्धि सिर्फ 1 से 2 तक होती है। तृतीय आवर्त में होनेवाली वृद्धि को सारणी में दिखाया गया है।
सारणी : आवर्त 3 में संयोजी इलेक्ट्रॉनों की संख्या में परिवर्तन

सारणी से स्पष्ट है कि इन तत्त्वों के परमाणुओं में संयोजी शेलों की संख्या समान है। अतः, समान शैलों की संख्यावाले तत्त्वों को आवत सारणी के एक ही आवर्त के अंतर्गत रखा गया है।
2. संयोजकता द्वितीय और तृतीय आवर्तो में बाएँ से दाएँ जाने पर हाइड्रोजन के सापेक्ष संयोजकता 1 से 4 तक बढ़ती है, फिर 4 से क्रमशः घटकर 1 हो जाती है।
तृतीय आवर्त : Na Mg Al Si P S Cl
संयोजकता : 1 2 3 4 3 2 1
अतः, एक ही आवर्तवाले तत्त्वों की संयोजकताएँ भिन्न-भिन्न होती हैं।
3. परमाणु का आकार – किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के परमाणु आकार घटते जाते हैं।

किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु संख्या बढ़ती है। अतः, परमाणु में प्रोटॉनों और इलेक्ट्रॉनों की संख्याएँ बढ़ती जाती हैं। अतिरिक्त आनेवाले इलेक्ट्रॉन एक ही शेल में प्रवेश करते हैं। अतः, नाभिक में धन आवेश बढ़ने से नाभिक और बाह्य इलेक्ट्रॉनों के बीच आकर्षण बढ़ जाने से बाह्य इलेक्ट्रॉन शेल नाभिक की ओर खिंच जाते हैं। फलतः, परमाणु का आकार घटते जाता है।
4. धातुई गुण– किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के धातुई गुण घटते जाते हैं। अतः, विशिष्ट धातुएँ आवर्त सारणी में एकदम बायीं ओर और विशिष्ट अधातुएँ एकदम दायीं ओर स्थित हैं। उदाहरण के लिए, तृतीय आवर्त के तत्त्वों को लें।

5. आयनन ऊर्जा- किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों की आयनन ऊर्जा क्रमशः बढ़ती जाती है। इसका कारण परमाणु के आकार का घटते जाना है। फलतः, तत्त्व का विद्युत धनात्मक गुण कम होते जाता है और विद्युतऋणात्मक गुण बढ़ते जाता है।
6. विद्युतऋणात्मकता- किसी आवर्त में बाएँ से दाएँ जाने पर तत्व की विद्युतऋणात्मकता बढ़ती जाती है। इसका कारण यह है कि बाएँ से दाएँ जाने पर परमाणु का आकार घटता है जिससे प्रवेश करनेवाले अतिरिक्त इलेक्ट्रॉन आसानी से नाभिक की ओर आकर्षित हो जाते हैं।
7. ऑक्साइडों के गुण- किसी आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के ऑक्साइड की प्रकृति प्रबल भास्मिक से क्रमशः घटकर प्रबल अम्लीय हो जाती है।

4. मेंडलीव की आवर्त सारणी से आधुनिक आवर्त सारणी सर्वोच्च है। कैसे ?
उत्तर – मेंडलीव की आवर्त सारणी की तुलना में आधुनिक आवर्त सारणी अधिक उपयोगी है।
- आधुनिक आवर्त सारणी तत्त्वों की परमाणु संख्या पर आधारित है, जबकि मेंडलीव की आवर्त सारणी तत्त्वों के परमाणु द्रव्यमान पर आधारित है। परमाणु द्रव्यमान की तुलना में परमाणु संख्या तत्त्व का अधिक मौलिक गुण है।
- आधुनिक आवर्त सारणी में तत्त्वों को उनके इलेक्ट्रॉनिक विन्यास के अनुसार सजाया गया है। समान इलेक्ट्रॉनिक विन्यास वाले तत्त्व एक ही वर्ग के अंतर्गत रखे गए हैं। इसीलिए किसी वर्ग के सभी तत्त्वों के गुण समान होते हैं। विभिन्न इलेक्ट्रॉनिक विन्यासवाले तत्त्व भिन्न-भिन्न गुणवाले होते हैं। अतः इन्हें भिन्न-भिन्न वर्गों में रखा गया है।
- आधुनिक आवर्त सारणी की सहायता से तत्त्वों के गुणों की रासायनिक आवर्तता की व्याख्या संतोषजनक रूप से की जा सकती है। तत्त्वों के इलेक्ट्रॉनिक विन्यास की आवर्तता के कारण उनके गुणों में भी आवर्तता उत्पन्न होती है। चूँकि तत्त्वों के इलेक्ट्रॉनिक विन्यास की पुनरावृत्ति निश्चित अंतरालों पर होती है, अतः उनके गुणों में भी ऐसी ही पुनरावृत्ति होती है।
- मेंडलीव की आवर्त सारणी की कई विसंगतियाँ आधुनिक आवर्त सारणी में दूर हो गयी हैं।
- आधुनिक आवर्त सारणी में सामान्य तत्त्व, संक्रमण तत्त्व और उत्कृष्ट गैसें स्पष्ट रूप से अलग-अलग कर दी गयी हैं। धातु और अधातु तत्त्व भी अलग-अलग हैं। किन्तु मेंडलीव की आवर्त सारणी में तत्त्वों के विभिन्न प्रकार अलग-अलग नहीं हैं।
- आधुनिक आवर्त सारणी में मेंडलीव की सारणी के उपवर्ग A और B बिल्कुल अलग-अलग कर दिए गए हैं और वर्गों की संख्याओं को 1, 2, 3, 4 ………., 18 तक अंकों में व्यक्त किया गया है।
- आधुनिक सारणी को याद रखना अपेक्षाकृत आसान है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here