धातु एवं अधातु | Class 10Th Chemistry Chapter – 3 Notes | Model Question Paper | धातु एवं अधातु Solutions
धातु एवं अधातु | Class 10Th Chemistry Chapter – 3 Notes | Model Question Paper | धातु एवं अधातु Solutions
धातु एवं अधातु (Metal and Non-Metal)
स्मरणीय तथ्य : एक दृष्टिकोण
(MEMORABLE FACTS : AT A GLANCE)
- तत्त्वों को धातु एवं अधातु, दो वर्गों में विभक्त किया गया है।
- धातुएँ ऑक्सीजन के साथ संयोग कर भास्मिक ऑक्साइड बनाती हैं।
- धातुएँ वे तत्व हैं जो इलेक्ट्रॉन खोकर धनात्मक आयन बनाती हैं।
- धातुएँ प्राय: कठोर, चमकीली, आघातवर्धनीय तथा ऊष्मा एवं विद्युत की सुचालक होती हैं।
- मरकरी (पारा) को छोड़कर सभी धातुएँ सामान्य अवस्था में ठोस होती है।
- धातुओं के वे ऑक्साइड जो अम्लीय एवं भास्मिक दोनों गुण प्रदर्शित करते हैं, द्विधर्मी ऑक्साइड कहलाते हैं। जैसे—ऐल्युमीनियम ऑक्साइड एवं जिंक ऑक्साइड।
- धातुओं का वह गुण जिसके कारण उनके पहले एवं लम्बे तार बनाए जाते हैं उसे तन्यता कहते हैं।
- धातुओं की वह श्रेणी जिसमें धातुओं को क्रियाशीलता के क्रम में दिखाया जाता है, क्रियाशीलता श्रेणी कहलाती है।
- क्रियाशीलता श्रेणी में जो धातुएँ हाइड्रोजन के ऊपर हैं वे तनु अम्लों से अभिक्रिया करके हाइड्रोजन मुक्त करती हैं।
- धातुओं द्वारा ऊष्मा या विद्युत को गुजरने देना चालकता कहलाता है।
- धातुओं को उनके अयस्कों से निकालना तथा उनका उपयोग हेतु विशुद्ध करने को धात्विक धातुकर्म कहते हैं।
- धातुओं को यौगिकों से अधिक क्रियाशा है। विस्थापित कर विशुद्ध धातु प्राप्त करने की प्रक्रिया को परिष्करण कहते हैं।
- अधिक क्रियाशील धातु कम क्रियाशील धातु को उसके लवण के विलयन से उस धातु को विस्थापित कर देती है।
- प्रकृति में धातु मुक्त या संयुक्त अवस्था में पायी जाती है।
- धातुओं का वह गुण जिसके कारण उन्हें पीटकर पतली चादरों में परिवर्तित किया जा सकता है आघातवर्ध्यता कहलाती है।
- किसी अणु के परमाणुओं को एक साथ बाँधकर रखनेवाला आकर्षण बल रासायनिक बंधन कहलाता है।
- जो परमाणु इलेक्ट्रॉन का त्याग करके धनायन बनाते हैं वे विद्युत धनात्मक कहलाते हैं ।
- जो परमाणु इलेक्ट्रॉन प्राप्त करके ऋणायन बनाते हैं वे विद्युत ऋणात्मक कहलाते हैं।
- एक परमाणु से दूसरे परमाणु में इलेक्ट्रॉनों के स्थानांतरण के फलस्वरूप जो बंधन बनता उसे वैद्युत संयोजक बंध या आयनिक बंधन कहते हैं।
- वैद्युत संयोजक यौगिक जल में विलेय, किन्तु कार्बनिक विलायकों में अविलेय होते हैं।
- सहसंयोजक बंधनवाले यौगिक सहसंयोजक यौगिक कहलाते हैं।
- वैद्युत संयोजक यौगिक द्रवित अवस्था में या जलीय विलयन की अवस्था में विद्युत के सुचालक होते हैं।
- सहसंयोजक यौगिक जल में अविलेय किंतु कार्बनिक विलयों में विलेय होते हैं।
- सहसंयोजक यौगिकों का द्रवणांक और क्वथनांक उच्च होता है।
- सहसंयोजक यौगिक विद्युत के कुचालक होते हैं।
- पृथ्वी के परत से प्राप्त किसी धातु के अयस्क में उपस्थित अपद्रव्यों को दूर कर अयस्क को शुद्ध रूप में प्राप्त करना अयस्क का सांद्रण कहलाता है।
- वायु के ऑक्सीजन एवं जलवाष्प की उपस्थिति में ही लोहे में जंग लगता है।
- मिश्रधातु दो या अधिक धातुओं या एक धातु एवं एक अधातु का समांग मिश्रण है।
- कुछ धातुओं को लंबे समय तक खुली हवा में छोड़ देने पर उसकी सतह मलिन पड़ जाती है और धीरे-धीरे धातुओं का क्षय होने लगता है। यह क्रिया धातुओं का संक्षारण कहलाती है।
- अधातुएँ वे तत्व हैं, जो इलेक्ट्रॉन प्राप्त कर ऋणात्मक आयन बनाती है।
- अधातुएँ ऑक्सीजन से संयोग करके अम्लीय ऑक्साइड बनाती हैं।
- अधातुएँ न तो आघात वर्धनीय होती है और न ही तन्य । इनमें कोई विशेष चमक नहीं होती तथा ये प्रायः ऊष्मा एवं विद्युत की कुचालक होती हैं।
- अधातुओं के परमाणु इलेक्ट्रॉन प्राप्त कर ऋणायन में परिवर्तित हो जाते हैं।
- ताँबा का सबसे मुख्य अयस्क कॉपर पाइराइट है।
- उत्प्रेरकों की क्षमता बढ़ाने वालों को वर्धक कहते हैं।
- शुद्ध सोना 24 कैरेट का होता है किन्तु यह अत्यन्त मुलायम होता है। इस कारण गहने के निर्माण के लिए यह उपयुक्त होता है।
- जस्ता का मुख्य अयस्क (ZnCO3) तथा जिंक ब्लैण्ड (ZnS) है।
- पारा का मुख्य अयस्क सिनेबार (HgS) है।
- पीतल Cu(80%) तथा Zn (20%) से निर्मित मिश्रधातु है।
- आभूषणों के निर्माण के लिए 22 कैरेट सोना उपयुक्त होता है । 22 कैरेट का अर्थ है 20 भाग सोना एवं 2 भाग सिल्वर या ताँबा मिश्रित है।
- ड्यूरालुमिन एक मिश्रधातु मिला हुआ होता है। जिसमें Al (95%), Cu (3%), Mn ( 1%) तथा Mg (0.5% )
- ड्यूरालुमिन से वायुयान, प्रेसर कुकर, स्वचालित वाहनों के पार्ट्स बनाये जाते हैं।
- ऐलुमीनियम का मुख्य अयस्क बॉक्साइट (Al2O3 2H2O) तथा कोरंडन (Al2O3) है। क्वायोलाइट (Na3AlF6) भी ऐलुमीनियम का ही अयस्क है।
अभ्यासार्थ प्रश्न
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर ( क, ख, ग या घ) लिखें।
1. निम्नलिखित में से किस धातु को किरोसिन में डुबाकर रखते हैं ?
(क) मैग्नीशियम
(ख) सोडियम
(ग) मरकरी
(घ) टंग्स्टन
उत्तर – (ख)
2. बॉक्साइड निम्नलिखित में से किस धातु का अयस्क है ?
(क) मैग्नीशियम
(ख) सोडियम
(ग) ऐलुमीनियम
(घ) बेरियम
उत्तर – (ग)
3. निम्नलिखित में किस धातु पर वायु प्रभाव नहीं पड़ता है ?
(क) सोना
(ख) सोडियम
(ग) लोहा
(घ) ताँबा
उत्तर – (क)
4. निम्नलिखित में कौन-सा लवण समुद्री जल में पाया जाता है ?
(क) LiCl
(ख) BaSO4
(ग) Na3PO4
(घ) NaCl
उत्तर – (घ)
5. इनमें किस धातु का विस्थापन उसके लवण के विलयन में लोहा द्वारा होता है ?
(क) कैल्सियमें
(ख) सोडियम
(ग) ताँबा
(घ) पोटैशियम
उत्तर – (ग)
6. निम्नलिखित में कौन-सी धातु साधारण ताप पर द्रव रूप में पाई जाती है ?
(क) लिथियम
(ख) लेड
(ग) मरकरी (पारा)
(घ) सिल्वर
उत्तर – (ग)
7. निम्नलिखित में कौन विद्युत का सुचालक है ?
(क) सल्फर
(ख) प्लैस्टिक
(ग) आयोडीन
(घ) ग्रेफाइट
उत्तर – (घ)
8. क्रियाशीलता श्रेणी के नीचेवाली धातुएँ
(क) अम्लों से अभिक्रिया कर हाइड्रोजन आयन देती है।
(ख) अम्लों से अभिक्रिया कर हाइड्रोजन गैस बनाती है।
(ग) जल के साथ साधारण ताप पर ही अभिक्रिया करती है।
(घ) इनमें कोई नहीं।
उत्तर – (घ)
9. निम्नलिखित में कौन-सी धातु अम्लराज के अलावे किसी अन्य अम्ल में नहीं घुलती है ?
(क) Al
(ख) Fe
(ग) Au
(घ) Cu
उत्तर – (ग)
10. निम्नलिखित में किस विधि द्वारा लोहे की कड़ाही को जंग लगने से बचाया जा सकता है ?
(क) ग्रीज का लैपन करके
(ख) रंगाई करके
(ग) जस्ता की परत चढ़ाकर
(घ) इनमें सभी के द्वारा
उत्तर – (ग)
11. खाद्य पदार्थवाले कुनस्तूर पर टुिन का लेप चढ़ाया जाता है, जस्ता लेप नहीं, क्योंकि –
(क) जस्ता टिन से अधिक महँगा होता है।
(ख) जस्ता का द्रवणांक टिन अधिक होता है।
(ग) जस्ता टिन से अधिक क्रियाशील होता है।
(घ) जस्ता टिन से कम क्रियाशील होता है।
उत्तर – (क)
12. सोडियम और क्लोरीन के बीच अभिक्रिया होने पर
(क) सोडियम परमाणु एक इलेक्ट्रॉन प्राप्त करता है।
(ख) सोडियम परमाणु एक इलेक्ट्रॉन खोकर धनायन बनाता है ।
(ग) क्लोरीन परमाणु एक इलेक्ट्रॉन खोता है।
(घ) सहसंयोजक यौगिक बनता है।
उत्तर – (ख)
13. निम्नलिखित में कौन दो इलेक्ट्रॉन खोकर आर्गन जैसी स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करता है?
(क) Mg
(ख) Br
(ग) Ca
(घ) S
उत्तर – (ग)
14. वह परमाणु जो अपने संयोजी इलेक्ट्रॉन का त्याग आसानी से कर देता है, कहलाता है
(क) विद्युतऋणात्मक
(ख) विद्युतधनात्मक
(ग) रेडियोसक्रिय
(घ) उपधातु
उत्तर – (ख)
15. तत्व A का इलेक्ट्रॉनिक विन्यास 2,8,6 और तत्त्व B का 2,8, 8, 1 है। A और B के संयोग से बने यौगिक की प्रवृत्ति होगी
(क) आयनिक
(ख) सहसंयोजक “
(ग) उपसहसंयोजक
(घ) अध्रुवीय
उत्तर – (क)
16. निम्नलिखित में कौन आयनिक यौगिक है?
(क) HCN
(ख) CCl4
(ग) KCl
(घ) CO2
उत्तर – (ग)
17. चाँदी के चम्मच को लंबे समय तक खुली वायु में छोड़ देने पर उसकी सतह काली हो जाती है। निम्नलिखित में से किस यौगिक के बनने के कारण ऐसा होता है ?
(क) Ag2O
(ख) Ag3N
(ग) Ag2S
(घ) AgOH
उत्तर – (ग)
18. A और B परमाणुओं के संयोग से आयनिक बंधन तब बनता है जब-
(क) A और B दोनों इलेक्ट्रॉन प्राप्त करते हैं।
(ख) A और B दोनों इलेक्ट्रॉन का त्याग करते हैं।
(ग) A धातु और B अधातु हो ।
(घ) A और B दोनों धातु हो ।
उत्तर – (ग)
19. निम्नलिखित में पीतल किसका उदाहरण है?
(क) धातु
(ख) अधातु
(ग) मिश्रधातु
(घ) यौगिक
उत्तर – (ग)
II. रिक्त स्थानों की पूर्ति करें।
1. प्रकृति में क्रियाशील धातुएँ ……….. में नहीं पाई जाती है।
उत्तर – मुक्त अवस्था
2. ……… अयस्कों के सांद्रण के लिए विद्युत चुंबकीय विधि प्रयुक्त होती है।
उत्तर – चुम्बकीय
3. …….. विद्युत का सर्वोत्तम चालक है।
उत्तर – सिल्वर
4. धातुओं में …….. विद्युत का सबसे मंद चालक होता है।
उत्तर – सोडियम
5. अयस्कों में उपस्थित उपद्रव्यों को ……. कहते हैं ।
उत्तर – गैंग
6. किसी धातु का मरकरी के साथ बना समांग मिश्रण ………… कहलाता है।
उत्तर – अमलगम
7. लोहे का जस्तीकरण कर देने से उसका ………. नहीं होता है ।
उत्तर – संक्षारण
8. सोडियम एवं पोटैशियम ……… धातु हैं।
उत्तर – क्षार
9. उत्कृष्ट गैसें ……… होती हैं ।
उत्तर – अक्रिय
10. एक परमाणु से दूसरे परमाणु में इलेक्ट्रॉन के स्थानांतरण से बना यौगिक यौगिक ………….. कहलाता है।
उत्तर – आयनिक
11. वैद्युत संयोजक यौगिक जल में प्राय:, किन्तु कार्बनिक विलायकों ………… में होते हैं।
उत्तर – विलेय, अविलेय
12. दो परमाणुओं के बीच दो- दो इलेक्ट्रॉनों का साझा होने पर ……….. बनता है।
उत्तर – द्विबंध
13. CO2 एक ………यौगिक है।
उत्तर – उत्तरसह संयोजक
14. क्लोरीन की संयोजकता 1 होती है क्योंकि क्लोरीन के परमाणु में इलेक्ट्रॉनों की संख्या उसके निकटस्थ उत्कृष्ट गैस आर्गन में ……….. कम होती है।
उत्तर – एक
15. सोडियम क्लोराइड एक ………. यौगिक है।
उत्तर – आयनिक
16. नाइट्रोजन अणु में बंधनों की संख्या ……….होती है।
उत्तर – तीन
III. सही / गलत का चयन करें।
1.धातुएँ चमकीली तथा तन्य होती हैं।
उत्तर – सही
2. धातुएँ विद्युत की कुचालक होती हैं।
उत्तर – गलत
3.अधातुएँ प्रायः ठोस या गैस के रूप में पाई जाती हैं।
उत्तर – सही
4. ब्रोमीन एक गैस है।
उत्तर – गलत
5. कार्बन एक अधातु है जो विभिन्न अपररूपों में पाया जाता है।
उत्तर – सही
6. सोडियम धातु कठोर होती हैं।
उत्तर – गलत
7. धातुओं के ऑक्साइड अम्लीय होते हैं।
उत्तर – गलत
8. अधातुओं के ऑक्साइड अम्लीय होते हैं।
उत्तर – सही
9. कुछ धातुओं के ऑक्साइड जल में घुलकर क्षार बनाते है ।
उत्तर – सही
10. प्लैटिनम का घनत्व निम्न होता है।
उत्तर – गलत
11. आयोडीन में धातुई चमक होती है। अतः, आयोडीन एक धातु है।
उत्तर – गलत
12. सभी अयस्क खनिज होते हैं।
उत्तर – सही
13. नाइट्रिक ऑक्साइड अधातु का ऑक्साइड होने के कारण अम्लीय होता है।
उत्तर – गलत
14. पारा को छोड़कर सभी धातुएँ ठोस होती हैं ।
उत्तर – सही
15. कैल्सियम ऑक्साइड एक सहसंयोजक यौगिक है।
उत्तर – गलत
16. मैग्नीशियम क्लोराइड का जलीय विलयन विद्युत का सुचालक होता है।
उत्तर – सही
17. आयनिक यौगिकों के द्रवणांक उच्च होता है।
उत्तर – सही
18. हाइड्रोजन अणु में हाइड्रोजन के दोनों परमाणु आयनिक बंधन द्वारा जुड़े रहते हैं
उत्तर – गलत
19. प्रायः सभी तत्वों के परमाणु अष्टक नियम का पालन करते हैं ।
उत्तर – सही
20. सहसंयोजक यौगिक विद्युत के सुचालक होते हैं।
उत्तर – गलत
21. कॉपर सल्फेट विलयन में लोहे की छड़ डुबाने पर उसकी बाहरी सतह पर ताँबा एकत्र हो जाता है ।
उत्तर – सही
22. 24 कैरेट सोना आभूषण बनाने के काम आता है।
उत्तर – गलत
23. क्रियाशील धातुएँ प्रकृति में मुक्त अवस्था में पाई जाती हैं।
उत्तर – गलत
24. ऐलुमिनियम का निष्कर्षण बॉक्साइट अयस्क से किया जाता है।
उत्तर – सही
25. किसी परमाणु के सभी इलेक्ट्रॉन संयोजी इलेक्ट्रॉन कहलाते हैं।
उत्तर – गलत
अतिलघु उत्तरीय प्रश्न
1. दो धातु एवं दो अधातु के नाम लिखें।
उत्तर – धातु—(i) लोहा, (ii) ताँबा ।
अधातु – (i) हाइड्रोजन, (ii) ऑक्सीजन।
2. समुद्री जल में पाये जाने वाले एक प्रमुख लवण का नाम लिखें।
उत्तर – सोडियम सल्फेट |
3. किसा अर्धातु का नाम लिखें जो साधारण ताप पर द्रव अवस्था में रहती है।
उत्तर – पारा।
4. एक अधातु का नाम लिखें जो वायु के संपर्क में आने पर जल उठती है ?
उत्तर – फासफोरस।
5. कौन सो अधातु विद्युत का सुचालक होती है ?
उत्तर – ग्रेफाइट।
6. क्या सभी खनिज अयस्क होते हैं ?
उत्तर – नहीं।
7. उल्फ्राम किस अयस्क में विद्यमान रहता है ?
उत्तर – टिन के अयस्क, टिनस्टोन (SnO2) में उल्फ्रॉम (Wolfram) विद्यमान रहता है ।
8. क्या लोहे में जंग लगना ओक्साकरण है
उत्तर – यह ऑक्सीकरण-अवकरण अभिक्रिया है।
9. मिश्रधातु क्या है ?
उत्तर – दो या दो से अधिक धातुओं के समाग्री मिश्रण को मिश्रधातु कहते हैं।
10. अमलगम से आप क्या समझते है ?
उत्तर – जब मिश्रधातु में एक धातु पारा हो तो उसे अमलगम कहते हैं ।
11. किस इलक्ट्रानिक विन्यास को प्राप्त कर तत्व स्थाया बन जाते हैं ?
उत्तर – 2,8 (अष्टक) प्राप्त करके तत्व स्थायी बन जाते हैं ।
12. सोडियम परमाणु जेल के साथ तीव्रता से अभिक्रिया करता है, किंतु सोडियम आयन नहीं, क्यों ?
उत्तर – सोडियम आयन स्थायी होता है, इस कारण जल से अभिक्रिया नहीं करता है।
13. आयनिक यौगिकों के द्रवणांक और क्वथनांक उच्च होते हैं, क्यों ?
उत्तर – इनके धन आयनों एवं ऋण आयनों के बीच मजबूत स्थिर वैद्युत आकर्षण बल कार्य करता है इस कारण इसको तवणांक एवं स्वधनुक्त धान्च होते हैं।
14. कार्बन टेट्रोक्लोरोइड से होकर विद्युत धारा क्यों नहीं प्रवाहित की जा सकती है ?
उत्तर – कार्बन टेट्राक्लोराइड स्थायी विन्यास को प्राप्त कर लेते हैं। इसके बंधन काफी मजबूत होते हैं।
15. आयनिक बंधनों में आयनों के बीच किस प्रकार का बंधन कार्य करता है ?
उत्तर – विद्युत संयोजक बंधन
16. नाइट्रोजन अणु में कितने सहसंयोजक बंधन होते हैं ?
उत्तर – तीन सह – संयोजकता बंधन होते हैं
17. अभिक्रिया तान सह सयाज भाविधन मात कॉन-भाग लेते हैं ।
उत्तर – संयोजकता या संयोजी इलेक्ट्रॉन ।
18. रसायनिक बंधन मुख्यतः कितने प्रकार के होते हैं ?
उत्तर – रासायनिक बंधन मुख्यतः दो प्रकार के होते हैं
(i) वैद्युत संयोजक, (ii) सह – संयोजक
19. एक परमाणु से दूसरे परमाणु में इलेक्ट्रॉनों का स्थानांतरण होने से किस प्रकार का बंधन बनता है ?
उत्तर – वैद्युत संयोजक बंधन
20. दो परमाणुओं के बीच इलेक्ट्रॉनों का साझा होने पर किस प्रकार का बंधन बनता है ?
उत्तर – सह-संयोजक बंधन।
21. निम्नांकित यौगिकों में बंधन की प्रकृति बताएँ –
(i) अमोनिया
(ii) कार्बन डाइऑक्साइड
(iii) सोडियम मोनोक्साइड
उत्तर –
(i) अमोनिया – एकल सह-संयोजक बंधन
(ii) कार्बन डाइऑक्साइड – द्वि सह संयोजक बंधन
(iii) सोडियम मोनोक्साइड – आयनिक बंधन।
22. ऑक्सीजन परमाणु का इलेक्ट्रानिक विन्यास नियॉन जैसा होने के लिए उसे कितने इलेक्ट्रॉन की आवश्यकता होगी ?
उत्तर – 2 इलेक्ट्रॉन ।
23. एक तत्त्व A के संयोजी रोल में 4 इलेक्ट्रॉन हैं और दूसरे तत्त्व B के संयोजी शेल में 7 इलेक्ट्रॉन हैं। A और B के संयोग से बननेवाला यौगिक विद्युत का कुचालक है। इस यौगिक में बंधन की प्रकृति बताएँ और इसकी इलेक्ट्रॉनिक संरचना लिखें।
उत्तर – यौगिक – कार्बन टेट्राक्लोराइड, बंधन की प्रकृति – एकल सह-संयोजक बंधन

24. एक यौगिक A और ऐलुमिनियम का उपयोग रेल लाइनों के जोड़ने में किया जाता है । यौगिक A की पहचान करें।
उत्तर – कॉपर
25. धातु के निष्कर्षण में सल्फाइड और कार्बोनेट अयस्कों को धातु के ऑक्साइड में परिवर्तित करना पड़ता है, क्यों ?
उत्तर – धातुओं को अनेक ऑक्साइड से निष्कर्षित करने में सल्फाइड और कार्बोनेट की तुलना में काफी आसानी होती है।
26. उस मिश्र धातु का नाम लिखें जिसका उपयोग विद्युत तारों को जोड़ने में किया जाता है ?
उत्तर – सोल्डर Sn ( 50% ) + Pb (50%)
लघु उत्तरीय प्रश्न
1. धातु एवं अधातु में एक अंतर बताएँ।
उत्तर – धातुओं में एक विशेष प्रकार की चमक होती है। अधातुओं में कोई चमक नहीं होती है।
2. धातुएँ विद्युत की सुचालक क्यों होती हैं ?
उत्तर – धातुओं के परमाणुओं में मुक्त इलेक्ट्रॉन रहते हैं। इस कारण विद्युत की धारा प्रवाहित होने पर उससे इलेक्ट्रॉन का प्रवाह सतत होता है। इसलिए यह विद्युत का सुचालक होता है।
3. धातु की तन्यता और आघातवर्धनीयता से क्या समझते हैं ?
उत्तर – धातु की तन्यता का तात्पर्य है खींचकर तार बनाना । धातुएँ तन्य होती हैं। अर्थात् वह गुण जिस कारण धातुओं से तार खींचे जा सकते हैं। आघातवर्धनीयता धातुओं का एक धातुओं को गुण है। पीटकर इनसे हथौड़े से पीटकर चादरें बनायी जाती हैं अर्थात् वह गुण जिस कारण चादरें बनायी जाती हैं। सोना एवं सिल्वर सर्वाधिक आघातवर्ध्य एवं तन्य हैं।
4. द्विधर्मी ऑक्साइड क्या है ?
उत्तर – धातुओं के वे ऑक्साइड जो अम्लीय एवं क्षारीय या भास्मिक हैं द्विधर्मी ऑक्साइड कहलाते हैं। जैसे ऐलुमीनियम ऑक्साइड एवं जिंक दोनों गुण प्रदर्शित करते ऑक्साइड।
5. ग्रेफाइड अधातु होते हुए भी कौन-सा धातुई गुण प्रदर्शित करता है ?
उत्तर – ग्रेफाइड में धातुई गुण मौजूद है क्योंकि उसमें चमक होती है होती है। और वह विद्युत धनात्मक होती है।
सहसंयोजक यौगिक – जब दो परमाणु आपस में इलेक्ट्रॉनों का साझा करके बंध बनाते हैं तो यह सहसंयोजक बंध कहलाते हैं तथा इनमें यौगिक सह-संयोजक यौगिक कहलाते हैं। इसमें यौगिक के परमाणु के इलेक्ट्रॉनों के बीच परस्पर साझेदारी होती है।
6. ऑर्गन के दो परमाणु परस्पर संयुक्त होकर ऑर्गन अणु (Ar,) क्यों नहीं बनाते हैं ?
उत्तर – ऑर्गन अक्रिय गैस है। इसका अष्टक पूरा रहता है। इस कारण किसी से संयोजक या बंधन नहीं बनता है। इस कारण यह परमाणु के रूप में रहता है।
7. परमाणु एवं आयन में अन्तर लिखें।
उत्तर – परमाणु– किसी तत्त्व का सबसे सूक्ष्म कण परमाणु है। ये इलेक्ट्रॉन, प्रोटॉन एवं न्यूट्रॉन से मिलकर बने होते हैं।
आयन– किसी तत्त्व के परमाणु का इलेक्ट्रॉन ग्रहण करने या त्याग करने से परमाणु के परिवर्तित रूप को आयन के कहते हैं। आयन दो प्रकार हैं धनायन तथा ऋणायन । उदाहरणार्थ, Na अब एक इलेक्ट्रॉन खोता है तो यह Na+ आयन बनाता है। जब इलेक्ट्रॉन ग्रहण करता है तो Na आयन बनाता है।
8. सहसंयोजक बंधन कितने प्रकार के होते हैं और ये कैसे बनते हैं ?
उत्तर – सहसंयोजक बंधन तीन प्रकार के होते हैं—
(i) एकल सहसंयोजक बंधन (Single Covalent bond)
(ii) द्विक सहसंयोजक बंधन (Double Covalent bond)
(iii) त्रिक सहसंयोजक बंधन (Triple Covalent bond )
(i) एकल सहसंयोजक बंधन — जब दो परमाणुओं के बीच इलेक्ट्रॉनों के सिर्फ एक युग्म का साझा होता है तब उनके बीच एकल सहसंयोजक बंधन बनता है-

(ii) द्विक सहसंयोजक बंधन – जब संयोग करने वाले दोनों परमाणु दो-दो इलेक्ट्रॉनों का साझा करते हैं तब उनके बीच द्विक सहसंयोजक बंधन बनता है।

(iii) त्रिक सहसंयोजक बंधन- जब संयोग करनेवाले दो परमाणु तीन-तीन (तीन जोड़ा) इलेक्ट्रॉनों (छ: इलेक्ट्रॉन) का साझा करते हैं तब उन परमाणुओं के बीच त्रिक सहसंयोजक बंधन बनता है।

9. आप कैसे प्रमाणित करेंगे कि कार्बन टेट्राक्लोराइड विद्युत का कुचालक होता है ?
उत्तर – कार्बन टेट्राक्लोराइड उदासीन अणुओं से बने होते हैं। ये आयन से नहीं बने हैं। इस कारण यह जलीय विलयन या पिघली अवस्था में आयन उत्पन्न नहीं करता है। इसलिए यह विद्युत का कुचालक होता है।
10. सोडियम क्लोराइड जल में घुल जाता है, किन्तु कार्बन टेट्राक्लोराइड नहीं, क्यों ?
उत्तर – सोडियम क्लोराइड जल में घुल जाता है, इसका कारण यह है कि जल के अणु सोडियम कलोराइड जैसे यौगिक में विद्यमान आयनों के साथ पारस्परिक क्रिया करते हैं जिससे सोडियम क्लोराइड में उपस्थित आयनों के बीच का आकर्षण बल कमजोर होकर टूट जाता है और आयन अलग-अलग हो जाते हैं। परिणामस्वरूप सोडियम क्लोराइड जल में घुल जाता है । किन्तु दूसरी ओर कार्बन टेट्राक्लोराइड जल में नहीं घुलता है; क्योंकि कार्बन टेट्राक्लोराइड जैसे कार्बनिक विलायक के साथ ऐसी कोई बात नहीं होती है। अतः सोडियम क्लोराइड जैसे यौगिक में होती है।
11. CH4 और CO2 इलेक्ट्रॉनिक संरचना लिखें।
उत्तर –

12. किसी रासायनिक यौगिक के बनने में संयोजी इलेक्ट्रॉनों की क्या भूमिका होती है ?
उत्तर – रासायनिक अभिक्रिया में भाग लेने वाले इलेक्ट्रॉनें ही संयोजी इलेक्ट्रॉन होते हैं। संयोजी इलेक्ट्रॉन ही तत्त्वों के साथ बंधन बनाकर यौगिक का निर्माण करते हैं। इस कारण इसकी भूमिका महत्त्वपूर्ण है।
13. किसी तत्व A की परमाणु संख्या 12 है और दूसरे तत्व B की परमाणु संख्या 17 है। A और B के संयोग से बने यौगिक का सूत्र लिखें।
उत्तर – A (12) का इलेक्ट्रॉनिक विन्यास – 2, 8, 2
B (17) का इलेक्ट्रॉनिक विन्यास– 2, 8, 7
A धातु मैग्नीशियम (Mg) तथा B धातु क्लोरीन (Cl) है। इसके संयोग से मैग्नीशियम क्लोराइड (MgCl2) बनता है।
14. (a) अमोनिया के अणु के कुल कितने सहसंयोजक बंधन हैं ?
(b) सोडियम अणु कहना क्या सही है ?
उत्तर – (a) अमोनिया के अणु में कुल 3 सहसंयोजक बंधन हैं।
(b) हाँ, सोडियम को अणु कहना उचित है।
15. एक परमाणु A दूसरे परमाणु B को दो इलेक्ट्रॉन प्रदान कर एक यौगिक बनाता है, तो A की संयोजकता और B की अंतिम कक्षा में इलेक्ट्रॉनों की संख्या बतायें।
उत्तर – A की संयोजकता 2 है और B की अंतिम कक्षा में इलेक्ट्रॉनों की संख्या 6 है। अतः A और B मिलकर मैग्नीशियम ऑक्साइड (MgO) यौगिक बनायेंगे जिसमें उपस्थित आयन Mg2+ और O2- है।
16. हाइड्रोजन अणु (H2) के बनने में दोनों H– परमाणु अष्टक प्राप्त नहीं करते, फिर भी हाइड्रोजन का अणु काफी स्थायी होता है, क्यों ?
उत्तर – हाइड्रोजन के दो परमाणुओं के संयोग से हाइड्रोजन अणु (H2) बनता है। इसमें हाइड्रोजन के दोनों परमाणु एक-एक इलेक्ट्रॉनों का साझा करके द्वितीय (duplet) पूरा करते हैं।
H’ + ‘H → H : H
साझेदारी में भाग लेने वाले दोनों इलेक्ट्रॉन दोनों परमाणुओं के बीच में रहते हैं। दोनों H परमाणुओं के बीच दो बिंदुयें साझे के इलेक्ट्रॉन-युग्म को निरूपित करती हैं साझे के एक इलेक्ट्रॉन युग्म से एकल बंधन (Single bond) बनता है, जिसे दोनों H– परमाणुओं के बीच एक छोटी रेखा (-) द्वारा सूचित किया जाता है। अतः हाइड्रोजन के अणु को निम्नलिखित प्रकार से दर्शाया जा सकता है –

बंधन बन जाने के पश्चात् दोनों परमाणुओं का इलेक्ट्रॉन विन्यास उत्कृष्ट गैस हीलियम की भाँति स्थायी बन जाता है।
17. A, B और C तीन तत्त्वों की परमाणु संख्यायें क्रमश: 8, 10 और 20 हैं। इनमें अक्रिय गैस की पहचान करें।
उत्तर – A तत्त्व की परमाणु संख्या 8, B तत्त्व की परमाणु संख्या 10 तथा C तत्त्व की परमाणु संख्या 20 है। इनमें B जिसका परमाणु संख्या 10 है वह अक्रिय गैस है। क्योंकि इसका इलेक्ट्रॉनिक विन्यास 2, 8 है जबकि गैस होने के लिये आखिरी शेल यानी संयोजी शेल में अष्टक पूरा होना चाहिए।
18. ऑक्सीजन परमाणु का इलेक्ट्रॉनिक विन्यास 2,6 है। इसकी संयोजकता ज्ञात करें।
उत्तर – ऑक्सीजन परमाणु की संयोजकता 6 है; क्योंकि आखिरी शैल में 6 इलेक्ट्रॉन हैं जो संयोजकता के द्योतक हैं।
19. निम्नलिखित में वैद्युत संयोजक और सहसंयोजक यौगिकों का चयन करेंग्लूकोस, पोटैशियम क्लोराइड, ऐसीटिलीन, यूरिया, कॉपर सल्फेट, कार्बन टेट्राक्लोराइड, अमोनियम क्लोराइड|
उत्तर – वैद्युत संयोजक यौगिक– पोटैशियम क्लोराइड, अमोनियम क्लोराइड, कॉपर सल्फेट । सहसंयोजक यौगिक–ग्लूकोस, कार्बन टेट्राक्लोराइडं, ऐसीटिलीन, यूरिया।
20. जल में विलेय दो सहसंयोजक यौगिकों के नाम लिखें।
उत्तर – जल में विलय दो सहसंयोजक यौगिक निम्न हैं
(i) ग्लकोजें (ii) यूरिया
21. मैग्नेटाइट में एक अचुंबकीय पदार्थ मिश्रित हैं। इन्हें अलग करने की एक विधि का उल्लेख करें।
उत्तर – मैग्नेटाइट में एक अचुम्बकीय पदार्थ मिश्रित हैं इन्हें अलग करने की एक सर्वाधिक उपयुक्त विधि इस प्रकार है –
चुम्बकीय पृथक्करण विधि (Magnetic Separation ) — यह विधि वैसे अयस्कों के लिये प्रयुक्त होती है जब अयस्क और उसमें विद्यमान अपद्रव्यों में कोई एक चुम्बकीय हो । उदाहरण के लिये, टिन के अयस्क टिनस्टोन (SnO2) में उल्फ्राम (Wolfram) अपद्रव्य के रूप में उपस्थित रहता है जो चुम्बकीय होता है । टिनस्टोन अयस्क को पीसकर महीन चूर्ण बना दिया जाता है। अब इस चूर्ण को एक विद्युत चुम्बकीय बेलनों (roller) के बेल्ट (belt) पर डालकर मशीन को चालू कर दिया जाता है। उल्फ्राम मैग्नेटाइट चुम्बकीय होने के कारण चुम्बक की ओर आकर्षित होकर एक पात्र में गिरता है, जबकि अचुम्बकीय पदार्थ उससे दूर होकर एक अलग पात्र में गिरता है। इस प्रक्रिया द्वारा सांद्रित मैग्नेटाइट अयस्क प्राप्त किया जाता है।

अतः इस प्रक्रिया द्वारा मैग्नेटाइट में मिले अचुम्बकीय पदार्थ को आसानी से अलग किया जा सकता है फलतः शुद्ध मैग्नेटाइट प्राप्त किया जा सकता है।
22. भर्जन क्या है? उदाहरण देकर समझाएँ।
उत्तर – भर्जन एक वैसी रासायनिक अभिक्रिया है जिसमें सांद्रित अयस्क को पर्याप्त वायु की आपूर्ति में अयस्क के द्रवणांक से कम ताप पर तीव्रता से गर्म किया जाता है जिससे इसमें अपद्रव्य आर्सेनिक (AS) तथा अन्य उपस्थित अपद्रव्य ऑक्सीकृत होकर बाहर निकल जाते हैं तथा धातु ऑक्साइड के रूप में परिवर्तित हो जाता है।
जैसे- 2ZnS + 3O2 → 2Zno + 2So2
23. प्रगलन में द्रावक की क्या भूमिका होती है ?
उत्तर – प्रगलन में द्रावक की भूमिका– द्रावक वह पदार्थ है जिसे अयस्क एवं कोक के साथ मिश्रित कर मिश्रण को गर्म किया जाता है। ऐसा करने से अयस्क में विद्यमान अद्रवणशील अपद्रव्य दूर जाते हैं। इस प्रकार प्रगलन में द्रावक की अति महत्त्वपूर्ण भूमिका है। क्योंकि इसी की सहायता से अयस्क में मौजूद अपद्रव्य को दूर किया जाता है।
24. सोडियम को किरोसिन में क्यों डुबाकर रखा जाता है ?
उत्तर – सोडियम सक्रिय धातु है जो वायु में उपस्थित ऑक्सीजन से क्रिया करके सोडियम ऑक्साइड बनाती है। यह पानी से क्रिया कर सोडियम हाइड्रॉक्साइड तथा हाइड्रोजन उत्पन्न करती है। वायु में खुला छोड़ देने पर यह आग पकड़ लेती है, इसलिये इसे मिट्टी के तेल में डुबोकर सुरक्षित रखते
25. धातुओं के संक्षारण से क्या समझते हैं ?
उत्तर – धातुओं की सतह पर वायु, नमी, CO2, SO2 अथवा रसायनों आदि के प्रभाव से क्षय होने या नष्ट होने को संक्षारण कहते हैं। लोहे नमी एवं ऑक्सीजन या वायु से अभिक्रिया कर Fe2O3 का परत बना लेता है जो भूरे रंग का होता है। यह प्रक्रिया जंग लगना कहलाता है। जंग लोहे को धीरे-धीरे नष्ट कर देता है।
26. धातुओं के शोधन की एक विधि का वर्णन करें।
उत्तर – धातुओं के शोधन की कई प्रचलित विधियाँ हैं। उनमें एक विधि इस प्रकार है –
द्रवण विधि (Liquation Process ) – इस विधि के द्वारा कम द्रवणांक वाली_धातुओं (टिन, लेड आदि) को उच्च द्रवणांक वाली धातुओं से अलग किया जाता है। इस विधि में एक ढालुई भट्ठी का इस्तेमाल किया जाता है। इस भट्ठी का ताप धातु के द्रवणांक से थोड़ा अधिक रखा जाता है। अशुद्ध धातु को भट्ठी के सिरे पर रखते हैं। धातु द्रवित होकर भट्ठी के निचले भाग (ढलकाव) की ओर बहने लगती है, किन्तु अद्रवणशील अपद्रव्य पीछे ही छूट जाते हैं।

27. मिश्रधातु क्या है ? किन्हीं दो मिश्रधातुओं के नाम और उपयोग लिखें।
उत्तर – दो या अधिक धातुओं अथवा एक धातु एवं एक अधातु का समांग मिश्रण मिश्रधातु कहलाता है। इच्छित धातुओं को उपयुक्त मात्रा में मिश्रित कर मिश्रण को गर्म करके पिघला देते हैं। पिघले हुये द्रव को ठण्डा करके ठोस रूप में परिवर्तित कर दिया जाता है। फलस्वरूप प्राप्त ठोस पदार्थ मिश्रधातु कहलाता है।
दो मिश्रधातुओं के नाम निम्न हैं-
(i) पीतल (Brass) – इसका उपयोग तरह-तरह के बर्तन बनाने में किया जाता है तथा नलियाँ एक कारतूस बनाने में भी इसका उपयोग किया जाता है।
(ii) ताँबा (Copper) —इसका उपयोग तमगे (Medals) बनाने में किया जाता है। चूँकि ताँबा (कॉपर) जल के साथ अभिक्रिया नहीं करती है। इसी कारण इसका उपयोग टंकी के निर्माण में किया जाता है।
28. लोहा एवं ताँबा के दो-दो अयस्कों के नाम लिखें।
उत्तर – लोहा के दो अयस्क ये हैं—(i) हेमेटाइट तथा (ii) मैग्नेटाइट।
ताँबा के दो अयस्क ये हैं—(i) कॉपर पाइराइट तथा (ii) मैलेकाइट।
29. धातुकर्म किसे कहते हैं ?
उत्तर – अयस्कों से धातुओं के निष्कर्षण एवं उनके शोधन धातुकर्म में प्रयुक्त होने वाले कुछ मुख्य पद होते हैं जो इस प्रकार –
(i) आधात्री (Gangue or Matrix)
(ii) अयस्क का सांद्रण (Dressing of the ore)
(iii) निस्तापन (Calcination)
(iv) जारण (Roasting)
(v) द्रावक ( Flux )
(vi) धातुमल (Slag)
(vii)प्रगलन (Smelting) |
30. सोडियम धात के निष्कर्षण का सिद्धांत लिखें।
उत्तर – सोडियम धातु के निष्कर्षण का सिद्धांत इस प्रकार हैसोडियम धातु मुख्यत: द्रवित पेट्रोलियम क्लोराइड (NaCl) का वैद्युत अपघटन करके प्राप्त की जाती है। चूँकि सोडियम क्लोराइड का द्रवणांक काफी उच्च (820°C) होता है। अतः इसके द्रवणांक को कम करने के लिये इसमें थोड़ा कैल्सियम क्लोराइड मिश्रित कर दिया जाता है। द्रवित मिश्रण का वैद्युत अपघटन करने पर सोडियम धातु कैथोड पर एवं क्लोरीन गैस ऐनोड पर मुक्त होती है।
NaCl → Na+ + Cl–
द्रवित
Na+ + e → Na (कैथोड पर)
2C– → Cl2 (एनोड पर)
इसमें प्रयुक्त विधि को डाउन की विधि (Down’s Process) कहते हैं। मिश्रण में उपस्थित कैल्सियम क्लोराइड का वैद्युत अपघटन नहीं होता है।
सोडियम धातु प्राप्त करने के लिये सोडियम क्लोराइड के जलीय विलयन का इस्तेमाल नहीं किया जा सकता है। इसका कारण यह है कि इस विलयन का वैद्युत अपघटन करने पर कैथोड पर मुक्त सोडियम विलयन में उपस्थित जल के साथ अभिक्रिया करके सोडियम हाइड्रॉक्साइड बनाता है तथा हाइड्रोजन गैस मुक्त होती है।
2Na + 2H5O → 2NaOH + H2
अतः कैथोड पर सोडियम धातु न मुक्त होकर हाइड्रोजन गैस मुक्त होती है और सोडियम हाइड्रॉक्साइड विलयन में रह जाता है ।
31. किसी औरत ने अपने गंदे एवं पुराने सोना के आभूषणों को स्वच्छ एवं चमकीला बनाने के लिये एक स्वर्णकार को दिया। स्वर्णकार ने उन आभूषणों को एक द्रव में डालकर उन्हें चमकीला बना दिया, किन्तु उन आभूषणों का भार पहले से कम हो गया। क्या आप बतायेंगे कि वह कौन-सा द्रव था तथा ऐसा क्यों हुआ ?
उत्तर – स्वर्णकार द्वारा प्रयोग किया गया विलयन एक्वारीजिया है। एक्वारीजिया विलयन में तनु हाइड्रोक्लोरिक अम्ल एवं 3 : 1 के अनुपात में होता है। सोना एक्वारीजिया में घुलनशील है। इसलिये औरत के आभूषणों का भार पहले से कम हो गया।
32. ऐलुमिनोथर्मिक विधि क्या है?
उत्तर – कुछ धातुओं के ऑक्साइड Cr2O3, MnO2 इत्यादि कार्बन द्वारा अवकृत नहीं किए जा सकते हैं, क्योंकि कार्बन के साथ उच्च ताप पर ये कार्बाइड बनाते है। ऐसी स्थिति में अवकरण की क्रिया एलुमिनियम धातु द्वारा कराई जाती है। इसी प्रक्रिया को एलुमिनोथर्मिक विधि कहते हैं।
Cr2O3 + 2Al → 2Cr + 2Al2O2
33. पीतल एवं काँसे के अवयव तत्त्व बतायें।
उत्तर – पीतल एवं काँसे मिश्रधातु हैं, इसके अवयवी तत्त्व निम्न हैं-
पीतल – Cu– 80%, Zn – 20%
काँसे – Cu – 90%, Sn – 10%
34. दो ऐसी धातुओं के नाम लिखे जो ठण्डे जल से अति तीव्र अभिक्रिया करती हैं। ऐसी किसी धातु को जल में डालने पर अवलोकित कोई तीन प्रेक्षण लिखें | यदि अभिक्रिया में, कोई गैस उत्पन्न होती है तो आप उसकी पहचान कैसे करेंगे ?
उत्तर – सोडियम और पोटैशियम ऐसी धातुयें हैं जो ठण्डे जल में अति तीव्र अभिक्रिया करते हैं।
ठण्डे जल के साथ अभिक्रिया– सोडियम, पोटैशियम एवं कैल्सियम धातुयें ठण्डे जल के साथ ही अभिक्रिया करती हैं।
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
(i) पोटैशियम एवं सोडियम की अभिक्रिया के फलस्वरूप इतनी ऊष्मा उत्पन्न होती है कि उत्पन्न हाइड्रोजन गैस में तरंत आग पकड़ लेती है
(ii) कैल्सियम के साथ अभिक्रिया अपेक्षाकृत कम तीव्रता से होती है। इससे उत्पन्न ऊष्णा इतनी कम होती है कि कैल्सियम में आग नहीं पकड़ती, किन्तु कैल्सियम को जल में डालने पर वह तैरने लगती है; क्योंकि मुक्त हाइड्रोजन (H2) गैस कैल्सियम की सतह को आच्छादित कर लेती है
(iii) पोटैशियम की जल के साथ अभिक्रिया सोडियम की अपेक्षा अधिक तेज़ी से होती है। अतः पोटैशियम सोडियम की तुलना में अधिक क्रियाशील है। किन्तु सोडियम कैल्सियम की अपेक्षा अधिक तेजी से अभिक्रिया करता है। अतः सोडियम कैल्सियम की तुलना में अधिक क्रियाशील है।
धातुएँ जो ठण्डे जल के साथ अभिक्रिया करती हैं उन अभिक्रियाओं के हर स्थिति में हाइड्रोजन (H2) गैस मुक्त होती है। इन अभिक्रियाओं से उत्पन्न गैस हाइड्रोजन अलग होती है। उसमें तुरन्त आग पकड़ लेती है ।
दीर्घ उत्तरीय प्रश्न
1. इलेक्ट्रॉनिक विन्यास के आधार पर तत्त्वों को धातु एवं अधातु में किस प्रकार वर्गीकृत किया जाता है ? सोदाहरण समझायें।
उत्तर – इलेक्ट्रॉनिक विन्यास के आधार पर तत्त्वों का धातु और अधातु में वर्गीकरणमें धातु के परमाणु की बाह्यतम कक्षा में साधारणतः 1, 2 और 3 इलेक्ट्रॉन रहते हैं। ये प्रकृति में धनात्मक होती हैं। उदाहरण के तौर पर सोडियम, मैग्नीशियम तथा ऐलुमीनियम इत्यादि ।
अधातुओं के परमाणु के बाह्यतम कक्षा रिक्त होती है। ये साधारणतः इलेक्ट्रॉन को धातुओं से ग्रहण कर अपना अष्टक पूरा करती हैं। उदाहरण के तौर पर कार्बन, सल्फर, ऑक्सीजन इत्यादि ।
2. कारण सहित बतायें कि धातुयें विद्युत की सुचालक और अधातुयें विद्युत की कुचालक क्यों होती हैं ?
उत्तर – धातुओं के ऊष्मा एवं विद्युत का सुचालक होने का कारण यह है कि परमाणुओं में मुक्त इलेक्ट्रॉन रहते हैं जो विद्युत धारा का संचलन करते हैं, कॉपर एवं सिल्वर की गणना सर्वोत्तम विद्युत चालकों में होती है। इसके बाद सोना, ऐल्युमीनियम और टंगस्टन का स्थान आता है। आयरन एवं मरकरी (पारा) विद्युत प्रवाह में अपेक्षाकृत अधिक बाधक होते हैं।
अधातुओं के कुचालक होने का कारण यह है कि इसके द्रवणांक और क्वथनांक हैं। इसी कारण ऊष्मा एवं विद्युत का संचलन प्रायः इसमें नहीं होता है जबकि ग्रेफाइट का द्रवणांक उच्च होता है। इसलिये यह विद्युत की सुचालक होती है।
3. धातुओं के किन्हीं तीन गुणों का उल्लेख करें।
उत्तर – धातुओं को मुख्यतः दो गुणों के आधार पर वर्गीकृत किया जाता है — (a) भौतिक गुण तथा (b) रासायनिक गुण ।
(a) भौतिक गुण-धातुओं के तीन भौतिक गुण निम्न हैं —
(i) इलेक्ट्रॉनिक विन्यास धातुओं के परमाणु की बाह्यतम कक्षा में साधारणतः 1, 2 या 3 इलेक्ट्रॉन रहते हैं। उदाहरण के लिये, सोडियम, मैग्नीशियम एवं ऐल्युमीनियम के इलेक्ट्रॉन क्रमशः 2, 8, 1 ; 2, 8, 2 तथा 2, 8, 3 होते हैं। इन तत्त्वों की बाह्यतम कक्षा में क्रमशः 1, 2 और 3 इलेक्ट्रॉन हैं। इसलिये ये तत्त्व धातु हैं। यद्यपि हाइड्रोजन (H) और हीलियम (He) की बाह्यतम कक्षाओं में क्रमशः 1 और 2 इलेक्ट्रॉन हैं, फिर भी ये तत्त्व अधातु हैं।
(ii) विद्युत धनात्मक गुण-धातुयें विद्युत धनात्मक होती हैं अर्थात् इन धातुओं के परमाणु अपने संयोजी शेल के इलेक्ट्रॉन को आसानी से त्याग कर धनायन में परिवर्तित हो सकते हैं, ये परमाणु अपना इलेक्ट्रॉन खोकर अपने निकटस्थ अक्रिय गैस की भाँति स्थायी विन्यास प्राप्त कर लेते हैं।

(iii) आघातवर्धनीयता – धातुयें आघातवर्धनीय (Malleable) होती है, अर्थात् इन्हें हथौड़े से पीटकर इनकी चादरें बनायी जा सकती हैं। सोना एवं सिल्वर सर्वाधिक आघातवर्ध्य होते हैं । इसलिये इनके कागज से भी पतले पत्तर बनाये जा सकते हैं।
(b) रासायनिक गुण-धातुओं में धनायन में परिवर्तन हो जाने की प्रकृति होती है, धातुओं के इसी प्रकृति के कारण इनमें कुछ विशिष्ट रासायनिक गुण आ जाते हैं। ये तीन गुण इस प्रकार हैं
(i) ऑक्सीजन के साथ अभिक्रिया -सभी धातुयें ऑक्सीजन के साथ संयोग करके ऑक्साइड बनाती हैं –
4Na + O2 → 2Na2O (सोडियम मोनोक्साइड)
2Mg + O2 → 2MgO (मैग्नीशियम ऑक्साइड)
धातु के ऑक्साइड भास्मिक (basic) होते हैं। कुछ ऑक्साइड जल में घुलकर क्षार बनाते हैं जैसे –
Na2O (s) + H2O (l) → 2NaOH (aq)
K2O (s) + H2O (l) → 2KOH (aq)
CaO (s) + H2O (l) → Ca (OH)2 (aq)
कुछ धातुओं के ऑक्साइड (Al2O3, ZnO आदि) में अम्लीय एवं भास्मिक दोनों प्रकार के गुण रहते हैं। ये द्विधर्मी ऑक्साइड (amphoteric oxides) कहलाते हैं। ये अम्ल एवं भस्म दोनों के साथ अभिक्रिया करते हैं। उदाहरण के लिये ZnO तनु HCl के साथ अभिक्रिया करके ZnCl2 और H2O बनाता है।
(ii) जल के साथ अभिक्रिया – विभिन्न धातुओं की जल के साथ अभिक्रिया भिन्न-भिन्न वेग से होती है। कुछ धातुयें ठण्डे जल के साथ ही अभिक्रिया कर लेती हैं। कुछ धातुओं को जल के साथ गर्म करने पर अभिक्रिया होती है, जबकि कुछ धातुयें भाप के साथ अभिक्रिया करती हैं, किन्तु हर स्थिति में H2 गैस मुक्त होती है, एवं इन धातुओं के ऑक्साइड हाइड्रॉक्पाइड बनते हैं।
उदाहरण के लिये सोडियम, पोटैशियम एवं कैल्सियम धातुयें ठण्डे जल के साथ ही अभिक्रिया करती हैं –
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca (OH)2 + H2 ↑
(iii) अम्लों के साथ अभिक्रिया – धातुयें प्राय: अम्लों के साथ अभिक्रिया करके अम्लों से हाइड्रोजन मुक्त करती हैं। अम्लों के साथ धातु की अभिक्रिया का वेग धातु के विद्युत धनात्मक गुण या उसकी क्रियाशीलता पर निर्भर करता है। अधिक विद्युत धनात्मक धातु कम विद्युत धनात्मक धातु की अपेक्षा साथ तेजी से अभिक्रिया करती है।
उदाहरण के लिये, सोडियम धातु तनु हाइड्रोक्लोरिक अम्ल के साथ तीव्रता से अभिक्रिया करके सोडियम क्लोराइड बनाती है तथा हाइड्रोजन गैस मुक्त होती है।
2Na + 2HCl → 2NaCl + H2 ↑
4. अधातुओं के किन्हीं तीन गुणों का उल्लेख करें।
उत्तर – धातुओं की तरह ही अधातुओं को भी मुख्यतः दो गुणों के आधार पर बाँटा जाता है — (a) भौतिक गुण तथा (b) रासायनिक गुण ।
(a) भौतिक गुण– अधातुओं के तीन भौतिक गुण निम्न हैं—
(i) भौतिक अवस्था – अधातुयें सामान्य ताप पर पदार्थ की तीनों अवस्थाओं (ठोस, द्रव एवं गैस के रूप) में पायी जाती हैं। उदाहरण के लिये; कार्बन, सल्फर, फॉस्फोरस, आयोडीन ठोस रूप में ब्रोमीन द्रव की अवस्था में जबकि हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, क्लोरीन आदि गैसीय अवस्था में रहते हैं।
(ii) भंगुरता– अधातुयें प्राय: भंगुर (brittle) होती हैं जिनसे चादरें (foils) एवं तार बनाये जा सकते हैं। अतः इनमें आघातवर्धनीयता (malleability) और तन्यता (ductility) नहीं होती है। इन्हें हथौड़े से पीटने पर या खींचने पर चूर-चूर हो जाती है।
(iii) ऊष्मा एवं विद्युत चालकता – अधातुएँ प्रायः ऊष्मा एवं विद्युत की कुचालक होती हैं। सिर्फ ग्रेफाइट विद्युत का सुचालक होता है।
(b) रासायनिक गुण– अधातुओं के तीन रासायनिक गुण इस प्रकार हैं –
(i) ऑक्सीजन के साथ अभिक्रिया – अधातुएँ ऑक्सीजन के साथ संयोग करके अम्लीय ऑक्साइड बनाती हैं, ये ऑक्साइड जल में घुलकर अम्ल बनाते हैं

(ii) क्लोरीन के साथ अभिक्रिया– अधातुयें क्लोरीन के साथ अभिक्रिया करके क्लोराइड बनाती हैं। उदाहरण के लिये, फॉस्फोरस की अभिक्रिया क्लोरीन के साथ कराने पर फॉस्फोरस ट्राइक्लोराइड बनता है।
P4 + 6Cl2 → 4PCl3
उसी प्रकार हाइड्रोजन की अभिक्रिया क्लोरीन से कराने पर हाइड्रोजन क्लोराइड बनता है।
H2 + Cl2 → 2HCl
(iii) हाइड्रोजन के साथ अभिक्रिया- अधातुयें हाइड्रोजन के साथ संयोग करके हाइड्राइड का निर्माण करती हैं।
H2 + S → H2S
हाइड्रोजन सल्फाइड
N2 +3H2 → 2NH3
अमोनिया
5. जस्ता कॉपर सल्फेट के विलयन से ताँबा को विस्थापित कर देता है, किन्तु ताँबा जिंक सल्फेट के विलयन से जस्ता को विस्थापित नहीं कर सकता, क्यों ?
उत्तर – क्रियाशील धातुयें अपने से कम क्रियाशील धातु के लवण के विलयन से कम क्रियाशील धातु को विस्थापित कर देती है।
जब जिंक धातु के एक टुकड़े को कॉपर सल्फेट के विलयन में डालते हैं तो कॉपर सल्फेट विलयन का नीला रंग धीरे-धीरे गायब होने लगता है और कॉपर धातु की लाल परत जिंक धातु पर जम जाती है।
Zn + CuSO4 → ZnSO4 + Cu ↓
जिंक कॉपर सल्फेट जिंक सल्फेट कॉपर
धातु अधिक क्रियाशील होने के कारण विलयन से कॉपर धातु को विस्थापित कर देती है।
ताँबा (कॉपर) बेहद कम क्रियाशील धातु है। जो जिंक सल्फेट के विलयन से जस्ता को विस्थापित नहीं कर सकता है। अतः कहा जा सकता है कि जस्ता कॉपर सल्फेट के विलयन से ताँबा को विस्थापित कर देती है, जबकि ताँबा जिंक सल्फेट के विलयन से जस्ता को विस्थापित नहीं कर सकता है।
6. द्विधर्मी ऑक्साइड क्या है ? द्विधर्मी ऑक्साइडों को दो उदाहरण दें।
उत्तर – कुछ धातुओं के ऑक्साइड में अम्लीय एवं भास्मिक या क्षारीय दोनों प्रकार के गुण रहते हैं। ये द्विधर्मी ऑक्साइड (amphoteric oxides) कहलाते हैं। ये अम्ल एवं भस्म दोनों के साथ अभिक्रिया करते हैं। उदाहरण के लिये ऐल्युमीनियम ऑक्साइड (Al2O3) तथा जिंक ऑक्साइड (ZnO) दोनों द्विधर्मी ऑक्साइड हैं।
7. भौतिक व रासायनिक गुणों के आधार पर धातु एवं अधातु में अन्तर स्पष्ट करें।
उत्तर – भौतिक व रासायनिक गुणों के आधार पर धातु एवं अधातु में अन्तर इस प्रकार किया जा सकता है –
भौतिक गुणों के आधार पर धातु एवं अधातु में बिभेद –
| धातुएँ (Metals) | अधातुएँ (Non-Metals) |
| 1. धातुएँ सामान्य ताप पर ठोस होती हैं परंतु केवल पारा सामान्य ताप पर तरल अवस्था में होता है। | 1. अधातुएँ सामान्य ताप पर तीनों अवस्थाओं में पाई जाती हैं। फॉस्फोरस और सल्फर ठोस रूप में, H2, O2, N2 गैसीय रूप में तथा ब्रोमीन तरल रूप में होती हैं। |
| 2. धातुएँ तन्य तथा आघातवर्ध्य, तथा लगिष्णु होती हैं। | 2. ये प्राय: भंगुर होती हैं। |
| 3. धातुएँ प्राय: चमकदार होती हैं अर्थात् उनमें धात्विक चमक होती है। | 3. अधातुओं में धात्विक चमक नहीं होती परंतु हीरा, ग्रेफाइट तथा आयोडीन इसके अपवाद है। |
| 4. धातुएँ ऊष्मा तथा विद्युत् की सुचालक होती हैं परंतु बिस्मथ इसका अपवाद है। | 4. ग्रेफाइट और गैस कार्बन को छोड़कर सभी अधातुएँ कुचालक हैं। |
| 5. धातुओं के गलनांक तथा क्वथनांक बहुत अधिक होते हैं। | 5. अधातुओं के गलनांक तथा क्वथनांक कम होते हैं। |
| 6. धातुएँ अधिकांशतः कठोर होती हैं परंतु सोडियम तथा पोटाशियम चाकू से काटी जा सकती है। | 6. इनकी कठोरता भिन्न-भिन्न होती है। हीरा सब पदार्थों से कठोरतम है। |
| 7. धातुओं का आपेक्षिक घनत्व अधिक होता है परंतु Na, K इसके अपवाद हैं। | 7. अधातुओं का आपेक्षिक घनत्व प्रायः कम होता है। |
| 8. धातुएँ अपारदर्शक होती हैं। | 8. गैसीय अधातुएँ पारदर्शक हैं। |
रासायनिक गुणों के आधार पर धातु एवं अधातु में विभेद
| धातुएँ (Metals) | अधातुएँ (Non-Metals) |
| 1. धातुएँ क्षारीय ऑक्साइड बनाती हैं जिसमें से कुछ क्षार बनाती हैं। | 1. अधातुएँ अम्लीय तथा उदासीन ऑक्साइड बनाती हैं। |
| 2. धातुएँ अम्लों से अभिक्रिया करके हाइड्रोजन गैस पुनः स्थापित करती हैं तथा अनुरूप लवण बनाती हैं। | 2. अधातुएँ अम्लों में से हाइड्रोजन गैस को पुनः स्थापित नहीं करती हैं। |
| 3. धातुएँ धनात्मक आवेश की प्रकृति की होती हैं। | 3. अधातुएँ ऋणात्मक आवेश की प्रकृति की होती हैं। |
| 4. धातुएँ क्लोरीन से संयोग करके क्लोराइड बनाती हैं जो वैद्युत संयोजक होते हैं। | 4. अधातुएँ क्लोरीन से संयोग कर क्लोराइड बनाती हैं, परंतु वे सहसंयोजक होते हैं। |
| 5. कुछ धातुएँ हाइड्रोजन से संयोग करके हाइड्रोक्साइड बनाती हैं जो विद्युत संयोजक होते हैं। | 5. अधातुएँ हाइड्रोजन के साथ अनेक स्थायी हाइड्राइड बनाती हैं जो सहसंयोजक होते हैं। |
| 6. धातुएँ अपचायक हैं। | 6. अधातुएँ ऑक्सीकारक हैं। |
| 7. धातुएँ जलीय विलयन में धनायन बनाती हैं। | 7. अधातुएँ जलीय विलयन में ऋणायन बनाती हैं। |
8. वैद्युत अपघटन विधि से धातु का शोधन किस प्रकार किया जाता है ?
उत्तर – वैद्युत अपघटन विधि द्वारा धातु का शोधन- इस विधि द्वारा ताँबा (कॉपर), जिंक, टिन, निकेल, सिल्वर, गोल्ड, ऐल्युमिनियम आदि धातुओं को शुद्ध रूप में प्राप्त किया जाता है।
इसमें अशुद्ध धातु को ऐनोड एवं शुद्ध धातु की प्लेट को कैथोड के रूप में इस्तेमाल किया जाता है। धातु के एक लवण का विलयन वैद्युत अपघट्य का कार्य करता है। विद्युत धारा प्रवाहित करने पर ऐनोड से शुद्ध धातु निकलकर विलयन में आती है और विलयन में से उतनी ही शुद्ध धातु कैथोड पर एकत्रित हो जाती है। विलेय अपद्रव्य विलयन में चले जाते हैं, जबकि अविलेय अपद्रव्य ऐनोड़ के नीचे पेंदी में एकत्र हो जाते हैं जो “ऐनोड मड” कहलाते हैं।

9. वैसे किन्हीं तीन अधातुई ऑक्साइडों के नाम लिखें जो अम्लीय होते हैं, जल के साथ ऑक्साइडों की अभिक्रिया कैसे होती है ?
उत्तर – (i) कार्बोनिक अम्ल (H2CO3), (ii) सल्फ्यूरस अम्ल (H2SO3) तथा (iii) सल्फ्यूरिक अम्ल (H2SO4) ऐसे तीन अधातुई ऑक्साइड हैं जो अम्लीय होते हैं ।
अधातुयें ऑक्सीजन के साथ संयोग करके अम्लीय ऑक्साइड बनाती हैं। ये ऑक्साइड जल में घुलकर अम्ल बनाते हैं।
C + O2 → CO2
कार्बन डाइऑक्साइड
H2O + CO2 → H2CO3
कार्बोनिक अम्ल
10. अयस्कों के सांद्रण से क्या समझते हैं ? सल्फाइड अयस्क का सांद्रण आप किस विधि द्वारा करेंगे ?
उत्तर – अयस्क का सांद्रण (Dressing of the ore) अयस्क में विद्यमान अपद्रव्यों को दूर करना अयस्क का सांद्रण कहलाता है।
सल्फाइड अयस्क के सांद्रण के लिये फेन उत्प्लावन विधि का प्रयोग किया जा सकता है-
प्रयोग – सल्फाइड अयस्क के भारी चूर्ण को जल से भरी एक टैंक (Tank) में डालते हैं । इसके बाद जल में थोड़ा तेल (Oil) डालकर वायु प्रवाह द्वारा जल को खूब आलोडित ( हिलाया) किया जाता है, विलेय अपद्रव्य जल में घुल जाते हैं और सल्फाइड अयस्क के हल्के कण फेन के साथ जल की सतह के ऊपर आ जाते हैं जिन्हें अलग कर लिया जाता है। फेन (झाग) को समाप्त करने के लिये उसमें थोड़ा अम्ल मिलाया जाता है। फिर सल्फाइड अयस्क को छानकर सुखा (dry) लेते हैं।

11. अयस्कों के निस्तापन एवं जारण से क्या समझते हैं ? इनमें अन्तर स्पष्ट करें।
उत्तर – अयस्कों का निस्तापन निस्तापन की प्रक्रिया में अयस्क को वायु की अनुपस्थिति में उसके द्रवणांक से कम ताप पर तीव्रता से गर्म किया जाता है।
उदाहरण –(i) ऑक्साइड अयस्क को गर्म करने पर उसमें उपस्थित जलवाष्प एवं वाष्पशील अपद्रव्य बाहर निकल जाते हैं।
Al2O3 · 2H2O → Al2O3 + 2H2O
(ii) कार्बोनेट अयस्क को गर्म करने पर वह धातु के ऑक्साइड में परिवर्तित हो जाता है।
CaCO3 → CaO + CO2
CaCO3 + MgCO3 → CaO + MgO + 2CO2
ZnCO3 → ZnO + CO2
कैलेमीन अयस्क
CuCO3 · Cu(OH)2 → 2CuO + H2O + CO2
अयस्कों का जारण – जारण प्रक्रिया में सांद्रित अयस्क को पर्याप्त वायु की आपूर्ति में अयस्क के द्रवणांक से कम ताप पर तीव्रता से गर्म करते हैं। इससे उसमें विद्यमान आर्सेनिक तथा अन्य अपद्रव्य ऑक्सीकृत होकर वाष्प रूप में बाहर निकल जाते हैं तथा धातु ऑक्साइड के रूप में परिवर्तित हो जाती है।
उदाहरण- (i) जिंक ब्लेंड (ZnS) जारित होकर ZnO में बदल जाता है।
2ZnS + 3O2 → 2ZnO + 2SO2
(ii) गैलेना (PbS) जारित होकर लिथार्ज (PbO) में परिणत हो जाता है।
2PbS + 3O2 → 2PbO + 2SO2
(iii) सिनेबार (HgS) का जारण करने पर वह सीधे मरकरी (पारा) में बदल जाता है।
HgS + O2 →Hg + SO2
(iv) आइरन पाइराइट (FeS2) का जारण करनेपर वह फेरिक ऑक्साइड (Fe2O3) में0परिवर्तित हो जाता है।
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
अंतः कहा जा सकता है कि निस्तापन एवं जारण दोनों प्रक्रियाओं द्वारा धातु का ऑक्साइड ही प्राप्त होता है। किन्तु फिर भी इन दोनों प्रक्रियाओं में कुछ भिन्नता है, जो ये हैं –
| निस्तापन | जारण |
| 1. इस प्रक्रिया में अयस्क को वायु की अनुपस्थिति में गर्म किया जाता है। | 1. इस प्रक्रिया में अयस्क को वायु की उपस्थिति में गर्म किया जाता है। |
| 2. यह ऑक्साइड एवं कार्बोनट अयस्कों के लिये प्रयुक्त होती है। | 2. यह सल्फाइड अयस्कों के लिये प्रयुक्त होती है। |
12. कारण बतायें—
(i) सोना एवं चाँदी का उपयोग आभूषणों के निर्माण में किया जाता है।
(ii) सोडियम धातु को किरोसिन में डुबाकर रखा जाता है।
(iii) ऐल्युमीनियम के अतिक्रियाशील होने के बावजूद इसका उपयोग घरेलू बरतन बनाने में किया जाता है।
(iv) मलिन पड़े ताँबा के रतनों को नींबू या इमली के रस से साफ किया जाता है ।
उत्तर – (i) सोनी एवं चाँदी के अग्रलिखित गुणधर्मों के के लिए किया जाता है— (a) तन्यता, (b) आघातवर्ध्यता, (c) जंग के प्रति सुरक्षित।
(ii) सोडियम अत्यधिक अभिक्रियाशील होती है। यह वातावरण में पाई जानेवाली ऑक्सीजन के साथ मिलकर अपना-अपना ऑक्साइड बनाते हैं तथा जल के संपर्क में आने पर जल जाता है। इसलिए इसे बचाने के लिए किरोसिन तेल में डुबोकर रखा जाता है।
(iii) ऐल्युमीनियम एक शक्तिशाली एवं सस्ता धातु हैं। यह ताप का सुचालक है। परंतु यह अत्यधिक अभिक्रियाशील है। आर्द्र वायु के संपर्क में आने पर इसकी सतह पर जानेवाली ऐल्युमीनियम ऑक्साइड (Al2O3) की परत चढ़ जाती है। यह परत आर्द्र वायु को क्रियाशील धातु के संपर्क में नहीं आने देती और धातु को जंग लगने से बचाती है। इन सभी कारणों से ऐलुमीनियम का प्रयोग खाना बनाने के बर्तन बनाने में किया जाता है।
(iv) ताँबा ऑक्साइड अम्लों में अभिक्रिया करता है, किन्तु ताँबा स्वयं अभिक्रिया नहीं करता। अतः ताँबे को अम्लीय पदार्थों यानी नींबू या इमली के रस से साफ किया जा सकता है ये ताँबे में संक्षारित हिस्सों (कॉपर ऑक्साइड) को अलग कर देता है तथा शुद्ध रह जाता है।
13. रासायनिक बंधन किसे कहते हैं ? यह कितने प्रकार का बाचा रासायनिक संयोग
उत्तर – रासायनिक बंधन या होने से अणु का निर्माण होता है। परमाणु एक बल से आपस में बँधे होते हैं, जो रासायनिक बंधन कहलाता है। अतः वह रासायनिक बल जो किसी अणु में परमाणुओं को एक साथ बाँध कर रखता है। रासायनिक बंधन कहलाता है।
रासायनिक बंधन के प्रकार (1) वैद्युत संयोजक बंधन या आयनिक बंधन (2) सहसंयोजक बंधन।
1. वैद्युत संयोजन बंधन दो परमाणुओं के बीच एक परमाणु से दूसरे परमाणु में एक या अधिक इलेक्ट्रॉनों के स्थानान्तरण के फलस्वरूप जो रासायनिक बंधन बनता है। उसे वैद्युत संयोजक बंधन या आयनिक बंधन कहते हैं। इसे ध्रुवीय बंधन भी कहते हैं ।

विपरीत आवेश वाले Na+ और Cl आयन स्थिर वैद्युत आकर्षण बल द्वारा एक दूसरे के साथ जुड़कर Na+Cl– बनाते हैं।
2. सहसंयोजक बंधन— जब दो परमाणु आपस में इलेक्ट्रानों का साझा करके अपना अष्टक पूरा करते हैं, तब उनके बीच बना हुआ रासायनिक बंधन सहसंयोजक बंधन कहलाता है।
यह तीन प्रकार का होता है—
(i) एकल सहसंयोजक बंधन
(ii) द्विक सहसंयोजक बंधन
(iii) त्रिक सहसंयोजक बंधन
उदाहरण-(i) एकल बंधन— H2 → H, + H. → H : H → H – H

14. वैद्युत संयोजक बंधन क्या है और यह कैसे बनता है ?
उत्तर – वैद्युत संयोजक बंधन – दो परमाणुओं के बीच एक परमाणु से दूसरे परमाणु में एक या अधिक इलेक्ट्रॉनों के स्थानांतरण के फलस्वरूप बने रासायनिक बंधन को वैद्युत संयोजक बंधन या आयनिक बंधन कहते हैं। इसे ध्रुवीय बंधन भी कहते हैं।
इस प्रकार के बंधन में एक परमाणु से दूसरे परमाणु में एक या अधिक इलेक्ट्रॉनों का स्थानांतरण होता है। एक परमाणु अपना, अतिरिक्त इलेक्ट्रॉन दूसरे परमाणु को प्रदान करता है जिससे दोनों परमाणुओं के इलेक्ट्रॉनिक विन्यास उनके निकटतम उत्कृष्ट गैस के इलेक्ट्रॉनिक विन्यास की तरह ही स्थायी हो जाते हैं। जो परमाणु इलेक्ट्रॉन प्रदान करता है। उसपर धन आवेश और जो परमाणु प्रदत्त इलेक्ट्रॉन प्राप्त करता है उसपर ऋण आवेश उत्पन्न हो जाते हैं। धनाविष्ट परमाणु धनायन (cation) और ऋणाविष्ट परमाणु ऋणायन (anion) कहलाता है। विपरीत आवेश वाले ये दोनों आयन स्थिर वैद्युत आकर्षण बल द्वारा परस्पर जुट जाते हैं। इन दोनों परमाणुओं को एक साथ बाँधकर रखनेवाला यह आकर्षण बल वैद्युत संयोजक बंधन या आयनिक बंधन कहलाता है।
वैद्युत संयोजक बंधन का बनना – इसके अंतर्गत हम कैल्सियम ऑक्साइड के बनने का वर्णन करेंगे–
कैल्सियम (Ca) और ऑक्सीजन (O) परमाणु परस्पर संयोग करके कैल्सियम ऑक्साइड (CaO) का निर्माण करते हैं। कैल्सियम और ऑक्सीजन की परमाणु संख्यायें क्रमश: 20 और 8 होती हैं। अतः इनके इलेक्ट्रॉनिक विन्यास इस प्रकार होंगे –
Ca (20) 2, 8, 8, 2
O (8) 2, 6
Ca परमाणु में संयोजी इलेक्ट्रॉनों की संख्या 2 है जबकि O परमाणु में 6 है। जब ये दोनों परमाणु परस्पर संयोग करते हैं तब Ca परमाणु के दोनों संयोजी इलेक्ट्रॉन ऑक्सीजन के संयोजी शेल में चले जाते हैं। अब कैल्सियम और ऑक्सीजन दोनों के बाह्यतम शेल में अष्टक पूरा हो जाता है जिससे वे उत्कृष्ट गैस का इलेक्ट्रॉनिक विन्यास प्राप्त करके स्थायी बन जाते हैं। इस अवस्था में कैल्सियम परमाणु पर दो धन आवेश और ऑक्सीजन परमाणु पर दो ऋण आवेश उत्पन्न हो जाते हैं।

दो विपरीत आवेश वाले Ca2+ और O2- आयन स्थिर वैद्दुत आकर्षण बल द्वारा परस्पर जुरकड़ कैल्सियम ऑक्साइड (Ca2+ O2- या CaO) बनाते हैं।

15. सहसंयोजक बंधन से क्या समझते हैं ? इसके बनने की प्रक्रिया का उल्लेख करें।
उत्तर – सहसंयोजक बंधन – जब दो परमाणु आपस में इलेक्ट्रॉनों का साझा करके अपना अष्टक पूरा करते हैं तब उनके बीच बना हुआ रासायनिक बंधन सहसंयोजक बंधन कहलाता है। जब संयोग करने वाले दोनों परमाणु के पास अपने निकटस्थ उत्कृष्ट गैस के इलेक्ट्रॉनिक विन्यास की अपेक्षा इलेक्ट्रॉनों की कमी हो तब वे दोनों परमाणु आपस में समान संख्या में इलेक्ट्रॉनों का साझा करके अपना अष्टक (Octet) पूरा करते हैं। साझेदारी में शामिल इलेक्ट्रॉन युग्मों पर दोनों परमाणुओं का समान अधिकार रहता है। इस प्रकार ये दोनों परमाणुओं के बीच बना बंधन सहसंयोजक बंधन कहलाता है।
सहसंयोजक बंधन का बननाएकल सहसयोजक सहसंयोजक बंधन के बनने की तीन प्रक्रिया होती है – (i) बंधन (ii) द्विक सहसंयोजक बंधन तथा (iii) त्रिक सहसंयोजक बंधन
(i) एकल सहसंयोजन-बंधन- इसके अन्तर्गत हम क्लोरीन अणु के बनने का वर्णन करेंगे—
क्लोरीन के दो परमाणु परस्पर संयोग कर क्लोरीन अणु (Cl2) बनाते हैं। क्लोरीन की परमाणु संख्या 17 होती है। अतः इसका इलेक्ट्रॉनिक विन्यास 2,8, 7 होता है, क्लोरीन परमाणु को अपने निकटस्थ उत्कृष्ट गैस ऑर्गन का स्थायी विन्यास (2, 8, 8) प्राप्त करने के लिये एक अतिरिक्त इलेक्ट्रॉन की आवश्यकता है, संयोग करने वाले दोनों परमाणु एक-एक इलेक्ट्रॉन का साझा करके अपना अष्टक पूरा करते हैं। ऐसा करके दोनों परमाणु ऑर्गन जैसा स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त कर लेते है –

(ii) द्विक सहसंयोजक बंधन का द्विबंधन – इसके अन्तर्गत हम ऑक्सीजन अणु (O2) के बनने का वर्णन करेंगे –
ऑक्सीजन परमाणु के संयोजी शेल में 6 इलेक्ट्रॉन हैं। अष्टक पूर्ण करने के लिये ऑक्सीजन परमाणु को दो इलेक्ट्रॉन की आवश्यकता है। अतः ऑक्सीजन के दो परमाणु दो-दो इलेक्ट्रॉनों का परस्पर साझा कर स्थायी ऑक्सीजन का निर्माण करते हैं।

(iii) त्रिक सहसंयोजक बंधन या त्रिबंधन– इसके अन्तर्गत हम नाइट्रोजन अणु (N2) के बनने का वर्णन करेंगे –
नाइट्रोजन परमाणु के संयोजी शेल में 5 इलेक्ट्रॉन रहते हैं। अतः नाइट्रोजन के दो परमाणु आपस में तीन-तीन इलेक्ट्रॉनों का साझा करके अपना स्थायी अष्टक पूरा करते हैं-

16. वैद्युत संयोजक यौगिकों की प्रमुख विशेषताओं का उल्लेख करें।
उत्तर – वैद्युत संयोजक या आयनिक यौगिकों की प्रमुख विशेषतायें इस प्रकार हैं—
(i) ये यौगिक धन और ऋण आवेशयुक्त आयनों के बने होते हैं। उदाहरण के लिये, सोडियम क्लोराइड (NaCl) Na+ और Cl– आयनों का बना होता है। ये आयन त्रिआयामी रूप से एक निश्चित क्रम में व्यवस्थित होकर रवा (क्रिस्टल) बनाते हैं।
(ii) इनके द्रवणांक और क्वथनांक उच्च होते हैं। इसका कारण यह है कि धन आयनों एवं ऋण आयनों के बीच मजबूत स्थिर वैद्युत आकर्षण बल कार्य करता है। इस आकर्षण बल को तोड़ने के लिये पर्याप्त ऊष्मा ऊर्जा की आवश्यकता होती है। अतः वैद्युत संयोजक यौगिकों के द्रवणांक और क्वथनांक उच्च होते हैं। इसे एक प्रयोग द्वारा समझा जा सकता है—
प्रयोग – एक स्पैचुला (Spatula) में थोड़ा सोडियम क्लोराइड लें। यह एक सफेद ठोस पदार्थ है। इसे ज्वालक की सहायता से गर्म करें। आप देखेंगे कि सोडियम क्लोराइड नहीं पिघलता है। इससे स्पष्ट होता है कि इसका द्रवणांक काफी उच्च होने के कारण यह आसानी से नहींपिघलता है।
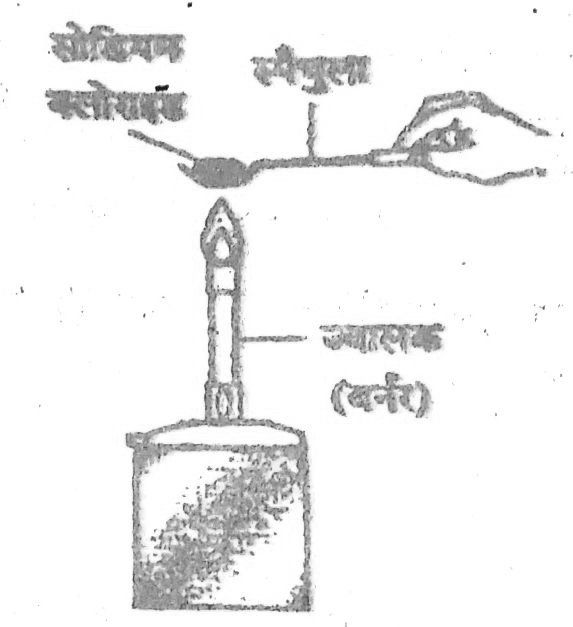
चित्र: सोडियम क्लोराइड पर ताप का प्रभाव
(iii) ये जल में प्रायः विलेय किन्तु बेंजीन, ऐसीटोन, कार्बन डाइसल्फाइड और कार्बन टेट्राक्लोराइड जैसे कार्बनिक विलायकों में अविलेय होते हैं। इसका कारण यह है कि जल के अणु आयनिक यौगिक में विद्यमान आयनों के साथ पारस्परिक क्रिया करते हैं जिससे आयनों के बीच का आकर्षण बल कमजोर होकर टूट जाता है और आयन अलग-अलग हो जाते हैं। परन्तु कार्बनिक विलायकों के साथ ऐसी कोई बात नहीं होती है।
(iv) ये द्रवित या जलीय विलयन की अवस्था में विद्युत के सुचालक होते हैं। ठोस अवस्था में इन यौगिकों के आयन निश्चित स्थानों पर बंधे रहते हैं और ये एक स्थान से दूसरे स्थान में गमन नहीं कर सकते हैं। अत: ठोस की अवस्था में ये यौगिक विद्युत का चालक नहीं होते हैं। परन्तु पिघली हुयी अवस्था में या इनके जलीय विलयन में इनके आयन मुक्त रूप से एक स्थान से दूसरे स्थान में गमन कर सकते हैं। अर्थात् इन अवस्थाओं में ये विद्युत के सुचालक हो जाते हैं। इसे निम्नलिखित प्रयोग द्वारा आसानी से समझा जा सकता है—
प्रयोग – एक छन्ना-पत्र (Filter Paper) लेकर उसे पोटैशियम नाइट्रेट (KNO3) के जलीय विलयन में भिंगोकर ग्रेफाइट की दो छड़ों पर लपेट देते हैं, जैसा कि चित्र में दिखाया गया है। छन्ना-पत्र के मध्य में कॉपर क्रोमेट (CuCrO4) के विलयन की एक बूँद टपका देते हैं। अब ग्रेफाइट की छड़ों में एक बैटरी की सहायता से विद्युत प्रवाहित करते हैं। आप देखेंगे कि नीले रंग के क्यूप्रिक आयन (Cu2+) बैटरी के ऋण ध्रुव की ओर गमन कर रहे हैं जबकि पीले रंग के क्रोमेट आयन (CrO42-) बैटरी के धन ध्रुव की ओर गमन कर रहे हैं।

अतः इस प्रकार निष्कर्ष के रूप में कहा जा सकता है कि वैद्युत संयोजक या आयनिक यौगिकों की कई विशेषतायें हैं।
17. सहसंयोजक यौगिकों की मुख्य विशेषतायें क्या है ?
उत्तर – सहसंयोजक यौगिकों की कई प्रमुख विशेषतायें होती हैं जो इस प्रकार हैं(i) सहसंयोजक यौगिक उदासीन अणुओं द्वारा बने होते हैं, अतः इन अणुओं के बीच विद्यमान आकर्षण बल आयनिक यौगिकों के आयनों के बीच वाले आकर्षण बल की तुलना में काफी कमजोर होते हैं, इसीलिये सहसंयोजक यौगिक में प्रायः वाष्पशील द्रव या गैस होते हैं। किन्तु कुछ सहसंयोजक यौगिक ठोस भी होते हैं। उदाहरण के तौर पर,
द्रव – जल, ऐल्कोहॉल, बेंजीन, कार्बन डाइसल्फाइड, कार्बन टेट्राक्लोराइड आदि ।
गैस – मेथेन, एथेन, एथिलीन, कार्बन डाइऑक्साइड इत्यादि।
ठोस – ग्लूकोज़, यूरिया इत्यादि ।
(ii) सहसंयोजक यौगिकों के द्रवणांक और क्वथनांक प्रायः निम्न (low) होते हैं। इसका कारण यह है कि सहसंयोजक यौगिकों के उदासीन अणुओं के मध्य स्थित अंतराण्विक आकर्षण बल बहुत कमजोर होता है। अतः अणुओं को अलग करने के लिये कम कृपया ऊर्जा की आवश्यकता होती है। इसी कारण सहसंयोजक यौगिकों के द्रवणांक और क्वथनांक प्रायः नि (low) होते हैं। इसे निम्न प्रयोग द्वारा स्पष्ट कर सकते हैं
प्रयोग – एक परखनली में थोड़ी चीनी लेकर परखनली को गर्म करें। चीनी शीघ्र ही द्रवित हो जाती है। चूँकि चीनी एक सहसंयोजक पदार्थ है। अतः यह कम ही ताप पर पिघल जाती है।
(iii) सहसंयोजक यौगिक विद्युत के कुचालक होते हैं। उदाहरण के लिये ग्लूकोज, यूरिया, ऐल्कोहॉल, कार्बन टेट्राक्लोराइड आदि विद्युत के कुचालक होते हैं, इसका कारण यह है कि ये उदासीन अणुओं से बने होते हैं आयनों से नहीं। ये पिघली या जलीय विलयन की अवस्था में आयन उत्पन्न नहीं करते हैं। इसीलिये ये विद्युत के कुचालक होते हैं।
(iv) सहसंयोजक यौगिक जल में प्रायः अविलेय, किन्तु कार्बनिक विलायकों में प्रायः विलेय होते हैं। उदाहरण के तौर पर बेंजीन, कार्बन डाइसल्फाइड, नेफ्थलीन आदि जल में अविलेय होते हैं। किन्तु ग्लूकोज, यूरिया आदि जल में विलेय होते हैं।
अतः इस प्रकार निष्कर्ष रूप में यह कहा जा सकता है कि सहसंयोजक यौगिकों के कई विशेषतायें हैं।
18. परमाणु संख्या 6, 7 और 8 वाले तत्त्वों की संयोजकता एवं उनके इलेक्ट्रॉनिक विन्यास लिखें। इनमें किस प्रकार की संयोजकता है और क्यों ?
उत्तर – परमाणु संख्या 6 का इलेक्ट्रॉनिक विन्यास 2, 4 होता है। परमाणु संख्या 7 का इलेक्ट्रॉनिक विन्यास 2, 5 होता है तथा परमाणु संख्या 8 का इलेक्ट्रॉनिक विन्यास 2,6 होता है। संयोजकता क्रमश: 4, 5, 6 होगी। परमाणु संख्या 6, 7 धनायन संयोजकता है और परमाणु संख्या 8 ऋणायन संयोजकता है।
19. अष्टक नियम क्या है ? एक आयनिक और एक सहसंयोजक यौगिक का उदाहरण देते हुये इस नियम को समझायें।
उत्तर – उत्कृष्ट गैसों के अतिरिक्त जितने भी तत्व हैं उनके परमाणुओं के बाह्यतम शेल (संयोजी शेल) में 8 से कम इलेक्ट्रॉन रहते हैं, अर्थात् इनके संयोजी शेल अपूर्ण होते हैं। इसीलिये इन तत्वों के परमाणु अन्य परमाणुओं से संयोग करके उत्कृष्ट गैसों की भाँति इलेक्ट्रॉनिक विन्यास प्राप्त कर लेने की प्रवृत्ति रखते हैं। इनके परमाणुओं में उत्कृष्ट (अक्रिय) गैसों की भाँति स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त कर लेने की प्रवृत्ति के कारण ही वे रासायनिक दृष्टि से क्रियाशील होते हैं। इन परमाणुओं में अपने इलेक्ट्रॉनों को इस प्रकार से व्यवस्थित करने की प्रवृत्ति होती है कि इनके बाह्यतम शेल में इलेक्टॉनों की संख्या 8 हो जाये । इसे ही अष्टक नियम (Octet rule) त्याग या उन्हें प्राप्त करता है।
आयनिक या वैद्युत संयोजक तथा सहसंयोजक यौगिक के उदाहरण को अष्टक नियम द्वारा इस प्रकार समझा जा सकता है-
आयनिक/वैद्युत संयोजक यौगिक के उदाहरण द्वारा अष्टक नियम का सत्यापन –
इसके अन्तर्गत हम सोडियम मोनोक्साइड (Na2O) के बनने का वर्णन करेंगे-
सोडियम (Na) और ऑक्सीजन (O) परमाणुओं के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं –
Na (11) 2, 8, 1
O (8) 2, 6
Na परमाणु के पास सिर्फ 1 संयोजी इलेक्ट्रॉन है, जबकि परमाणु के पास 6 अत: Na और o के बीच संयोग के क्रम में Na के दो परमाणु अपने संयोजी इलेक्ट्रॉनों को O के पास परमाणु में स्थानांतरित करते हैं, ऐसा करने से Na के दोनों परमाणुओं और O के परमाणु के अष्टक पूर्ण हो जाता है।

अत: Na2O एक आयनिक यौगिक है।
सहसंयोजक यौगिक के उदाहरण द्वारा अष्टक नियम का सत्यापन – सहसंयोजक तीन प्रकार के होते हैं—(i) एकल सहसंयोजक बंधन (ii) द्विक सहसंयोजक बंधन या द्विबंधन। (iii) त्रिक सहसंयोजक बंधन या त्रिबंधन। इसीलिये हम इन तीनों प्रकार के उदाहरणों द्वारा अष्टक नियम को समझेंगे।
(i) एकल सहसंयोजन बंधन- इसके अन्तर्गत हम क्लोरीन अणु के बनने का वर्णन करेंगेक्लोरीन के दो परमाणु परस्पर संयोग कर क्लोरीन अणु (Cl2) बनाते हैं। क्लोरीन की परमाणु संख्या 17 होती है। अत: इसका इलेक्ट्रॉनिक विन्यास 2, 8, 7 होता है, क्लोरीन परमाणु को अपने निकटस्थ उत्कृष्ट गैस ऑर्गेन का स्थायी विन्यास (2, 8, 8) प्राप्त करने के लिये एक अतिरिक्त इलेक्ट्रॉन की आवश्यकता है, संयोग करने वाले दोनों परमाणु एक-एक इलेक्ट्रॉन का साझा करके अपना अष्टक पूरा करते हैं। ऐसा करके दोनों परमाणु ऑर्गन जैसा स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त कर लेते हैं —

(ii) द्विक सहसंयोजक बंधन या द्विबंधन- इसके अन्तर्गत हम ऑक्सीजन अणु (O2)) के बनने का वर्णन करेंगे —
ऑक्सीजन परमाणु के संयोजी शेल में 6 इलेक्ट्रॉन हैं। अष्टक पूर्ण करने के लिये ऑक्सीजन परमाणु को दो इलेक्ट्रॉन की आवश्यकता है। अतः ऑक्सीजन के दो परमाणु दो-दो इलेक्ट्रॉनों का परस्पर साझा कर स्थायी ऑक्सीजन का निर्माण करते हैं।

(iii) त्रिक सहसंयोजक बंधन या त्रिबंधन- इसके अन्तर्गत हम नाइट्रोजन अणु (N2) के बनने का वर्णन करेंगे –
नाइट्रोजन परमाणु के संयोजी शेल में 5 इलेक्ट्रॉन रहते हैं। अतः नाइट्रोजन के दो परमाणु आपस में तीन-तीन इलेक्ट्रॉनों का साझा करके अपना स्थायी अष्टक पूरा करते हैं —
N(7) — 2, 5

20. एक तत्व A ऑक्सीजन में जलकर एक आयोनिक यौगिक AO बनाता है यदि यह तत्व क्लोरिन और गंधक के साथ संयोग करे तब किस प्रकार के यौगिक बनेंगे।
उत्तर – दिया गया है कि

(a) कैल्सियम वह तत्व है जबकि (b), (c) और (d) गलत है।
21. वैद्युत संयोजक यौगिकों के द्रवणांक और क्वथनांक उच्च होते हैं, किन्तु सहसंयोजक यौगिकों के द्रवणांक और क्वथनांक अपेक्षाकृत निम्न होते हैं ? ऐसा क्यों होता है ?
उत्तर – वैद्युत संयोजक या आयनिक यौगिकों के द्रवणांक और क्वथनांक उच्च होते हैं। इसका कारण यह है कि धन आयनों एवं ऋण आयनों के बीच मजबूत स्थिर वैद्युत आकर्षण बल कार्य करता है। इस आकर्षण बल को तोड़ने के लिये पर्याप्त ऊष्मा ऊर्जा की आवश्यकता होती हैं। अतः वैद्युत संयोजक यौगिकों के द्रवणांक और क्वथनांक उच्च होते हैं।
किन्तु दूसरी ओर सहसंयोजक यौगिकों के द्रवणांक और क्वथनांक प्रायः निम्न होते हैं। इसका कारण यह है कि सहसंयोजक यौगिकों के उदासीन अणुओं के बीच स्थित अन्तराण्विक आकर्षण बल बहुत कमजोर होता है। अतः अणुओं को अलग करने के लिये कम ऊष्मा ऊर्जा की आवश्यकता होती है। इसी कारण सहसंयोजक यौगिकों के द्रवणांक और क्वथनांक वैद्युत संयोजक यौगिकों के द्रवणांक और क्वथनांक से अपेक्षाकृत निम्न होते हैं ।
22. पारा धातु का निष्कर्षण कैसे होता है ? इसकी उपयोगिता बताएँ।
उत्तर – पारा या मरकरी (Hg) धातु का निष्कर्षण–पारा का प्रमुख अयस्क सिनेबार (HgS ) है जिससे पारा का निष्कर्षण किया जाता है। सांद्रित सिनेबार अयस्क को चारकोल के साथ गर्म करने पर पारा प्राप्त होता है ।
2HgS + 3O2 → 2HgO + 2SO2 ↑
2HgO → 2Hg + O2 ↑
HgO + C → Hg + CO ↑
पारा के वाष्प CO एवं SO2 के मिश्रण को संघनक से प्रवाहित कर उसे संघनित कर लिया जाता है।
अतः उपर्युक्त विधि द्वारा पारा (Hg) का निष्कर्षण किया जाता है।
23. धातुओं के संक्षारण से आप क्या समझते हैं ? लोहे को जंग से बचाने के लिये क्या उपाय हैं?
उत्तर – धातुओं का संक्षारण धातुओं की सतह पर वायु, नमी, CO2, SO2 अथवा रसायनों आदि के प्रभाव से क्षय होने या नष्ट होने को संक्षारण कहते हैं। लोहे नमी एवं ऑक्सीजन या वायु से अभिक्रिया कर Fe2O का परत बना लेता है। जो भूरे रंग का होता है। यह प्रक्रिया जंग लगना कहलाता है। जंग लोहे को धीरे-धीरे नष्ट कर देता है।
लोहे को जंग (संक्षारण) से बचाने के लिये निम्नलिखित उपाय किये जाते हैं
(i) तेल या ग्रीस की तह जमाकर- यदि लोहे पर तेल या ग्रीस की तह जमा दें तो नम वायु लोहे के संपर्क में नहीं आ पाती जिससे जंग नहीं लगता। मशीनों के पुर्जों पर ऐसा ही किया जाता है।
(ii) एनेमल से– लोहे की सतह पर रंग-रोगन की तह जमाकर जंग लगने पर नियंत्रण पाया जाता है। बसों, कारों, स्कूटर – मोटर साइकिल, खिड़कियों, रेलगाड़ियों आदि पर एनेमल की तह ही जमाई जाती है।
(iii) प्लास्टिक की परत लगाने से— लोहे की सतह को प्लास्टिक से ढांप दिया जाता है। लोहे के फर्नीचर की रक्षा ऐसे ही की जाती है।
(iv) गैलवेनीकरण– लोहे पर जिंक की तह जमाने को गैलवेनीकरण कहते हैं। इस विधि से लोहे की बाल्टियों, टबों, ड्रमों, लोहे की चादरें की जंग से रक्षा की जाती है।
(v) विद्युत लेपन से- निकेल, क्रोमियम, एलुमिनियम आदि धातुओं की तह विद्युत लेपन से लोहे की सतह पर चढ़ा दी जाती है। वाहनों के रिम, हैंडल, बंपर आदि की रक्षा इसी प्रकार की जाती है।
(vi) कलई कर के लोहे पर कलई की तह जमाई जाती है। घी के कनस्तर एवं खाना पैक करने के डिब्बों पर ऐसा ही किया जाता है।
(vii) इस्पात में बदल कर – लोहे को इस्पात में बदल कर जंग से बचाया जाता है।
25. ऐलमिनोथर्मिक विधि क्या है ?
उत्तर – ऐलुमिनोथर्मिक विधि— कुछ धातुओं के ऑक्साइड कार्बन द्वारा अवकृत नहीं हो पाते हैं। इनके लिये ऐलुमिनियम जैसे किसी अधिक क्रियाशील धातु का इस्तेमाल किया जाता है। यह विधि थर्मिट विधि या ऐलुमिनोथर्मिक विधि (Thermite or alumino thermic process) कहलाती है। मैंगनीज (Mn), क्रोमियम (Cr) आदि के ऑक्साइड कार्बन द्वारा अवकृत नहीं किये जा सकते हैं। अतः ऐसे ऑक्साइडों का अवकरण ऐलुमिनियम द्वारा किया जाता है।
3Mn3O4 + 8Al → 4Al2O3 + 9Mn
Cr2O3 + 2Al → Al2O3 + 2Cr
ऐलुमिनोथर्मिक विधि या थर्मिट विधि को एक प्रयोग द्वारा स्पष्ट समझा जा सकता है।
प्रयोग – ऐलुमिनियम के चूर्ण को धातु के ऑक्साइड के साथ मिलाकर मिश्रण तैयार करते क़े हैं। इस मिश्रण में एक जलते हुये मैग्नीशियम का टुकड़ा प्रविष्ट कराकर अभिक्रिया प्रारंभ कराई जाती है। ऐलुमिनियम ऑक्साइड को धातु में परिवर्तित कर देता है। इस अभिक्रिया में इतनी अधिक ऊष्मा उत्पन्न होती है कि धातु पिघली हुयी अवस्था में प्राप्त होती है।
लौह ऑक्साइड की अवस्था में लोहा द्रवित अवस्था में प्राप्त होता है। लौह ऑक्साइड एवं ऐलुमिनियम चूर्ण के मिश्रण को थर्मिट कहते हैं । द्रवित लोहा को दो टुकड़ों के बीच टपकाकर दोनों टुकड़ों को जोड़ा जाता है। किसी मशीन के छिद्रों, रेल की पटरियों में पड़े दरारों आदि को इसी विधि द्वारा जोड़ा जाता है।

26. बॉक्साइट का रासायनिक सूत्र लिखें। इसका शोधन कैसे किया जाता है
उत्तर – बॉक्साइट का रासायनिक सूत्र है – Al2O3 · 2H2O
बॉक्साइट का शोधन (Refining of Bauxite) — पृथ्वी की परत से प्राप्त बॉक्साइट में कई प्रकार के अवांछनीय पदार्थ जैसे—बालू, कंकड़ या मिट्टी के टुकड़े आदि मिश्रित रहते हैं। ये पदार्थ आधात्री कहलाते हैं। इन पदार्थों को धातु के शोधन के पूर्व अयस्क को दूर करना अति आवश्यक होता है।
27. (क) आयनिक और सहसंयोजी यौगिकों में निम्नलिखित गुणों के आधार पर भेद करें।
(i) संघटक तत्वों के बीच क्रियाकारी बलों की दृढ़ता
(ii) यौगिकों की जल में घुलनशीलता
(iii) पदार्थों में वैद्युत चालकता ।
उत्तर – आयनिक और सहसंयोजी यौगिकों में निम्नलिखित गुणों के आधार पर अन्तर या भेद कर सकते हैं –
| गुणों का आधार | आयनिक यौगिक | सहसंयोजी यौगिक |
| (i) संघटक तत्वों के बीच क्रियाकारी बलों की दृढ़ता | इनके धन आयनों एवं ऋण आयनों के बीच मजबूत स्थिर वैद्युत आकर्षण बल कार्य करता है। | इन अणुओं के बीच विद्यमान आकर्षण बल आयनिक यौगिकों के आयनों के बीच वाले आकर्षण बल की तुलना में काफी कमजोर होते हैं। |
| (ii) यौगिकों की जल में घुलनशीलता | ये जल में प्रायः विलेय, किन्तु बेंजीन, क्लोरोफॉर्म आदि कार्बनिक विलायकों में प्रायः अविलेय होते हैं। | ये जल में अविलेय किन्तु कार्बनिक यौगिकों में विलेय होते हैं। |
| (iii) पदार्थों में वैद्युत चालकता | ये ठोस अवस्था में विद्युत के कुचालक, किन्तु द्रवित या जलीय विलयन की अवस्था में विद्युत के सुचालक होते हैं । | ये यौगिक ध्रुवीय सहसंयोजक यौगिकों को छोड़कर विद्युत के कुचालक होते हैं। |
(ख) स्पष्ट करें कि निम्नलिखित धातुयें अपने यौगिकों से अपचयन विधि द्वारा किस प्रकार प्राप्त की जाती है
(i) धातु M जो सक्रियता श्रेणी के मध्य में स्थित है।
(ii) धातु M जो सक्रियता श्रेणी में ऊपर की ओर है। प्रत्येक प्रकार का एक-एक उदाहरण दें।
उत्तर – ये धातुयें अपने यौगिकों से अपचयन विधि द्वारा निम्नलिखित प्रकार से प्राप्त की जा सकती हैं—
(i) धातु M जो सक्रियता श्रेणी के मध्य में स्थित है – सक्रियता श्रेणी के मध्य में स्थित पण इस धातु की अभिक्रियाशीलता मध्यम होती है। प्रकृति में यह प्रायः सल्फाइड या कार्बोनेट के रूप में पायी जाती है। सल्फाइड या कार्बोनेट की तुलना में इस धातु को उसके ऑक्साइड से प्राप्त करना अधिक आसान होता है। उदाहरण के तौर पर
(ii) धातु N जो सक्रियता श्रेणी में ऊपर की ओर है – अभिक्रियाशीलता श्रेणी में सबसे ऊपर धातु N है, जो अत्यन्त अभिक्रियाशील होती है। इस धातु को कार्बन के साथ गर्म कर इसके यौगिक से प्राप्त नहीं किया जा सकता है। उदाहरण के लिये; कार्बन के द्वारा सोडियम, मैग्नीशियम, कैल्सियम, ऐलुमिनियम आदि के ऑक्साइड का अपचयन कर उन्हें धातुओं में परिवर्तित नहीं किया जा सकता है। इस धातु की बंधुता कार्बन की अपेक्षा ऑक्सीजन के प्रति अधिक होती है। इस धातु को विद्युत अपघटनी अपचयन द्वारा प्राप्त किया जा सकता है। उदाहरण के तौर पर सोडियम, मैग्नीशियम एवं कैल्सियम को उनके गलित क्लोराइडों के विद्युत अपघटन से प्राप्त किया जाता है। कैथोड (ऋण आवेशित इलेक्ट्रोड) पर धातुयें निक्षेपित हो जाती हैं तथा ऐनोड (धन आवेशित इलेक्ट्रोड) पर क्लोरीन मुक्त होती है। अभिक्रियायें इस प्रकार हैं –
कैथोड पर Na+ + e– → Na
एनोड पर 2Cl– → Cl2 + 2e–
इसी प्रकार ऐलुमिनियम ऑक्साइड के विद्युत अपघटनी अपचयन से ऐलुमिनियम प्राप्त किया जाता है।
अथवा, (क) ‘भर्जन’ (जारण) और ‘निस्तापन’ में अन्तर लिखें। सल्फाइड अयस्कों के लिये इन दोनों में से किस प्रक्रम का उपयोग होता है और क्यों ?
उत्तर – भर्जन व निस्तापन में निम्नलिखित अंतर है –
| भर्जन | निस्तापन |
| 1. यह विधि सल्फाइड अयस्कों को ऑक्साइड अयस्कों में बदलने के लिए अधिक उपयुक्त है। | यह विधि कार्बोनेट व हाइड्रोक्साइड अयस्कों के सान्द्रण के लिए उपयुक्त है। |
| 2. इस विधि में अयस्क को वायु में गर्म किया जाता है। | इस विधि में अयस्क को वायु की अनुपस्थिति में गर्म किया जाता है। |
सल्फाइड अयस्कों के लिये भर्जन (जारण) के प्रक्रम का उपयोग होता है। इसका कारण यह है कि जारण प्रक्रिया में सांद्रित अयस्क को पर्याप्त वायु की आपूर्ति में सल्फाइड अयस्क के द्रवणांक से कम ताप पर तीव्रता से गर्म करते हैं। इससे उसमें विद्यमान आर्सेनिक तथा अन्य अपद्रव्य ऑक्सीकृत होकर वाष्प-रूप में बाहर निकल जाते हैं तथा धातु ऑक्साइड के रूप में परिवर्तित हो जाती है।
(ख) एक रासायनिक समीकरण द्वारा रेल पटरियों में दरारों को जोड़ने में ऐलुमिनियम के प्रयोग को स्पष्ट करें।
उत्तर – जब आयरन (III) ऑक्साइड तथा ऐलुमिनियम पाउडर (थर्माइट) के मिश्रण को आग लगायी जाती है तो एक बहुत प्रबल अभिक्रिया प्रारंभ हो जाती है। इससे आयरन धातु तथा ऐलुमिनियम ऑक्साइड बनता है। यह अभिक्रिया थर्मिट अभिक्रिया कहलाती है।
Fe2O3 + 2Al → 2Fe + Al2O3 + अत्यधिक ऊष्मा
आयरन (III) पिघला
ऑक्साइड आयरन
इस अभिक्रिया में इतनी अधिक ऊष्मा उत्पन्न होती है कि धातु पिघली हुयी अवस्था में प्राप्त होती है। लौह ऑक्साइड की अवस्था में लोहा द्रवित अवस्था में प्राप्त होता है। (लौह ऑक्साइड एवं ऐलुमिनियम चूर्ण के मिश्रण को थर्मिट कहते हैं।) द्रवित लोहा को दो टुकड़ों के बीच टपकाकर दोनों टुकड़ों को जोड़ा जाता है। रेल की पटरियों में पड़े दरारों को इसी विधि द्वारा जोड़ा जाता है।
(ग) किसी धातु अशुद्ध ताम्बे के विद्युत अपघटनी परिष्करण में आप ऐनोड, कैथोड एवं विद्युत अपघट्य बनायेंगे ?
उत्तर – इस प्रक्रिया में अशुद्ध धातु को ऐनोड बनाया जाता है तथा शुद्ध धातु की एक पतली

पट्टी को कैथोड बनाया जाता है। धात्विक लवण का उपयोग विद्युत अपघट्य के रूप में लिया जाता है। उपकरणों में दिए गए चित्र के ताँबे का विद्युत अपघटनी परिष्करण, अम्लीकृत कॉपर सल्फेट विलयन का विलयन विद्युत अपघट्य है। अशुद्ध ताँबा ऐनोड है जबकि शुद्ध ताँबे की पट्टी कैथोड का कार्य करती है। विद्युत धारा प्रवाहित करने पर शुद्ध ताँबा कैथोड पर निक्षेपित हो जाता है। चित्र के अनुसार व्यवस्थित किया जाता है। विद्युत अपघट्य से विद्युत प्रवाहित करने पर ऐनोड पर स्थित शुद्ध धातु विद्युत अपघट्य में घुल जाता है। शुद्ध धातु की इतनी ही मात्रा कैथोड पर जमा हो जाती है। विलयशील अशुद्धियाँ विलयन में पहुँच जाती हैं जबकि अविलयशील अशुद्धियाँ ऐनोड के नीचे जम जाती हैं जिन्हें ऐनोड पंक कहा जाता है।
28. एक तत्व A के संयोजी सेल में 5 इलेक्ट्रॉन हैं और दूसरे तत्व B के संयोजी सेल में 7 इलेक्ट्रॉन हैं। A और B के संयोग से बनने वाला यौगिक विद्युत का कुचालक है। इस यौगिक में बंधन की प्रकृति बतायें और इसकी इलेक्ट्रॉनिक संरचना लिखें।
उत्तर – A और B के संयोग से बनने वाला यौगिक कार्बन टेट्राक्लोराइड है जो विद्युत का कुचालक है।
यौगिक के बंधन की प्रकृति – एकल सह संयोजक बंधन –

29. प्लास्टर ऑफ पेरिस और जल की परस्पर अभिक्रिया का रासायनिक समीकरण दें।
उत्तर – प्लास्टर ऑफ पेरिस जल के साथ अभिक्रिया कर जिप्सम बनाता है।
(CaSO4)2 H2O + 3H2O → 2CaSO4 + 2H2O
प्लास्टर ऑफ पेरिस जिप्सम
अन्य महत्त्वपूर्ण प्रश्न एवं उनके उत्तर
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर ( क, ख, ग या घ) लिखें।
1. Al2O3 एक ऑक्साइड है –
(क) उभयधर्मी
(ख) अम्लीय
(ग) क्षारीय
(घ) सभी गलत है
उत्तर – (क)
2. सल्फाइड अयस्कों का सान्द्रण किस विधि के द्वारा किया जाता है ?
(क) कार्बन-अवकरण
(ख) फेन उत्प्लवन
(ग) गुरुत्वाकर्षण
(घ) साइनाइड
उत्तर – (ख)
3. ऐलुमिनियम का निष्कर्षण किस विधि के द्वारा किया जाता है ?
(क) कार्बन-अवकरण
(ख) विद्युत अपघटन
(ग) ऐलुमिनोथर्मिक
(घ) साइनाइड
उत्तर – (ख)
4. फिटकरी का व्यवहार पानी शुद्ध करने के लिये किया जाता है, क्योंकि –
(क) इसका जलीय विलयन अम्लीय होता है
(ख) इसका जलीय विलयन क्षारीय होता है
(ग) इसका जलीय विलयन उदासीन होता है
(घ) यह कीटाणुनाशक तथा जलीय (Coagulant) पदार्थ है
उत्तर – (घ)
5. तप्त लोहे पर जलवाष्प की अभिक्रिया से हाइड्रोजन गैस मुक्त होती है और बनता है –
(क) Fe2O3
(ख) Fe3O4
(ग) FeO
(घ) Fe2O2
उत्तर – (ख)
6. लोहे का सबसे महत्त्वपूर्ण अयस्क कौन है ?
(क) लौह पाइराइट
(ख) सिडेराइट
(ग) लाल हेमेटाइट
(घ) मैग्नेटाइट
उत्तर – (ग)
7. फेरस क्लोराइड
(क) हरा लवण है
(ख) भूरा लवण है
(ग) नीला लवण
(घ) रंगीन लवण है
उत्तर – (क)
8. लाल हेमेटाइट से लोहा निष्कर्षण के चरणों में निम्नलिखित में कौन-सा गलत है ?
(क) सान्द्रण
(ख) बिजली द्वारा प्रगलन
(ग) कार्बन द्वारा अपचयन
(घ) धातुमल का पृथक्करण
उत्तर – (ख)
9. एन्टीमनी है—
(क) धातु
(ख) उपधातु
(ग) अधातु
(घ) मिश्रधातु
उत्तर – (ख)
10. भूपर्पटी पर सबसे अधिक पाई जानेवाली धातु है
(क) लोहा
(ख) ऐलुमिनियम
(ग) सोडियम
(घ) कैल्सियम
उत्तर – (ख)
11. सिनेबार किस धातु का अयस्क है
(क) सोना
(ख) ऐलुमिनियम
(ग) पारा
(घ) सोडियम
उत्तर – (ग)
12. स्टेनलेस स्टील –
(क) धातु है
(ख) अधातु है
(ग) उपधातु है
(घ) मिश्रधातु है
उत्तर – (घ)
13. अयस्क में उपस्थित अशुद्धियों को कहा जाता है
(क) आधात्री (गैंग)
(ख) खनिज
(ग) धातुमल
(घ) धातु मिश्रण
उत्तर – (घ)
14. फॉस्फोरस का कौन-सा अपररूप अधिक क्रियाशील हैं ?
(क) बैंगनी
(ख) श्वेत
(ग) लाल
(घ) सिंदूरी
उत्तर – (ख)
15. श्वेत फॉस्फोरस –
(क) प्रकाश में चमकता है
(ख) अंधेरे में चमकता है
(ग) सदा चमकता है
(घ) अज्ञात है
उत्तर – (ख)
16. धोबन सोडा (Washing soda) के एक अणु में जल के अणु होते हैं
(क) सात
(ख) दस
(ग) पाँच
(घ) दो
उत्तर – (ख)
17. इनमें से किस धातु का उपयोग थर्मामीटर में होता है
(क) पारा
(ख) लोहा
(ग) ताँबा
(घ) प्लेटिनम
उत्तर – (क)
18. जर्मन सिल्वर में रहता –
(क) ताँबा
(ख) ताँबा, निकेल, जस्ता
(ग) लेड तथा टिन
(घ) लोहा तथा जिंक
उत्तर –(ख)
19. खानेवाले सोड़ा का व्यवहार होता है
(क) कपड़ा धोने में
(ख) कठोर जल को बनाने में मृदु
(ग) अग्निशामक यंत्र में
(घ) कोई नहीं
उत्तर – (ग)
20. इनमें से किस पदार्थ को साधारणतः पानी के अन्दर रखा जाता है ?
(क) श्वेत फॉस्फोरस
(ख) सिलिकॉन
(ग) ताँबा
(घ) कोई नहीं
उत्तर – (क)
21. साधारण नमक वायु से नमी सोखता है क्योंकि साधारण नमक में रहता है –
(क) MgCl2
(ख) CaCl2
(ग) MgCO2
(घ) Na2CO3
उत्तर – (क)
22. निम्नलिखित में से किसके अपररूप नहीं होते हैं ?
(क) ताँबा
(ख) फॉस्फोरस
(ग) सिलिकॉन
(घ) इनमें से कोई नहीं
उत्तर – (क)
23. इनमें से कौन-सा पदार्थ गर्म करने पर नहीं टूटता है ?
(क) सोडियम कार्बोनेट
(ख) सोडियम बाइकार्बोनेट
(ग) जिप्सम
(घ) इनमें से कोई नहीं
उत्तर – (क)
24. FeO में लोहे की संयोजकता है-
(क) 1
(ख) 3
(ग) 2
(घ) 5
उत्तर – (ग)
25. ऑक्सीजन गैस का अणु सूत्र है –
(क) O
(ख) O2
(ग) O3
(घ) P4
उत्तर – (ख)
26. ड्यूरेलियम है —
(क) लोहे की मिश्रधातु
(ख) ऐलुमिनियम की मिश्रधातु
(ग) जस्ते की मिश्रधातु
(घ) एक धातु
उत्तर – (ख)
27. साधारण ताप पर फॉस्फोरस का अणुसूत्र है –
(क) P
(ख) P2
(ग) P3
(घ) P4
उत्तर – (घ)
28. फॉस्फोरस का कौन-सा रूप जंतु जीवन के लिए घातक है
(क) लाल फॉस्फोरस
(ख) श्वेत फॉस्फोरस
(ग) लाल तथा पीला दोनों
(घ) कोई नहीं
उत्तर – (ख)
II. रिक्त स्थानों की पूर्ति करें।
1. दो अथवा उससे अधिक धातुओं या एक धातु एवं एक अधातु के समांग मिश्रण को …………. कहा जाता है।
उत्तर – मिश्रधात
2. पृथ्वी की परत में सबसे प्रचुर मात्रा में पाई जाने वाली अधातु ………… है।
उत्तर – ऑक्सीजन
3. ………. एक धातु है जो कमरे के तापक्रम पर द्रव है।
उत्तर – पारा
4. ब्यूटी पार्लरों में बालों को विशिष्ट आकार से सेट करने के लिए ………. का उपयोग किया जाता है।
उत्तर – गंधक
5. स्टेनलेस स्टील ………. तथा ………. से बनती है |
उत्तर – क्रोमियम, निकेल
6. जर्मन सिल्वर के अवयव ………… एवं …….. है ।
उत्तर – कॉपर, निकेल, जिंक
7. सल्फाइड अयस्क का सान्द्रण ………. विधि द्वारा होता है।
उत्तर – फेन उत्प्लवन
8. ………… के रूप में विरंजक चूर्ण का उपयोग जल को शुद्ध करने के लिए होता है।
उत्तर – कीटाणुनाशक
9. ………….. वैसे खनिज को कहते हैं जिनसे धातुओं को आसानी से एवं कम खर्च में प्राप्त किया जा सकता है।
उत्तर – अयस्क
10. ऐल्युमिनियम का इलेक्ट्रॉनिक विन्यास ………है।
उत्तर – 2, 8, 3
11. सामान्य ताप पर फॉस्फोरस का अणुसूत्र ………. होता है।
उत्तर – P4
12. ………… लोहे का एक महत्त्वपूर्ण अयस्क है।
उत्तर – हेमेटाइट
13. ……… ऊष्मा का सर्वोत्तम चालक है।
उत्तर – ताँबा
14. धातु के ऑक्साइड …………. होते हैं।
उत्तर – क्षारीय
15. धातु अपना इलेक्ट्रॉन खोकर ………. बनाते हैं।
उत्तर – धनायन
16. नाइट्रिक अम्ल गंधक को ………ऑक्सीकृत कर देता है।
उत्तर – H2SO4 अम्ल
17. अशुद्धि तथा प्रदावक के संयोग से बने यौगिक को ……… कहते हैं।
उत्तर – धातुमल
18. वायुयान बनाने में ……… मिश्रधातु का उपयोग होता है।
उत्तर – ड्यूरेलुमिन
19. सोल्डर ……… तथा ……… की मिश्रधातु है ।
उत्तर – शीशा, टिन
20. ………. फॉस्फोरस अत्यधिक विषैला है।
उत्तर – श्वेत
21. ……… भिन्न होने के कारण लाल फॉस्फोरस, श्वेत फॉस्फोरस से भौतिक एवं रासायनिक गुणों में अन्तर दिखाता है।
उत्तर – परमाणुकता
III. सही / गलत का चयन करें।
1. बॉक्साइट ऐलुमिनियम धातु का अयस्क है।
उत्तर – सही
2. ग्रेफाइट विद्युत का कुचालक होती है।
उत्तर – गलत
3. पीतल मिश्रण धातु है।
उत्तर – सही
4.टंगस्टन को किरोसिन तेल में डुबाकर रखते हैं।
उत्तर – गलत
5.जस्ता का प्रमुख अयस्क जिंक ब्लेंड (ZnS) है।
उत्तर – सही
अतिलघु उत्तरीय प्रश्न
1. एक ऐसी धातु का नाम बताएँ जो कमरे के ताप पर द्रव होती है।
उत्तर – पारा (Hg)
2. ऐसी धातु का उदाहरण दें जो चाकू द्वारा आसानी से काटा जा सकता है।
उत्तर – Na (सोडियम) ।
3. ऐसी धातु का नाम लिखें जो ऊष्मा की सबसे अच्छी चालक होती है।
उत्तर – Ag (सिल्वर ) ।
4. ऐसी धातु का नाम लिखें जो ऊष्मा की कुचालक होती है।
उत्तर – लेड तथा मरकरी ।
5. एक ऐसी धातु का नाम लिखें जो ऊष्मा की अल्पतम चालक होती है।
उत्तर – Pb (लेड ) ।
6. एक ऐसी अधातु का नाम बताएँ जो सामान्य ताप पर द्रव अवस्था में पाई जाती है ।
उत्तर – ब्रोमीन (Br)
7. एक ऐसी अधातु का नाम लिखें जो विद्युत का सुचालक होती है।
उत्तर – ग्रेफाइट।
8. आयरन की भाप के साथ अभिक्रिया का रासायनिक समीकरण लिखें।
उत्तर – 3Fe + 4H2O → Fe3O4 + 4H2
9. जल के साथ कैल्सियम तथा पोटैशियम की अभिक्रिया का समीकरण लिखें।
उत्तर – (i) Ca + 2H2O → Ca(OH)2 + H2
(ii) 2K + 2H2O → 2KOH + H2 + ऊष्मा
10. अभिक्रियाशील धातु को तनु हाइड्रोक्लोरिक अम्ल में डाला जाता है तो कौन-सी गैस निकलती है ? आयरन के साथ तनु H2SO4 की रासायनिक अभिक्रिया लिखें।
उत्तर – हाइड्रोजन गैस ।
Fe + H2OS4 → FeO4 +H2
11. उस धातु का नाम बताएँ जो विद्युत के प्रवाह का तीव्र प्रतिरोध करता है।
उत्तर – पारा।
12. दो ऐसी धातुओं के नाम बताएँ जो सर्वाधिक आघातवर्ध्य तथा तन्य हों।
उत्तर – सोना तथा चाँदी।
13. एक ग्राम सोने से कितनी लम्बी तार खींची जा सकती है ?
उत्तर – 2 किलोमीटर ।
14. उन धातुओं के नाम बताएँ जो हाइड्रोजन के साथ अभिक्रिया करती है।
उत्तर – Na, K, Ca.
15. दो धातुओं का नाम बताएँ जो तनु अम्ल से हाइड्रोजन को विस्थापित नहीं कर सकती है ?
उत्तर – Cu, Au.
16. विद्युतीय परिपथ बनाने में किस धातु का उपयोग किया जाता है ?
उत्तर – ताम्र (Cu).
17. क्या होता है जब कोई धातु किसी तनु अम्ल के साथ अभिक्रिया करती है ?
उत्तर – इस अभिक्रिया में धातु के लवण तथा हाइड्रोजन गैस का निर्माण होता है।
उदाहरण – Zn (s) + 2HCl (aq) → ZnCl2 + H2 (g)
18. धातु एवं हाइड्रोजन के बीच अभिक्रिया को प्रदर्शित करने के लिए समीकरण लिखें।
उत्तर – Ca (s) + H2 (g) → CaH2 (s)
19. ध्वानिक (सोनोरस) किसे कहते है ?
उत्तर – वे धातुएँ जो कठोर सतह से टकराने पर आवाज उत्पन्न करती हैं उन्हें सोनोरस कहते हैं।
20. अपररूप किसे कहते हैं ?
उत्तर – कुछ तत्व कई रूपों में पाये जाते हैं जिनके भौतिक गुणों में तो भिन्नता होती हैं पर रासायनिक गुण समान होते हैं। ये विभिन्न रूप अपररूप तथा यह परिघटना अपररूपता कहलाती है।
21. धातु को उसके ऑक्साइड से प्राप्त करने के लिए किस रासायनिक प्रक्रिया का उपयोग किया जाता है ?
उत्तर – अपचयन की प्रक्रिया।
22. सबसे अधिक अभिक्रियाशील धातु कौन-सी है ?
उत्तर – Li, K.
23. कौन-सी धातु आसानी से संक्षारित नहीं होती है ?
उत्तर – सोना, चाँदी ।
24. कोई धातु ऑक्सीजन के साथ अभिक्रिया कर उच्च गलनांक वाला यौगिक निर्मित करती है। यह यौगिक जल में विलेय है। यह तत्व क्या है ?
उत्तर – कैल्सियम ।
25. सबसे कठोर प्राकृतिक पदार्थ का नाम बताएँ।
उत्तर – पृथ्वी पर पाया जाने वाला सबसे कठोर प्राकृतिक तत्व है, हीरा ।
26. सोडियम धातु को चाकू से भी काटा जा सकता है, क्यों ?
उत्तर – यह मोम जैसा कोमल होता है और इसका द्रवनांक एवं घनत्व कम होता है।
27. लगभग सभी धातुएँ ऑक्सीजन के साथ मिलकर क्या बनाती हैं ?
उत्तर – धातु ऑक्साइड
28. धनाग्रीकरण क्या है ?
उत्तर – ऐलुमिनियम पर मोटी ऑक्साइड परत बनाने की प्रक्रिया है।
29. उपधातु किसे कहते हैं ? उदाहरण सहित समझाइए।
उत्तर – उपधातु वे तत्व हैं जिनमें धातु तथा अधातु दोनों के गुण हैं, जैसे आर्सेनिक (As), एंटीमनी (Sb), बिस्मथ (Bi) |
30. सोने एवं चाँदी को अत्यधिक तापमान पर गर्म करने पर क्या होगा ?
उत्तर – चाँदी तथा सोना अत्यधिक तापमान पर ऑक्सीजन के साथ अभिक्रिया नहीं करते।
31. एक्वारीजिया में मिश्रण का अनुपात बताएँ।
उत्तर – एक्वारीजिया में तीन भाग सांद्र हाइड्रोक्लोरिक अम्ल एवं एक भाग सांद्र नाइट्रिक अम्ल होता है।
32. सोडियम को खुले में क्यों नहीं रख सकते ?
उत्तर – सोडियम वायु के संपर्क में आने पर तेजी से अभिक्रिया करता है। इसलिए इसे खुले में नहीं रखा जाता।
33. नाइट्रोजन के ऑक्साइड के नाम लिखें।
उत्तर – N2O, NO एवं NO2 नाइट्रोजन के तीन ऑक्साइड हैं।
34. Zn, Al, Mg एवं Fe दिए गए धातुओं को घटते अभिक्रियात्मकता क्रम में लगाएँ।
उत्तर – Mg > Al > Zn > Fe.
35. सर्वाधिक कम क्रियाशील धातु को छाँटिए ।
K, Zn, Ca, Au, Ag
उत्तर – Au (सोना) ।
36. Na+ में इलेक्ट्रॉन की संख्या कितनी है ?
उत्तर – 10
37. आयनिक यौगिक कठोर क्यों होते हैं ?
उत्तर – धनात्मक एवं ऋणात्मक आयनों के बीच मजबूत आकर्षण बल के कारण आयनिक यौगिक ठोस एवं थोड़े कठोर होते हैं।
38. K, Ca, Na, Mg स्वतंत्र रूप में नहीं पाए जाते, क्यों ?
उत्तर – K, Ca, Na एवं Mg अत्यंत क्रियाशील धातुएँ हैं। इसलिए यह स्वतंत्र रूप में नहीं पाए जाते।
39. ग्रेफाइट विद्युत् का सुचालक क्यों है ?
उत्तर – ग्रेफाइट के परमाणुओं के मुक्त इलेक्ट्रॉनों के कारण इलेक्ट्रॉनों का सुगम प्रवाह हो जाता है।
40. गालक से क्या अभिप्राय है ?
उत्तर – गालक वे पदार्थ हैं जो अयस्क में उपस्थित अम्लनीय अशुद्धियों को गलनीय पदार्थों में परिवर्तित करते हैं।
41. टाइटेनियम का शुद्धिकरण किस विधि द्वारा किया जाता है ?
उत्तर – वान आरकेल द्वारा विकसित विधि द्वारा।
42. निस्तापन किसे कहते हैं ?
उत्तर – निस्तापन वह प्रक्रम है जिसमें किसी कार्बोनेट अयस्क को वायु की अनुपस्थिति में गर्म किया जाता है।
43. लोहे के निष्कर्षण में चूने का पत्थर क्यों डाला जाता है ?
उत्तर – लोहे के अयस्क में सिलिका (रेत) की अशुद्धि को दूर करने के लिए चूने का पत्थर डाला जाता है।
44. जस्तीकरण से क्या अभिप्राय
उत्तर – लोहे पर जस्ते की एक पतली परत चढ़ाने को जस्तीकरण कहते हैं।
45. लोहे का कौन-सा रूप सबसे शुद्ध है ?
उत्तर – पिटवाँ लोहा सबसे शुद्ध है।
46. सोने के आभूषणों में ताँबा क्यों मिलाया जाता है ?
उत्तर – कठोरता प्रदान करने के लिए ताँबा मिलाया जाता है।
47. कौन-कौन सी धातुएँ एंजाइमों के घटक हैं ?
उत्तर – ताँबा (Cu) तथा जस्ता (Zn) ।
48. स्नायु एवं पेशीय संकुचन की वैद्युत् प्रक्रियाओं में भाग लेने वाली धातुएँ कौन-कौन-सी हैं ?
उत्तर – सोडियम (Na) तथा पोटाशियम (K) |
49. अरक्तता (anaemia) होने पर क्या लेना चाहिए ?
उत्तर – आयरन ।
50. यदि हमारे शरीर में ताँबे की मात्रा बढ़ जाए तो कौन-सा रोग हो जाता है ?
उत्तर – विल्सन रोग।
51. आवर्त सारणी में कुल कितनी अघातुएँ हैं ?
उत्तर – आवर्त सारणी में 22 अधातुएँ हैं।
52. कुल 22 अधातुओं में से कितनी ठोस, तरल तथा गैसीय हैं ?
उत्तर – 22 अधातुओं में से 11 गैसें हैं, एक तरल है तथा शेष 10 ठोस है।
53. तरल अधातु का नाम लिखें।
उत्तर – ब्रोमीन।
54. विद्युत की सुचालक अघातु का नाम लिखें।
उत्तर – ग्रेफाइट।
55. गंधक के अणु किस रूप में पाये जाते हैं ?
उत्तर – गंधक के अणु 8 सदस्यों वाली किसी वलयाकार संरचना के रूप में पाये जाते हैं।
56. रबड़ की कौन-सी वस्तु में गंधक सबसे अधिक होती है ?
उत्तर – रबड़ टायरों में गंधक की मात्रा सबसे अधिक होती है।
57. कोक एक अच्छा ईंधन है फिर भी इसका ईंधन के रूप में प्रयोग कभी-कभार ही किया जाता है, क्यों ?
उत्तर – कोक बहुत अच्छा अपचायक है जिसका धातु निष्कर्षण में प्रयोग किया जा सकता है इसलिए इसका प्रयोग ईंधन के रूप में कभी-कभार किया जाता है।
58. उस प्रक्रिया का नाम लिखें जिसके द्वारा बॉक्साइट शुद्ध एलुमिना में बदला जाता है ?
उत्तर – बेयर विधि।
59. उस धातु का नाम बतायें जो भाप का विघटन कर देता है ?
उत्तर – लोहा।
60. विश्व के सबसे हल्के तत्व का नाम लिखिए।
उत्तर – हाइड्रोजन।
61. सांद्र सल्फ्यूरिक अम्ल की संरचना लिखिए।
उत्तर – 98% सल्फ्यूरिक अम्ल और 2% पानी।
62. तनु सल्फ्यूरिक अम्ल की संरचना क्या होती है ?
उत्तर – 10% सल्फ्यूरिक अम्ल और 90% पानी।
63. कार्बन और सल्फर के साथ सल्फ्यूरिक अम्ल किस प्रकार का व्यवहार करता है ?
उत्तर – ऑक्सीकारक का व्यवहार ।
64. कार बैटरियों को ध्यान से उठाना चाहिए। क्यों ?
उत्तर – कार बैटरियों में सल्फ्यूरिक अम्ल होता है जो वस्त्रों और त्वचा को जला सकता है।
65. सल्फ्यूरिक अम्ल की सहायता से बनने वाले दो उर्वरकों के नाम लिखिए।
उत्तर – अमोनियम सल्फेट, अमोनियम फॉस्फेट।
66. धातुओं के किन्हीं दो गुणों का उल्लेख करें।
उत्तर – धातुओं के दो गुण इस प्रकार हैं—(i) धातुओं के द्रवणांक एवं क्वथनांक प्रायः उच्च होते हैं। (ii) धातुयें ऊष्मा और विद्युत की सुचालक होती हैं।
67. खनिज और अयस्क में क्या अंतर है ?
उत्तर – पृथ्वी तल के नीचे पाए जाने वाले वे प्राकृतिक पदार्थ जिनमें धातु या उनके यौगिक उपस्थित रहते हैं, खनिज कहलाते हैं। वे खनिज पदार्थ जिनसे धातुएँ सस्ती और आसानी से की जा सकता हैं, अयस्क कहलाते हैं।
अतः सभी अयस्क खनिज होते हैं न कि सभी खनिज अयस्क।
68. धातुएँ विद्युत धनात्मक होती हैं, जबकि अधातुएँ विद्युत ऋणात्मक, क्यों ?
उत्तर – धातुओं के परमाणु इलेक्ट्रॉन का त्याग कर धनायन बनाते हैं, इसीलिए धातुएँ विद्युत धनात्मक होती हैं। इसके विपरीत, अधातुओं के परमाणु इलेक्ट्रॉन ग्रहण कर ऋणायन बनाते हैं, के इसीलिए अधातुएँ विद्युत ऋणात्मक होती हैं।
69. अधातुओं के किन्हीं दो गुणों को लिखें।
उत्तर – अधातु के दो गुण इस प्रकार हैं- (i) अधातुओं के द्रवणांक और क्वथनांक प्रायः निम्न होते हैं। (ii) अधातुएँ ऊष्मा और विद्युत की प्रायः कुचालक होती हैं।
70. निस्तापन क्या है ?
उत्तर – निस्तापन वह प्रक्रिया है जिसमें किसी अयस्क को वायु की अनुपस्थिति में कसकर गर्म किया जाता है। ऐसा करने से (i) कार्बोनेट अयस्क धातु के ऑक्साइड में परिवर्तित हो जाता है, (ii) हाइड्रेटेड अयस्कों में से जलवाष्प बनकर निकल जाता है और (iii) अयस्क में उपस्थित वाष्पशील अशुद्धियाँ निकल जाती हैं।
71. जारण से क्या समझते हैं ?
उत्तर – जारण उस प्रक्रिया को कहते हैं जिसमें अयस्क को वायु की अल्प उपस्थिति में कसकर गर्म किया जाता है। ऐसा करने से (i) सल्फाइड धातु के ऑक्साइड में परिवर्तित हो जाता जाती है और (ii) वाष्पशील अशुद्धियाँ निकल अय
72. आधात्री क्या है ?
उत्तर – अयस्क में उपस्थित बालू, पत्थर के टुकड़े, मिट्टी के कण आदि अवांछनीय अशुद्धियाँ आधात्री कहलाती हैं ।
73. धातुकर्म क्या
उत्तर – अयस्कों से धातुओं के निष्कर्षण और उनके शोधन से संबद्ध विभिन्न प्रक्रियाएँ धातुकर्म कहलाती हैं।
74. ब्लीचिंग पाउडर के दो उपयोगों का उल्लेख करें।
उत्तर – रंग नाशक के रूप में । (ii) कीटाणु नाशक के रूप में।
75. खाद्य पदार्थ के डिब्बों पर जिंक की बजाय टिन की परत क्यों होती है ?
उत्तर – टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है।
76. उस अधातु का नाम बताइए जिसका उपयोग वनस्पति तेल के हाइड्रोजनीकरण द्वारा वनस्पति घी के निर्माण में होता है।
उत्तर – हाइड्रोजन |
77. धातु ऑक्साइड की सामान्य प्रकृति क्या है ?
उत्तर – क्षारीय।
78. अम्लों के साथ अभिक्रिया के दौरान धातुओं द्वारा विस्थापित गैस का नाम बताइए।
उत्तर – हाइड्रोजन गैस ।
79. सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं का निष्कर्षण किस तरह किया जाता है ?
उत्तर – विद्युत अपघटन विधि द्वारा।
लघु उत्तरीय प्रश्न
1. धातु किसे कहते हैं ? चार धातुओं के नाम बताएँ।
उत्तर – वैसे तत्व जो ऊष्मा तथा विद्युत का चालन करते हैं और आघातवर्ध्य तथा तन्य होते हैं, उसे धातु कहते हैं।
चार धातुएँ– आयरन, ऐलुमिनियम, सोना और चाँदी।
2. अधातु किसे कहते हैं ? चार अधातुओं के नाम बताएँ।
उत्तर – वैसे तत्व जो ऊष्मा तथा विद्युत का चालन नहीं करती है और न ही आघातवर्ध्य एवं तन्य होती है लेकिन वे भंगुर होते हैं, उसे अधातु कहते हैं ।
चार अधातुएँ– कार्बन, सल्फर, ब्रोमीन एवं हाइड्रोजन
3. धात्विक चमक किसे कहते हैं ?
उत्तर – अपने शुद्ध रूप में धातु की सतह चमकदार होती है। धातु के इस गुणधर्म को धात्विक चमक कहते हैं ।
4. धातुओं की प्रकृति विद्युत धनात्मक होती है। क्यों ?
उत्तर – धातुओं की प्रकृति विद्युत धनात्मक होती है क्योंकि उनमें अपने संयोजी इलेक्ट्रॉन खोकर धनायन बनाने की प्रकृति होती है।
5. अम्लराज (ऐक्वारेजिया) क्या है ?
उत्तर – सांद्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल के (3 : 1) के ताजा मिश्रण को अम्लराज कहते हैं। यह सोना प्लैटिनम को गला देता है।
6. जिंक को आयरन (II) सल्फेट के विलयन में डालने से क्या होता है ? इसकी रासायनिक अभिक्रिया लिखें।
उत्तर – जिंक को आयरन (II) सल्फेट के घोल में डालने से आयरन विस्थापित हो जाता और जिंक सल्फेट का घोल बन जाता है।
Zn + FeSO4 → ZnSO4 + Fe
7. आयनिक यौगिक या वैद्युत संयोजक यौगिक किसे कहते हैं ?
उत्तर – जिन यौगिकों के अणु में वैद्युत संयोजक बंधन या आयनिक बंधन रहता है उन्हें वैद्युत संयोजक या आयनिक यौगिक कहते हैं।
8. (i) सोडियम, (ii) ऑक्सीजन एवं (iii) मैग्नीशियम का इलेक्ट्रॉन बिन्दु संरचना दर्शाएँ।
उत्तर –

9. इलेक्ट्रॉन स्थानान्तरण के द्वारा Na2O एवं MgO की रचना को दर्शाएँ।
उत्तर –

10. आयनिक यौगिकों का गलनांक उच्च क्यों होता है ?
उत्तर – आयनिक यौगिकों का गलनांक एवं क्वथनांक बहुत अधिक होता है क्योंकि मजबूत अंतर-आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की पर्याप्त मात्रा की आवश्यकता होती है।
11. निम्नांकित पदों को परिभाषित करें-
(a) खनिज, (b) अयस्क, (c) गैंगा
उत्तर – (a) खनिज— प्रकृति में पाए जानेवाले ऐसे पदार्थ जिनमें धातु या धातुओं के यौगिक उपस्थित रहते हैं उसे खनिज कहते हैं।
जैसे— एलुमिना — Al2O2 2H2O
(b) अयस्क – ऐसे खनिज जिनसे धातुएँ आसानी से तथा सुमतापूर्वक लाभप्रद ढंग से प्राप्त की जा सकती हैं उसे अयस्क कहते हैं।
जैसे – कॉपर पायराइट (CuFeS2), एलुमिना — Al2O3. 2H2O
(c) गँग– पृथ्वी से खनिज अयस्कों में मिट्टी, रेत आदि जैसी कई अशुद्धियाँ होती हैं जिन्हें गैंग कहते हैं।
12. थर्मिट अभिक्रिया किसे कहते हैं ? इसके कोई दो उपयोग लिखें।
उत्तर – आयरन ऑक्साइड (Fe2O3) की Al के साथ अभिक्रिया अति तीव्र होती हैं जिससे काफी ऊष्मा उत्पन्न होती है। इस अभिक्रिया को थर्मिट अभिक्रिया कहते हैं।
Fe2O3 + 2Al → 2Fe + Al2O3 + ऊष्मा
उपयोग– (i) रेलवे ट्रैकों को जोड़ने में,
(ii) क्षारयुक्त मशीन के पुर्जों को जोड़ने में।
13. कुछ धातुओं को वायु में खुला छोड़ देने पर उनकी सतहें भद्दी हो जाती हैं। इसे •कारण सहित समझाएँ।
उत्तर – वायु में खुला छोड़ने पर धातु की सतह पर वायु से अभिक्रिया होने के कारण ऑक्साइड, कार्बोनेट या सल्फाइड यौगिक की सतह बन जाती है। इसीलिए धातु की चमक नष्ट हो जाती है।
14. जंग क्या होती है ?
उत्तर – लम्बे समय तक आर्द्र वायु में रहने पर लोहे पर भूरे रंग के पतली पदार्थ की परत चढ़ जाती है जिसे जंग कहते हैं।
15. लोहे को जंग से बचाने के लिए दो तरीके बताएँ।
उत्तर – (a) यशदलेपन इस विधि में लोहे की वस्तुओं के ऊपर जिंक की एक परत चढ़ाई जाती है।
(b) पेंट करके इस प्रक्रिया में लोहे की वस्तुओं का पेंट किया जाता है।
16. मिश्रधातु किसे कहते हैं ? इसके दो नाम तथा उपयोग लिखें।
उत्तर – दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्रधातु कहते हैं। मिश्रधातु के दो रूप हैं –
(a) इस्पात (b) पीतल ।
उपयोग- (a) इस्पात – जहाज, पुलों एवं वाहनों के निर्माण में ।
(b) पीतल–बर्तन निर्माण में।
17. अमलगम क्या है ?
उत्तर – यदि कोई एक धातु पारद है तो इसके मिश्रधातु को अमलगम कहते हैं।
18. 24 कैरेट गोल्ड क्या होता है ? इसको आप 18 कैरेट गोल्ड में किस प्रकार परिवर्तित कर सकते हैं ?
उत्तर – सोने की शुद्धता कैरेट में प्रदर्शित की जाती है। शुद्ध सोना 24 कैरेट का कहलाता है। ताँबा अथवा चाँदी धातु के 6 हिस्से 18 हिस्सा सोने में मिश्रित करके हम शुद्ध सोने को 18 कैरेट सोने में बदल सकते हैं।
19. प्लैटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है क्यों ?
उत्तर – प्लैटिनम, सोना एवं चाँदी बहुत कम अभिक्रियाशील है तथा ये संक्षारित नहीं होते हैं। उनकी चमक भी तेज होती है। अतः इनका उपयोग आभूषण बनाने के लिए किया जाता है।
20. पोटैशियम एवं लिथियम को तेल के अन्दर संग्रहित किया जाता है क्यों ?
उत्तर – पोटैशियम एवं लिथियम इतनी अभिक्रियाशील हैं कि खुले में रखने पर तुरन्त (तत्काल) आग पकड़ लेती है। उन्हें बचाने तथा आग लगने से रोकने के लिए उन्हें किरोसिन तेल के अन्दर संग्रहित किया जाता है।
21. ऐलुमिनियम अत्यधिक अभिक्रियाशील धातु है, फिर भी इसका उपयोग खाना बनाने वाले बर्तन के लिए किया जाता है क्यों ?
उत्तर – ऐलुमिनियम संक्षारित नहीं होता, साथ ही यह उष्मा का सुचालक है।
22. निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है क्यों ?
उत्तर – किसी धातु को उसके सल्फाइड और कार्बोनेट की अपेक्षा उसके ऑक्साइड से प्राप्त करना अधिक आसान है। इसलिए अपचयन से पहले धातु सल्फाइड एवं कार्बोनेट को धातु ऑक्साइड में बदल लेना चाहिए ।
23. खट्टे पदार्थ बर्तन को साफ करने में क्यों प्रभावी होते हैं ?
उत्तर – खट्टे पदार्थ अम्लों से अभिक्रिया करते हैं, ये पदार्थों में संक्षारित हिस्सों को अलग कर देता है शुद्ध पदार्थ बच जाता है।
24. गर्म जल का टैंक बनाने में ताम्बे का उपयोग होता है परन्तु इस्पात का नहीं, क्यों ?
उत्तर – ताँबा जल के साथ किसी भी स्थिति में अभिक्रिया नहीं करती है। लेकिन लोहा भाप के साथ अभिक्रिया कर ऑक्साइड एवं हाइड्रोजन गैस बनाती है। इसलिए गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है लेकिन लोहा अर्थात् इस्पात का उपयोग नहीं किया जाता है।
25. आपको एक हथौड़ा, बैटरी, बल्ब, तार एवं स्विच दिया गया है –
(a) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों को कैसे अलग कर सकते हैं ?
(b) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिताओं का आकलन करें।
उत्तर – (a) नीचे दिए गए चित्र के अनुरूप हम एक परिपथ बनाएँगे।

यदि नमूने को विद्युत परिपथ में लगाने पर स्विच ऑन करने पर बल्ब जलता है तो दिया गया नमूना एक धातु है ।
(b) यह विधि धातु एवं अधातु की जाँच के लिए बहुत उपयोगी है किन्तु ग्रेफाइट एक अपवाद है क्योंकि यह अधातु होते हुए भी विद्युत का सुचालक है।
26. ऑक्सीजन के साथ संयुक्त होकर अधातुएँ कैसा ऑक्साइड बनाती हैं ?
उत्तर – अधातुएँ ऑक्सीजन के साथ संयुक्त होकर उनके अम्लीय या उदासीन ऑक्साइड बनाती हैं।
C + O2 → CO2 (अम्लीय)
2C + O2 → 2CO (उदासीन)
27. तन्यता गुण को उदाहरण सहित परिभाषित करें।
उत्तर – धातु के पतले तार के रूप में खींचने की क्षमता को तन्यता कहा जाता है। सोना सबसे अधिक तन्य धातु है। केवल 1 ग्राम सोना से लगभग 2 km (किलोमीटर) लंबा तार बनाया जा सकता है।
28. धातुओं के अम्लीय एवं भस्मीय स्वभाव पर टिप्पणी लिखें।
उत्तर – धातु ऑक्साइड स्वभाव अम्लीय होता है। लेकिन ऐलुमिनियम ऑक्साइड, जिंक ऑक्साइड जैसे कुछ धातु ऑक्साइड अम्लीय तथा भस्मीय दोनों स्वभाव प्रदर्शित करते हैं।
29. धातुएँ पुनः ऑक्सीकरण से कैसे सुरक्षित रहती हैं ?
उत्तर – सामान्य तापमान पर मैग्नीशियम, ऍलुमिनियम, जिंक, सीसा आदि जैसी धातुओं की सतह पर ऑक्सीजन की पतली परत चढ़ जाती है। ऑक्साइड की यह परत धातुओं को पुन: ऑक्सीकरण से सुरक्षित रखती हैं।
30. एक्वारीजिया क्या होता है ? विवरण दें।
उत्तर – एक्वारीजिया, 3 : 1 के अनुपात में सांद्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल का मिश्रण है। यह सोने को गला सकता है जबकि दोनों में से किसी अम्ल में अकेलें यह क्षमता नहीं है।
एक्वारीजिया (रॉयल जल का लैटिन शब्द) भभक्ता द्रव होने के साथ तेज संक्षारक है। यह प्लैटिनम को गलाने में भी सक्षम है।
31. अभिक्रियात्मकता शृंखला की परिभाषा दें तथा प्रथम 5 धातुओं को उनके घटते क्रियाशीलता क्रम में प्रदर्शित करें।
उत्तर – अभिक्रियात्मकता श्रृंखला वह सूची है जिसमें धातुओं को क्रियाशीलता के अवरोही क्रम में व्यवस्थित किया गया है। विस्थापन के प्रयोगों के बाद इस शृंखला को विकसित किया गया है।
श्रृंखला की प्रथम 5 धातुएँ उनके घटते क्रियाशीलता क्रम में इस प्रकार से है।
K > Na > Ca > Mg > Al
32. कॉपर को वायु वायु खुला छोड़ने पर वह हरे रंग का हो जाता है। क्यों ?
उत्तर – कॉपर में उपस्थित आर्द्र कार्बन डाइऑक्साइड के साथ अभिक्रिया करता है। जिससे इसकी सतह से भूरे रंग की चमक धीरे-धीरे खत्म हो जाती है तथा इस पर हरे रंग की चमक चढ़ जाती है। यह हरा पदार्थ कॉपर कार्बोनेट होता है ।
33. 24 कैरेट सोना क्या है ?
उत्तर – शुद्ध सोने को 24 कैरेट कहते हैं तथा ये काफी नर्म होता है। इसलिए आभूषण बनाने के लिए ये उपयुक्त नहीं होता है। इसे कठोर बनाने के लिए चाँदी या कॉपर के साथ मिलाया जाता है। हमारे देश में प्रायः आभूषण बनाने के लिए 22 कैरेट सोने का उपयोग होता है। इसका मतलब है कि 22 भाग शुद्ध सोने में 2 भाग कॉपर या चाँदी मिश्रित किया जाता है।
34. गैलियम और सीजियम के द्रवनांक के बारे में बताएँ।
उत्तर – पारा को छोड़कर सारे धातु कमरे के तापमान पर ठोस अवस्था में पाए जाते हैं क्योंकि धातुओं का द्रवनांक अधिक होता है। लेकिन गैलियम और सीजियम का द्रवनांक कम होता है। हाथ पर रखने पर ये धातु पिघलने लगते हैं
35. एलुमिना के विद्युत अपघटनी अपचयन में, क्रायोलाइट के क्या विभिन्न कार्य है ?
उत्तर – ऐलुमिनियम के निष्कर्षण में क्रायोलाइट के मुख्य दो कार्य होते हैं
1. एलुमिना के द्रवनांक को कम करने के लिए।
2. एलुमिना विद्युत का कुचालक होता है। क्रायोलाइट (Na3AlF6) मिलाने से एलुमिना से Al3+ आयन उत्पन्न हो जाते हैं।
36. लोहे को थोड़े से कार्बन के साथ मिश्रित करने के उपरांत प्राप्त पदार्थ का उपयोग अधिक क्यों है ?
उत्तर – जब लोहे के साथ कुछ कार्बन मिला दिया जाता है तब वह फौलाद बन जाता है। वह अधिक दृढ़ हो जाता है। उसकी क्षमता बढ़ जाती है और उसे समुद्री जहाज, वाहन, बाँघ आदि बनाने में प्रयुक्त किया जा सकता है।
37. कच्चा लोहा एवं इस्पात में क्या-क्या भिन्नताएँ होती ?
उत्तर – ढलवाँ लोहा में कार्बन की प्रतिशत मात्रा 2 से 4.5% होती है जबकि इस्पात में यह 0.25 से 2% तक होती है। ढलवाँ लोहा भंगुर होता है और उसकी वेल्डिंग नहीं हो सकती। पर इस्पात आघातवर्ध्य तथा भंगुर है उसकी वेल्डिंग भी की जा सकती है।
38. सल्फर प्रकृति में किस अवस्था में मिलता है ? उसके खनिजों के नाम लिखिए।
उत्तर – सल्फर प्रकृति में मुक्त एवं संयुक्त दोनों अवस्थाओं में मिलता है। प्राकृतिक सल्फर के बड़े-बड़े भंडार पाए जाते हैं। यौगिकों के रूप में भी यह प्राप्त होता है। सल्फर के खनिज हैं-
1. सिनेबार (HgS )
2. जिंक ब्लेंड (ZnS )
3. कॉपर पाइराइट (CuFeS2) ।
39. सल्फर के उपयोगों का वर्णन करें।
उत्तर –
- सल्फर से सल्फ्यूरिक अम्ल बनाया जाता है जिसे अम्लों का सम्राट कहते हैं।
- इसके उपयोग से त्वचा क्रीम, एंटीसेप्टिक, फंगसनाशी बनाए जाते हैं।
- इसका उपयोग बारूद एवं आतिशबाजी में किया जाता है।
- प्राकृतिक रबड़ के गुणों में वृद्धि के लिए अर्थात् रबड़ के वल्कनीकरण में इसका उपयोग किया जाता है।
40. अधातुओं के भौतिक गुण लिखिए।
उत्तर – अधातुओं के भौतिक गुण –
- अधातुएँ प्राय: भंगुर होती हैं, इसलिए इनकी तारें और चादरें नहीं बनाई जा सकती हैं।
- इनमें ग्रेफाइट को छोड़कर किसी में चमक नहीं होती।
- ये ताप तथा ऊष्मा की कुचालक हैं परंतु ग्रेफाइट इसका अपवाद है।
- धातुओं की भाँति अधातुओं में स्वतंत्र इलेक्ट्रॉन नहीं होते।
- अधातुएँ वैद्युत ऋणात्मक होती हैं।
- इनका गलनांक, क्वथनांक तथा घनत्व कम होता है।
41. अधातुएँ ऑक्सीजन से संयोग करके किस प्रकार के ऑक्साइड बनाती हैं ? उदाहरण दीजिए।
उत्तर – अधातुएँ ऑक्सीजन से संयोग करके दो प्रकार के ऑक्साइड बनाती हैं अम्लीय और उदासीन।
(i) अम्लीय ऑक्साइड – अधातुएँ ऑक्सीजन से संयोग करके सह संयोजक ऑक्साइड बनाती हैं जो पानी में घुलकर अम्ल बनाते हैं।

(ii) उदासीन ऑक्साइड कुछ अधातुएँ ऑक्सीजन से संयोग करके उदासीन ऑक्साइड बनाती हैं। इन पर लिटमस पेपर का कोई प्रभाव नहीं होता है जैसे- कार्बन मोनोऑक्साइड (CO), पानी (H2O) तथा नाइट्रस ऑक्साइड (N2O) उदासीन ऑक्साइड हैं।
42. यदि सिल्वर नाइट्रेट के घोल में कॉपर की पत्ती को कुछ देर के लिए डुबो कर रखा जाए तो क्या होता है ? हो रही क्रिया का आयनी समीकरण लिखें।
उत्तर – कॉपर, सिल्वर से अधिक क्रियाशील है। जब कॉपर की पत्ती को कुछ देर के लिए सिल्वर नाइट्रेट के घोल में डुबो कर रखा जाता है तो सिल्वर निम्नलिखित क्रिया पर लेपित (deposit ) हो जाती है और घोल का रंग नीला हो जाता है।

43. ऐलुमिनियम के उपयोग बताएँ।
उत्तर – ऐलुमिनियम के उपयोग –
- ऐलुमिनियम हल्की धातु होने के कारण, हवाई जहाजों की बॉडी और मोटर इंजन बनाने के काम आती है।
- यह बर्तन, फोटोफ्रेम तथा घरेलू उपयोग की और अनेक वस्तुएँ बनाने में काम आती हैं।
- यह बिजली का सुचालक है इसलिए आजकल बिजली के स्थानांतरण के लिए इनका प्रयोग किया जाता है ।
- एलुमिनियम की बारीक परतों को खाने का सामान, दवाइयाँ, दूध की बोतलें आदि पैक करने में प्रयुक्त की जाती हैं।
- ऐलुमिनियम पाउडर सिल्वर पेंट बनाने के काम आता है।
- ऐलुमिनियम पाउडर एलुमिनो थेरैपी में प्रयुक्त होता है। यह प्रक्रम लोहे की पटरियों तथा मशीनों के टूटे भागों को जोड़ने के काम आता है।
44. ताँबे के उपयोगों पर प्रकाश डालिए।
उत्तर – ताँबे के प्रमुख उपयोग निम्नलिखित हैं
- ताँबा विद्युत तथा ताप का सुचालक है इसलिए विद्युत तारें, वैद्युत साधित्र इससे बनाए जाते हैं।
- इससे घरों में काम आने वाले बर्तन बनाए जाते हैं।
- इसका प्रयोग विद्युत लेपन, विद्युत मुद्रण आदि में किया जाता है।
- इससे मिश्र धातु जैसे काँसा, पीतल, गनमैटल आदि बनाए जाते हैं।
- इससे निर्वात पलड़ों, ऊष्मामापी, सिक्कं तथा मूर्तियाँ आदि बनाई जाती हैं।
- इसका प्रयोग आजकल मुद्रित इलेक्ट्रॉनिक परिपथ बनाने में किया जाता है।
- सोने के आभूषणों को कठोर करने के लिए उनमें ताँबा मिलाया जाता है।
45. वल्कनीकरण किसे कहते हैं ? इस प्रक्रिया में रबड़ में क्या परिवर्तन आते हैं ?
उत्तर – सल्फर को प्राकृतिक रबड़ के साथ मिश्रित करने की प्रक्रिया को वकनीकरण कहते हैं। जब प्राकृतिक रबड़ को सल्फर से मिलाकर गर्म करते हैं तो रबड़ अधिक कठोर तथा कम लचकदार हो जाता है। रबड़ एक बहुलक है जिसमें एक ही तल में अणुओं की एक लंबी श्रृंखला होती है जिसके कारण रबड़ को खींचा जा सकता है परंतु सल्फर मिलाने से उसका लचीलापन समाप्त हो जाता है क्योंकि सल्फर रबड़ की शृंखला के समान अणुओं के मध्य आड़े बंध बनाता है। सल्फर कार्बन परमाणुओं के घूर्णन में भी बाधा डालती है।
46. वल्कनीकृत रबड़ के उपयोग लिखिए।
उत्तर – 1. इससे रबड़ के टायर बनाए जाते हैं।
2. स्याही मिटाने वाली रबड़, गेंद, कालीन के अस्तर आदि वल्कनीकृत रबड़ से बनते हैं।
3. रबड़ बैंड बनाए जाते हैं।
4. वल्कनीकृत वड़ साधारण विलायकों में घुलता नहीं इसलिए इससे तेल रखने वाले बर्तन बनाए जाते हैं।
5. इससे बनी नियोप्रिन रबड़ विद्युत तारों के रोधक रूप में उपयोग होती है।
6. नियोप्रीन रबड़ से पट्टियाँ बनती हैं जिन्हें आग नहीं लगती तथा उनका प्रयोग कोयले की खानों में किया जाता है।
47. ढलवाँ लोहा, पिटवॉ लोहा तथा इस्पात में अंतर बताएँ।
उत्तर –

48. आप ताँबे को कैसे शोधन करेंगे ? इसका वर्णन करें।
उत्तर – अशुद्ध कॉपर को एनोड बनाया जाता है जबकि शुद्ध कॉपर की पतली चादर को कैथोड से जोड़ा जाता है। कॉपर सल्फेट जिसमें कुछ तनु H2SO4 को विद्युत अपघट्य के रूप में प्रयोग किया जाता है जैसा कि चित्र में दर्शाया गया है।
विद्युत् अपघट्य में से विद्युत् धारा प्रवाहित की जाती है तो कॉपर कैथोड पर जमा होना आरंभ करता है और अशुद्धियाँ एनोड पर एनोड मड (गारा) के रूप में इकट्ठी हो जाती है।

49. शुद्ध धातुओं के उपयोग लिखें।
उत्तर – (i) ताँबा तथा ऐलुमिनियम की तारें विद्युत् धारा को संचारित करने के लिए प्रयोग में लाई जाती हैं ।
(ii) बर्तन तथा कारखानों की मशीनें, लोहे, ऐलुमिनियम तथा ताँबे से बनती हैं।
(iii) सोने तथा चाँदी का उपयोग आभूषण बनाने तथा मिठाइयों को सजाने में होता है।
(iv) ऐलुमिनियम के पतले वर्क खाद्य पदार्थों को पैक करने में प्रयुक्त होते हैं।
(v) कैडमियम, टाइटेनियम, जिर्कोनियम आदि धातुओं का उपयोग नाभिकीय ऊर्जा तथा अंतरिक्ष विज्ञान के प्रोजेक्टों में होता है।
(vi) टाइटेनिक तथा इसकी मिश्र धातुओं का उपयोग अंतरिक्ष यान, वायुयान ढाँचे तथा इंजन, रासायनिक रियेक्टर इत्यादि बनाने के लिए किया जाता है।
(vii) मानवीय शरीर में कृत्रिम अंगों तथा टूटी हुई हड्डियों के रूप में धातुएँ प्रयोग की जाती हैं।
50. उन धातुओं के नाम तथा उपयोग लिखिए जो जैव तंत्र के लिए आवश्यक है।
उत्तर – 1. लोहा- यह हीमोग्लोबिन का एक भाग है जो जैव तंत्र में ऑक्सीजन प्रदान करवाता है।
2. ताँबा तथा जिंक- ये एंजाइमों के घटक हैं।
3. सोडियम तथा पोटाशियम- ये स्नायु एवं संकुचन की वैद्युत् प्रक्रियाओं में हिस्सा लेते हैं।
51. गंधक अणु की संरचना लिखें।
उत्तर – गंधक के अणु आठ सदस्यों वाली किसी वलयाकार (ring like) संरचना के रूप में पाये जाते हैं। गर्म करने पर ये वलयाकार संरचनाएँ टूट जाती हैं। गंधक के एक अणु में आठ गंधक परमाणु होते हैं।
गंधक के अणु में स्थित आठ गंधक परमाणु एकल बंध (Single.covalent) द्वारा जुड़े होते हैं | S-S-S बंध परस्पर 105° का कोण बनाते हैं।

52. गंधक के अपररूपों के नाम लिखें।
उत्तर – गंधक के अपररूप –
(i) समचतुर्भुज गंधक (Rhombic Sulphur)
(ii) त्रिपाश्र्व गंधक (Monoclinic Sulphur)
(iii) लचीला गंधक (Plastic Sulphur)
(iv) दुधिया गंधक (Milky Sulphur)
(v) कोलाइडल गंधक (Colloidal Sulphur
53. हवाई जहाजों का डाँका ऐलुमिनियम के मिश्र धातुओं से क्यों बनाया जाता है ? वर्णन करेंगे
उत्तर – हवाई जहाजों का ढाँचा ऐलुमिनियम के मिश्र धातुओं ड्यूरेलुमिन और मैग्लिनियम से निम्नलिखित कारणों से बनाया जाता है –
(i) मे अति हल्की मिश्र धातु है जिसका आपेक्षिक घनल बहुत कम है।
(ii) सुचालक होने के कारण विद्युत् प्रेषण तारें इनसे बनाई जा सकती हैं।
(iii) इन पर जंग नहीं लगता।
(iv) इन मिश्रधातुओं की कठोरता बहुत अधिक होती है।
(v) ये रसायनों के प्रति बहुत क्रियाशील नहीं है
54. मिश्रधातु (Alloys) स्टील क्या है ? किसी तीन मिश्रधातु (Alloy) स्टील के नाम और उनकी संरचना लिखें।
उत्तर – लोहे के साथ अन्य धातुओं और अधातुओं को मिला कर प्राप्त की जाने वाली मिश्रधातु स्टील कहलाती है। इसके तीन प्रकार हैं –
- कार्बन स्टील लोहे और कार्बन का मिश्र धातु कार्बन स्टील कहलाता है जिसमें कार्बन की मात्रा 0.5 से 1.5% तक होती है। कार्बन के अतिरिक्त सिलिकॉन, गन्धक, फॉस्फोरस तथा मैंगनीज भी होती है। कार्बन स्टील पॅच, कील, गाड़ी की पटरियाँ, गार्डर तथा मशीनें बनाने में काम आता है। समुद्री जहाज, इमारतें तथा वाहन भी इसी से बनते हैं।
- स्टेनलेस स्टील – जिसमें क्रोमियम, निकेल, ताँबा, टंगस्टन या वेनेडियम को मिलाया जाता है उसे स्टेनलेस स्टील कहते हैं। इसमें क्रोमियम 18% तथा निकेल 8% होता है। यह डेयरी उद्योग, अस्पतालों तथा बर्तन तैयार करने में काम आता है।
- टैंपर्ड स्टील गलित लोहे में कार्बन की मात्रा मिला कर जिस स्टील को प्राप्त किया जाता है उसे ऊष्मीय उपचार से अति कठोर बना दिया जाता है। वही टैपई स्टील कहलाता है। इसे मशीनों को बनाने में प्रयुक्त किया जाता है।
55. टाइटेनियम धातु का शुद्धिकरण कैसे किया जाता है ?
उत्तर – टाइटेनियम धातु का शुद्धिकरण वान आर्केल विधि द्वारा किया जाता है। इस विधि द्वारा 100% शुद्ध टाइटेनियम प्राप्त किया जाता है। इस विधि में अशुद्ध टाइटेनियम धातु को आयोडाइड में परिवर्तित करते हैं। धातु के वैरल में निर्वात् पैदा कर उसमें आयोडीन से भरे बल्ब को तोड़कर धातु को तप्त करते हैं। गैसीय टाइटेनियम आयोडाइड तंतु के सम्पर्क में आने से अपघटित हो जाता है और विशुद्ध टाइटेनियम तंतु पर जमा हो जाता है।
56. धातुकर्म या धात्विक (metallurgy) से क्या समझते हैं ? इसके प्रमुख चरण कौन-कौन से हैं ?
उत्तर – किसी अयस्क से धातु शुद्ध रूप में प्राप्त करने की क्रिया को धातुकर्म कहते हैं। धातुकर्म के प्रमुख चरण हैं –
(i) प्रारंभिक उपचार–(a) अयस्क का बारीक चूर्ण बनाना, (b) सान्द्रण (concentration)
(ii) सान्द्रित अयस्क का भर्जन या जारण (roasting)
(iii) सान्द्रित अयस्क का निस्तापन (calcination)
(iv) अवकरण (reduction) तथा
(v) अशुद्ध धातु का शोधन (refining )
57. टाइटेनियम को रणनीतिक धातु क्यों कहते हैं ?
उत्तर – टाइटेनियम धातु का उपयोग वायुयान का फ्रेम बनाने, इंजन बनाने, अंतरिक्षयानों में, रासायनिक उद्योगों में सेना का साज-सामान बनाने में परमाणु ऊर्जा तथा अंतरिक्ष के कार्यक्रमां में तथा रासायनिक रिएक्टर में होता है। ये सभी वस्तुएँ युद्ध के लिए अति आवश्यक एवं उपयोगी हैं। अतः टाइटेनियम को रणनीतिक धातु कहा जाता है।
58. मिश्रधातु क्या है ? इसे एक उदाहरण के द्वारा समझाएँ ।
उत्तर – दो या दो से अधिक धातुओं के संयोग से बनी धातु को मिश्रधातु कहते हैं। स्टेनलेस स्टील तथा ड्यूरेलुमिन मिश्रधातु के उदाहरण हैं।
स्टेनलेस स्टील; लोहा, क्रोमियम तथा निकेल धातु के संयोग से बनता है। इनकी प्रतिशत मात्रा निम्नांकित हैं —
लोहा 88-95%, क्रोमियम 12-15% तथा निकेल 4-7%
59. धातु संक्षारण से क्या समझते हैं तथा इससे बचने का क्या उपाय है ?
उत्तर – कुछ धातु वायुमण्डल की वायु और नमी से अभिक्रिया करके अवांछनीय पदार्थों में परिणत हो जाते हैं तथा इसकी ऊपरी सतह नष्ट होने लगती है। इस क्रिया को ‘धातु संक्षारण ‘ कहते हैं।
कुछ धातुओं को संक्षारण से बचाने के उपाय इस प्रकार हैं- (i) कलई कर (ii) मिश्रधातु बनाकर (iii) ग्रीज या तैलीय पदार्थ का लेप चढ़ाकर (iv) कम संक्षारित होने वाले धातुओं का लेप चढ़ाकर ।
60. सोना और प्लैटिनम पर अम्लों का कोई प्रभाव नहीं पड़ता है, पर अम्लराज इन्हें भी घुला देता है। क्यों ?
उत्तर – सोना और प्लैटिनम किसी भी सान्द्र अम्ल में नहीं घुलते हैं लेकिन तीन भाग HCl तथा एक भाग HNO3 के मिश्रण में ये घुल जाते हैं। इस अम्ल मिश्रण को अम्लराज (aquaregia) कहते हैं। इन दोनों अम्लों की अभिक्रिया से नवजात क्लोरीन उत्पन्न होता है।
3HCl + NHO3 → NOCl + 2H2O + 2Cl
यह नवजात क्लोरीन, सोना या प्लैटिनम से अभिक्रिया करता है।
Au + 3Cl + HCl → H+ AuCl4
61. तापानुशीतन क्या है ?
उत्तर – इस्पात को इतना गर्म किया जाता है कि वह एकदम लाल हो जाए। इस लाल एवं तप्त इस्पात को जल या तेल में डुबोकर शीघ्र ठंडा किया जाता है। इससे इस्पात अत्यंत कठोर तथा भंगुर हो जाता है। इस क्रिया को इस्पात का कठोरीकरण कहते हैं।
इस प्रकार के इस्पात को पुनः गर्म करके धीरे-धीरे ठंडा करने पर वह लचीला तथा कम भंगुर हो जाता है। इस क्रिया को इस्पात का तापानुशीतन कहते हैं ।
62. स्टेनलेस स्टील क्या है तथा इसकी विशेषताएँ क्या हैं ?
उत्तर – स्टेनलेस स्टील लोहा का मिश्रधातु (alloy) है। ये मुख्यतः लोहा, कार्बन, क्रोमियम तथा निकेल धातु से बने रहते हैं। इसमें क्रोमियम की मात्रा 12-15% तथा निकेल की मात्रा 4-7% होती है।
इसमें जंग नहीं लगती है। अतः इसका उपयोग बर्तन, ब्लेड, वाल्व बनाने में होता है।
63. फिटकरी का क्या उपयोग है ?
उत्तर – फिटकरी (पोटाश एलम) पोटैशियम एवं ऐलुमिनियम धातु का एक मिश्रित लवण है। इसका अणुसूत्र है :–
K2SO4 Al2 (SO4)3 · 24H2O
उपयोग — (i) जल के शुद्धिकरण में, (ii) औषधि बनाने में, (iii) चमड़ा उद्योग में तथा (iv) खून बंद करने में है।
64. ड्यूरेलुमिन क्या है ? इसके दो उपयोग लिखें।
उत्तर – ड्यूरेलुमिन ऐलुमिनियम का एक मिश्रधातु है। इसमें ऐलुमिनियम 95%, ताँबा 4% तथा वायुयान के पंखे, मैग्नीशियम और अल्पमात्रा में मैंगनीज धांतु मिले रहते हैं। इसका उपयोग वायुयान, रसोई के बर्तन तथा अन्य सामान आदि बनाने में होता है।
65. बॉक्साइट क्या है ?
उत्तर – बॉक्साइट ऐलुमिनियम धातु का एक अयस्क है। इसका अणुसूत्र Al2O3 · 2H2O है। पृथ्वी तल में यह प्रचुर मात्रा में पाया जाता है।
पश्चिम बंगाल, झारखंड, केरल, महाराष्ट्र तथा मध्य प्रदेश में बॉक्साइट से ऐलुमिनियम धातु का निष्कर्षण होता है।
66. वाशिंग सोडा. का रासायनिक सूत्र लिखिए। इसके दो प्रमुख गुण तथा उपयोग लिखिए।
उत्तर – वाशिंग सोडा का सूत्र Na2CO3 · 10H2O है जिसका रासायनिक नाम सोडियम कार्बोनेट है। इसे साल्वे विधि द्वारा बनाया जाता है।
गुण – (i) इसकी प्रकृति क्षारीय है तथा इसमें अपमार्जक के गुण हैं । (ii) क्रिस्टलीय रूप में इसमें क्रिस्टलन जल होता है जिसे वायु में खुला रखने पर जल निकल जाता है तथा क्रिस्टल सफेद अपारदर्शक पाउडर में परिवर्तित हो जाता है।
Na2CO3 · 10H2O → Na2CO3 · H2O + 9H2O
उपयोग (i) कठोर जल को मृदु जल में बदलने के काम आता है। (ii) घरेलू कार्यों में कपड़ों की सफाई के लिए प्रयुक्त किया जाता है। (iii) इससें बोरेक्स, कॉस्टिक सोडा, काँच, कागज, साबुन तथा अपमार्जक बनाए जाते हैं। (iv) इसका उपयोग क्षारक के रूप में भी होता है।
67. बेकिंग सोडा का संक्षिप्त वर्णन कीजिए।
उत्तर – बेकिंग सोडा का रासायनिक सूत्र NaHCO3 है तथा इसका रासायनिक नाम सोडियम बाइकार्बोनेट है। इसका निर्माण Na2CO3 के जलीय विलयन में CO2 गुजारने पर होता है।
Na2CO3 +CO2 + H2O → 2NaHCO3
गुण – जब इसे गर्म करते हैं तो यह फूल जाता है और हल्का हो जाता है। बेकिंग पाउडरों में टारटेरिक अम्ल होता है। गर्म करने, पर यह NaHCO3 के साथ क्रिया करके CO2 उत्पन्न करता है जिसके कारण फूलकर मुलायम तथा हल्का हो जाता है। यह पानी में घुलनशील है।
उपयोग – (i) इसका उपयोग वाशिंग सोडा बनाने में होता है। (ii) पेट की खराबी की अवस्था में यह औषधि का कार्य करता है। (iii) इसे अग्निशामक यंत्र में भी भरा जाता है।
68. कली चूना से बुझा हुआ चूना कैसे बनाया जाता है ? संतुलित समीकरण दें।
उत्तर – जब कली चूना पर जल डाला जाता है तो ऊष्माक्षेपी अभिक्रिया के फलस्वरूप वह बुझा हुआ चूना में बदल जाता है।
CaO + H2O → Ca(OH)2
कली चूना बुझा हुआ चूना
69. फॉस्फोरस स्वतंत्र रूप में क्यों प्राप्त नहीं होता ? इसकी प्राप्ति के सौत लिखिए। इसको किस प्रकार प्राप्त किया जाता है ?
उत्तर –फॉस्फोरस एक अति क्रियाशील तत्त्व है जिसके कारण यह स्वतंत्र अवस्था में नहीं पाया जाता है। यह समस्त जैव जीवों, पौधे तथा जन्तु दोनों में पाया जाता है। हमारे शरीर में फॉस्फोरस, हड्डियों, मांसपेशियों तथा स्नायु ऊतकों में पाया जाता है।
फॉस्फोरस को अस्थियों अथवा खनिजों के फास्फेट से प्राप्त करते हैं। फॉस्फेट को रेत तथा कोक के साथ गर्म करके भी फॉस्फोरस प्राप्त किया जाता है।
70. हरे पौधों को फॉस्फोरस की अत्यधिक आवश्यकता होती है। कारण लिखिए।
उत्तर – हरे पौधों की वृद्धि फॉस्फोरस की उपस्थिति पर निर्भर करती है। पौधों द्वारा भोजन बनाने की प्रकाश-संश्लेषण विधि फॉस्फोरस की अनुपस्थिति में संपन्न नहीं हो सकती है। इसकी कमी से पौधों की पत्तियाँ पीली पड़ जाती हैं तथा अंत में पौधे मर जाते हैं। फसल की पैदावार फॉस्फोरस की उपस्थिति में अच्छी होती है। पौधे फॉस्फोरस को केवल घुलनशील यौगिकों के रूप में ही उपयोग कर सकते हैं।
71. सिलिकॉन के क्या उपयोग हैं ?
उत्तर – सिलिकॉन के निम्नलिखित उपयोग हैं—
(i) सिलिकॉन कार्बाइड (SiC) बनाने मे
(ii)अर्द्धचालक युक्तियाँ बनाने में
(iii) सीमेंट तथा काँच के निर्माण में
(iv) लोहा, ऐलुमिनियम, ताँबा तथा मैंगनीज की मिश्रित धातुओं में एवं सिलिकॉन बहुलक बनाने में।
72. फॉस्फोरस के दो अपररूपों के नाम लिखिए। कौन-सा अपररूप स्थाई है ? तीन उपयोग भी लिखिए।
उत्तर – फॉस्फोरस के अपररूपों के नाम इस प्रकार हैं-
(i) पीला या सफेद फॉस्फोरस,
(ii) लाल फॉस्फोरस, लाल फॉस्फारस स्थाई अपररूप है।
उपयोग – (i) दियासलाई तथा आतिशबाजी बनाने के काम आता है। (ii) पौधों के लिए सुपर फॉस्फेट उर्वरक इससे बनाये जाते हैं। (iii) मनुष्यों की हड्डियों का यह एक आवश्यक अंग है।
73. गंधक के किन्हीं दो अपरूपों को लिखें।
उत्तर – (i) एकनताक्ष गंधक (ii) अष्टफलकीय गंधक।
74. इस्पात के टेंपरिंग (tempering) से क्या अभिप्राय है ?
उत्तर – गलित आयरन में कार्बन मिलाकर विभिन्न कठोरता वाले इस्पात प्राप्त किए जाते हैं। अर्थात् ऊष्मीय उपचार द्वारा इस्पात की कठोरता में परिवर्तन लाया जा सकता है। अतः इस्पात ‘को नियन्त्रित दर से गर्म करने तथा ठण्डा करने का प्रक्रम टेंपरिंग कहलाता है।
75. सोना और चाँदी प्राय: स्वतंत्र अवस्था में क्यों पाये जाते हैं ?
उत्तर – सोना तथा चाँदी अन्य धातुओं की तुलना में सबसे कम अभिक्रियाशील हैं। कम अभिक्रियाशील होने के कारण ये अन्य धातुओं से संयोग नहीं करते हैं। अतः ये प्रकृति में स्वतंत्र अवस्था में पाये जाते हैं।
76. पीला फॉस्फोरस जल में क्यों रखा जाता है ?
उत्तर – पीला फॉस्फोरस काफी क्रियाशील तत्त्व है। इसका प्रज्वलन ताप 30°C है। अर्थात् वायु में रखने पर गर्मी के कारण यह स्वतः जलने लगता है। अतः इसे जल में रखा जाता है।
77. श्वेत फॉस्फोरस को हवा में छोड़ देने पर जल उढ़ता है जबकि माचिस की तीली स्वतः नहीं जलती है, क्यों ?
उत्तर – श्वेत फॉस्फोरस को हवा में छोड़ देने पर स्वतः जल उठता है। साधारण ताप पर यह स्फुरदीप्ति दिखाता है तथा ऑक्सीकरण प्रदर्शित करता है। दियासलाई की तीली में लाल फॉस्फोरस होता है जिसपर साधारण ताप का कोई प्रभाव नहीं पड़ता है। अतः माचिस की तीली स्वतः नहीं जलती है।
दीर्घ उत्तरीय प्रश्न
1. धातु और अधातु के सामान्य गुणधर्मों के प्रमुख चार अपवाद लिखिए।
उत्तर –
- पारा को छोड़कर सारे धातु कमरे के तापमान पर ठोस अवस्था में पाए जाते हैं। धातुओं का द्रवनांक अधिक होता है लेकिन गैलियम और सीजियम का द्रवनांक बहुत कम है।
- आयोडीन अधातु होते हुए भी चमकीला है।
- कार्बन ऐसा अधातु है जो विभिन्न रूपों में रह सकता है। हीरा कार्बन का एक अपररूप है। यह सबसे कठोर प्राकृतिक पदार्थ है। इसका द्रवनांक तथा क्वथनांक बहुत अधिक है। कार्बन का एक अन्य अपररूप ग्रेफाइट विद्युत् का सुचालक है।
- क्षारीय धातु (लिथियम, सोडियम, पोटैशियम) इतने मुलायम होते हैं कि उनको चाकू से भी काटा जा सकता है। इनका घनत्व तथा द्रवनांक कम होता है ।
2. अयस्कों का सान्द्रण क्यों आवश्यक है ? सल्फाइड अयस्कों के सान्द्रण में कौन-सी विधि उपयुक्त है ? सकारण लिखें।
उत्तर – किसी अयस्क (ores) में उपस्थित अशुद्धियों को दूर करना अयस्क का सान्द्रण ( concentration of ores) कहलाता है।
सल्फाइड अयस्कों के सान्द्रण की उपयुक्त विधि ‘फेन-प्लवन विधि’ (froth floatation process) है। कॉपरन पाइराइट (CuFeS2), गैलेना (PbS), सिल्वर गलान्स (Ag2S), जिंक ब्लेंड (ZnS) आदि अयस्कों का सान्द्रण इसी विधि के द्वारा किया जाता है।

सल्फाइड अयस्क के महीन चूर्ण को पाइन या युकेलिप्टस तेल मिश्रित जल में डाला जाता है। एक पाइप के द्वारा जल में वायु का झोंका प्रवाहित किया जाता है। इससे जल में झाग उत्पन्न होता है। अयस्क के कण झाग के साथ ऊपर उठ जाते हैं तथा अशुद्धियाँ भार के कारण नीचे बैठ जाती है।
3. मिश्रधातु किसे कहते हैं ? इनके बनाने के उद्देश्यों का वर्णन करें।
उत्तर – मिश्रधातु (Alloys)- किसी धातु का किसी अन्य धातु या अधातु के साथ मिलाकर बनाया गया समांगी मिश्रण मिश्रधातु कहलाता है। जैसे-टांका में कलई तथा सीसा समान मात्रा में मिलाया जाता है। उदाहरण के लिए; स्टेनलेस स्टील, टांका, पीतल, काँसा, गनमेटल आदि सभी मिश्रधातु हैं।
मिश्रधातुओं के उपयोग
- कठोरता बढ़ाने के लिए लोहे में कार्बन की मात्रा मिलाकर स्टेनलेस स्टील बनाया जाता है जो लोहे से अधिक कठोर होता है। सोने में ताँबा तथा चाँदी में सीसा मिलाने से उनकी कठोरता अधिक हो जाती है।
ड्यूरेलियम ऐलुमिनियम से बना मिश्रधातु है जो अत्यधिक कठोर होता है।
- शक्ति बढ़ाने के लिए इस्पात, ड्यूरेलियम आदि मिश्रधातु कठोर होने के कारण शक्तिशाली भी होते हैं।
- संक्षारण रोकने के लिए स्टेनलेस स्टील, जर्मन सिल्वर आदि पर जंग नहीं लगती है।
- ध्वनि उत्पन्न करने के लिए ताम्बे तथा जस्ता से बनाई गई मिश्रधातु में बेलमेटल होती है जिससे अधिक ध्वनि उत्पन्न की जाती है।
- गलनांक कम करने के लिए जैसे रोज-मेटल मिश्रधातु है। इसका गलनांक कम होता है। यह बिस्मथ कलई और सीसे से बनती है।
- उचित साँचे में ढालने के लिए- कांसा तथा टाइप मेटल ।
- रंग परिवर्तन के लिए ताँबा तथा ऐलुमिनियम से बनी ऐलुमिनियम ब्रांज मिश्रधातु का रंग सुनहरा होता है।
- घरेलू उपयोग– घरों, कारखानों, दफ्तरों आदि में मिश्रधातुओं का उपयोग होता है जैसे घर के बर्तन, आलमारी, पंखे, फ्रिज, आभूषण आदि में।
4. नामांकित चित्र की सहायता से सल्फर निष्कासन की फ्राश-प्रक्रम का वर्णन कीजिए। सान्द्र सल्फ्यूरिक अम्ल तथा कार्बन के साथ सल्फर की प्रतिक्रिया रासायनिक समीकरण के साथ लिखिए।
उत्तर – पृथ्वी की सतह के काफी नीचे पाई जाने वाली गंधक को फ्राश-प्रक्रम के द्वारा प्राप्त किया जाता है।

इस विधि के लिए तीन संकेन्द्रित नलियाँ ली जाती हैं जिन्हें जमीन के दी जाती है जहाँ गंधक की परतें होती हैं। अन्दर वहाँ तक धंसा
सबसे बाहरी एवं चौड़ी नली से अति तप्त जल प्रवाहित किया जाता है जो गंधक को पिघला देता है। सबसे बीच वाली नली से दाब युक्त हवा प्रवाहित की जाती है। हवा के दाब के कारण मध्य नली से द्रवित गंधक बाहर निकलती है तथा ठंढक के कारण जमकर ठोस अवस्था प्राप्त djyshg$;g yxhz 99.8% शुद्ध गंधक होती हैं।
गंधक की प्रतिक्रिया–(i) सान्द्र गंधकाम्ल के साथ अभिक्रिया करके यह सल्फर डाइऑक्साइड गैस देती है।
S + 2H2SO4 → 2H2O + 3SO2
(ii) लाल तप्त कार्बन पर गंधक का वाष्प प्रवाहित करने से कार्बन डाइसल्फाइड बनता है।
C + 2S → CS2
5. लोहे के दो मुख्य अयस्कों के नाम उनके सूत्र सहित लिखें। लोहे के निष्कर्षण के करण भट्टी में होनेवाली अभिक्रियाओं के समीकरण दें।
उत्तर – लोहे के मुख्य अयस्क इस प्रकार हैं
(i) हेमेटाइट → Fe2O3
(ii) मैग्नेटाइट → Fe3O4
वात्या भट्ठी में होने वाली अभिक्रिया –
(i) भट्ठी के तली के करीब 1500°C ताप पर कोक जलकर CO2 गैस बनती है।
C + O2 → CO2 + ऊष्मा
(ii) भट्ठी के बीच में CO2 गैस तप्त कोक द्वारा अवकृत होकर CO गैस बनती है।
CO2 + C → 2CO
(iii) भट्ठी के सिरे के निकट CO गैस हेमेटाइट अयस्क को लोहा में अवकृत कर देता है, कुछ Fe2O3 का अवकरण कोक द्वारा भी होता है।
Fe2O3 + 3CO → 2Fe + 3CO2
Fe2O3 + 3C → 2Fe + 3CO
प्राप्त द्रवित लोहा को साँचा में ढाल लिया जाता है।
अतः इस लोहा को ‘ढलवाँ लोहा’ कहा जाता है।
6. सल्फर को गंधकाम्ल एवं हाइड्रोजन के साथ तथा फॉस्फोरस की क्लोरीन एवं कॉस्टिक सोडा से उसके साथ अभिक्रियाओं के संतुलित समीकरण लिखें।
उत्तर – सल्फर की अभिक्रिया-
(i) गंधकाम्ल (H2SO4) के साथ गंधक (sulphur) को सान्द्र गंधकाम्ल के साथ गर्म करने पर सल्फर डाइऑक्साइड गैस निकलती है।
S + 2H2SO4 → 2H2O+ 3SO2
(ii) हाइड्रोजन के साथ – उबलती हुई गंधक में हाइड्रोजन गैस प्रवाहित करने पर हाइड्रोजन (H2S) गैस बनती है।
S + H2 → H2S
फॉस्फोरस की अभिक्रिया –
(i) क्लोरीन के साथ- श्वेत फॉस्फोरस साधारण ताप पर क्लोरीन से संयोग करता है जबकि लाल फॉस्फोरस गर्म किए जाने पर क्लोरीन से संयोग करता है।
P4 + 6Cl2 → 4PCl3
P4 + 10Cl2 → 4PCl5
(ii) कॉस्टिक सोडा (NaOH) के साथ- श्वेत फॉस्फोरस कॉस्टिक सोडा के गर्म तथा सान्द्र विलयन से अभिक्रिया कर फॉस्फीन (PH3) गैस उत्पन्न करता है ।
4P + 3H2O + 3NaOH → 3NaH2PO2 + PH3
7. सिलिकॉन बनाने की विधि लिखिए। इसके भौतिक तथा रासायनिक गुणों का वर्णन कीजिए।
उत्तर – सिलिकॉन को इसके सामान्य रूप सिलिकॉन डाइऑक्साइड से प्राप्त किया जाता है। यह स्वतंत्र रूप में उपलब्ध नहीं है। सिलिकॉन डाइऑक्साइड को कोक के साथ विद्युत भट्ठी में गर्म करने पर इसका अपचयन हो जाता है जिससे सिलिकॉन प्राप्त होता है।

सिलिकॉन के भौतिक गुण – (i) यह सामान्य ताप पर ठोस होता है । (ii) यह कड़ा, वमकदार तथा स्लेटी रंग का पदार्थ है। (iii) इसका गलनांक 1410°C है। (iv) यह क्रिस्टलीय ठोस है तथा इसकी परमाणु व्यवस्था हीरे के समान है। सिलिकॉन अणु चार (Si) परमाणुओं घेरा रहता है तथा समस्त Si परस्पर सहसंयोजक बंधों द्वारा जुड़े रहते हैं।
सिलिकॉन के रासायनिक गुण – (i) कक्ष ताप पर सिलिकॉन निष्क्रिय है परंतु उच्च तापक्रम पर ऑक्सीजन से संयोग कर श्वेत रंग की ठोस सिलिका (रेत) बनाती है।
Si + O2 → Si2 ↓ (सिलिका)
(ii) अक्रिस्टलीय सिलिकॉन 450°C पर क्लोरीन के साथ क्रिया करके सिलिकॉन टेट्राक्लोराइड बनती है।
Si + 2Cl2 → SiCl4
(iii) हाइड्रोक्लोरिक अम्ल अभिक्रिया कर सिलिकॉन टेट्राक्लोराइड तथा हाइड्रोजन गैस बनती है।
Si + 4HClO → SiCl4 + 2H2 ↑
(iv) गर्म सोडियम हाइड्रोक्साइड के घोल में घुलकर यह हाइड्रोजन गैस मुक्त करती है।
Si + 2NaOH + H2 → Na2SiO3 + 2H2 ↑
(सोडियम सिलिकेट)
2Al(OH)3 → Al2O3 + 3H2O
8. साधारण नमक का रासायनिक नाम तथा सूत्र लिखें। यह क्यों पसीजता है ? इससे निर्मित दो उपयोगी यौगिकों का घरेलू नाम तथा सूत्र दें।
उत्तर – साधारण नमक का रासायनिक नाम सोडियम क्लोराइड तथा इसका सूत्र NaCl है। इस नमक में अशुद्धि के रूप में मैग्नेशियम क्लोराइड (MgCl2) उपस्थित रहने के कारण बरसात के दिनों में यह पसीजता है। मैग्नेशियम क्लोराइड एक जलशोषक (deliquescent) पदार्थ अतः यह वायुमंडल की नमी को शोषित करता है, जिसके कारण कुछ जल जमा हो जाता हमलोग ऐसा अनुभव करते हैं कि नमक ही पसीज रहा है।
साधारण नमक से निर्मित पदार्थ
(i)इससे कॉस्टिक सोडा (NaOH) तैयार होता है, जिससे साबुन बनता है।
(ii)साधारण नमक से धोने वाला सोडा (Na2CO3) का निर्माण होता है जिससे कपड़े धोये जाते हैं।
9. धातुओं का परिष्करण किस विधि द्वारा होता है ? किन-किन धातुओं के लिए इस विधि को अपनाया जा सकता है ?
उत्तर – धातुओं का परिष्करण धातुओं का शुद्धिकरण कहलाता है। ताँबा, टिन, सीसा, सोना, जिंक, क्रोमियम तथा निकेल जैसी अनेक धातुओं का परिष्करण वैद्युत अपघटन द्वारा किया जाता है। । शुद्ध धातु की पट्टी को कैथोड तथा अशुद्ध धातु की पट्टी को ऐनोड के रूप में लिया जाता है। वैद्युत अपघट्य धातु का कोई लवण लिया जाता है। जब वैद्युत अपघटन सेल से धारा प्रवाहित करते हैं तो धातु कैथोड पर जमा हो जाती है तथा ऐनोड पर स्थित अन्य अभिक्रियाशील धातुएँ, जैसे—सोना तथा चाँदी विद्युत अपघटनी सेल की तली में गिर जाती हैं, जिन्हें प्राकृतिक अवस्था में प्राप्त कर लिया जाता है।

यदि ताँबे को परिष्कृत करना हो तो विद्युत अपघटन के रूप में कॉपर सल्फेट का अम्लीकृत घोल लिया जाता है तथा सेल में होने वाली अभिक्रियाएँ निम्नलिखित होती हैं –

वैद्युत परिष्करण न केवल धातु को शुद्ध करता है, बल्कि अन्य अमूल्य धातुओं को पुनः प्राप्त करने में भी सहायक है।
10. क्या होता है जब ( केवल संतुलित समीकरण दें)
(i) कॉपर सांद्र सल्फ्यूरिक अम्ल से प्रतिक्रिया करता है।
(ii) फॉस्फोरस नाइट्रिक अम्ल से प्रतिक्रिया करता है ।
(iii) सोडियम हाइड्रॉक्साइड की अभिक्रिया सिलिकॉन से करायी जाती है।
(iv) अमोनियम क्लोराइड की प्रतिक्रिया अबुझा चूना से करायी जाती है।
उत्तर – (i) Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
(ii) 2P + 10HNO3 → 2H3PO4 + 10NO2 + 2HO
(iii) 2NaOH + Si + H2O → Na2SiO3 + H2
(iv) 2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3
11. विरंजक चूर्ण (ब्लीचिंग पाउडर) कैसे बनाया जाता है ? इसके गुण तथा उपयोग लिखिए।
उत्तर – ब्लीचिंग पाउडर का रासायनिक सूत्र CaOCl2 है। इसके निर्माण के लिए क्लोरीन गैस को शुष्क बुझे चूने में से प्रवाहित किया जाता है। चित्र में दर्शाया गया है कि नीचे से गर्म वायु तथा क्लोरीन को गुजारा जाता है जो ऊपर के निर्गम मार्ग में अभिक्रिया के पश्चात् निकल जाती है।
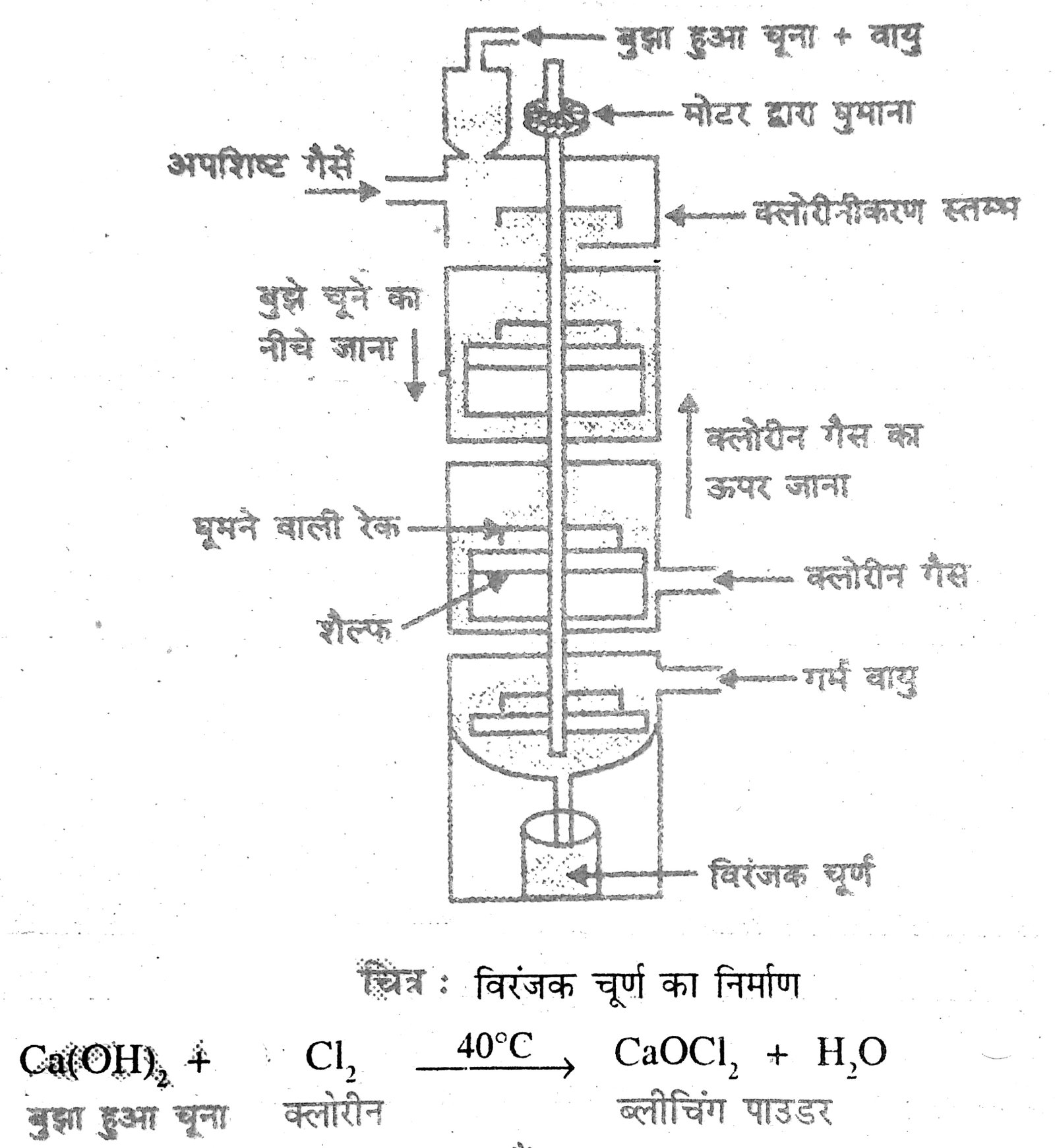
ब्लीचिंग पाउडर के गुण इस प्रकार हैं-
(i) यह श्वेत रंग का चूर्ण है जिससे क्लोरीन की गन्ध आती है।
(ii) इसे हवा में रखने पर क्लोरीन गैस मुक्त होती है
(iii) यह पानी में घुलनशील है।
(iv) यह CO2 के साथ अभिक्रिया कर क्लोरीन गैस को निष्कासित करती है।
(v) यह तनु अम्लों से क्रिया करके भी क्लोरीन गैस मुक्त करती है।
CaOCl2 + H2SO4 → CaSO4 + H2O + Cl2
(vi) तनु अम्ल की अल्प मात्रा में यह नवजात ऑक्सीजन उत्पन्न करता है जो विरंजन का कार्य करती है।
2CaOCl2 + H2SO4 → CaSO4 + 2HClO + CaCl2
HClO → HCl + O
ब्लीचिंग पाउडर के उपयोग इस प्रकार हैं
(i) सूती कपड़ों, कागज की लुगदी आदि में विरंजन का कार्य करता है ।
(ii) ऊन को धोने पर सिकुड़ने से बचाने के लिए इसका अल्प मात्रा में उपयोग किया जाता है।
(iii) यह जल को संक्रमण रहित करता है।
(iv) इसका उपयोग क्लोरोफार्म बनाने में किया जाता है ।
12. लोहे के फ्राईंग पैन को जंग से बचाने के लिए निम्न में से कौन-सी विधि उपयुक्त है ?
(a) ग्रीज लगाकर
(b) पेंट लगाकर
(c) जिंक की परत लगाकर
(d) ऊपर के सभी।
उत्तर – ऊपर दिए गए सभी तरीके लोहे को जंग से बचाने में सक्षम हैं। परंतु (a) और (b). विधि फ्राईंग पैन के लोहे के लिए उपयुक्त नहीं है क्योंकि ग्रीज और पेंट दोनों ही तत्व हैं जो गर्म करने पर जल जाते हैं। इसलिए विधि (c) का प्रयोग किया जाता है। क्योंकि जिंक लोहे से अधिक अभिक्रियाशील है इसलिए यह लोहे को जंग नहीं लगने देता। क्योंकि जिंक का गलनांक लोहे से कम होता है और यह उच्च तापमान को सहन कर सकता है, इसलिए इसका प्रयोग फ्राईंग पैन में लोहे को जंग से बचाने के लिए किया जा सकता है। अतः विधि (c) सही एवं उपयुक्त विधि है।
13. संतोष ने सल्फर चूर्ण को स्पेचुला में लेकर उसे गर्म किया तथा परखनली को उल्टाकर उसने उत्सर्जित गैस को एकत्र किया।
(a) गैस की क्रिया क्या होगी ?
(i) सूखे लिटमस पत्र पर
(ii) आर्द्र लिटमस पत्र पर।
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखिए।
उत्तर – (a) सल्फर जलने पर सल्फर डाइऑक्साइड उत्पन्न करता है।
S (s) + O2 → SO2 (g)
(i) सूखे लिटमस पत्र पर गैस की कोई भी क्रिया नहीं होगी।
(ii) गैस आर्द्र लिटमस पत्र में मौजूद जल के साथ अभिक्रिया कर सल्फ्यूरिक अम्ल उत्पन्न करेगी जो नीले लिटमस पत्र को लाल कर देगा।
(b) SO2 (g) + H2O → H2SO3 (aq0
सल्फ्यूरस
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here