Gujarat Board | Class 9Th | Science | Chemistry | Model Question Paper & Solution | Chapter – 3 Atoms and Molecules(પરમાણુઓ અને અણુઓ)
પ્રશ્નોત્તર
પ્રસ્તાવના
પ્રશ્ન 1. મહર્ષિ કણાદની પરમાણુ અંગેની અભિધારણા જણાવો. [2 ગુણ]
ઉત્તર : પ્રાચીન ભારતીય અને ગ્રીક તત્ત્વજ્ઞાનીઓ હંમેશાં દ્રવ્યના અજ્ઞાત અને અદશ્ય સ્વરૂપ વિશે આશ્ચર્યચકિત થતા રહ્યા.
→ ઈ. સ. પૂર્વે 500ની આસપાસ ભારતમાં દ્રવ્યના વિભાજનનો વિચાર કરવામાં આવ્યો.
→ ભારતીય તત્ત્વજ્ઞાની મહર્ષિ કણાદે એવી ધારણા કરી હતી કે જો દ્રવ્ય(પદાર્થ)નું સતત વિભાજન કરવામાં આવે, તો તેનું વધુ ને વધુ નાના નાના કણોમાં વિભાજન થતું રહેશે.
→ અંતે એક એવો સમય આવશે કે આ કણનું વધુ વિભાજન શક્ય બનશે નહિ, અર્થાત્ આ કણ અવિભાજ્ય રહેશે.
→ મહર્ષિ કણાદે તત્ત્વના આ અંતિમ અવિભાજ્ય સૂક્ષ્મ કણને ‘પરમાણુ’ નામ આપ્યું.
પ્રશ્ન 2. ભારતીય તત્ત્વજ્ઞાની પકુધા કાત્યાયમનું પરમાણુ માટેનું સૂચન જણાવો. [2 ગુણ]
ઉત્તર : મહર્ષિ કણાદે સૂચવેલા સિદ્ધાંતનો ઝીણવટપૂર્વક અભ્યાસ કરી પકુધા કાત્યાયમે સૂચવ્યું કે, “પરમાણુઓ સામાન્ય રીતે સંયુક્તરૂપે અસ્તિત્વ ધરાવે છે, જે દ્રવ્યનાં વિવિધ સ્વરૂપો આપે છે.’’
પ્રશ્ન 3. પ્રાચીન ગ્રીક તત્ત્વજ્ઞાનીઓનું પરમાણુ માટેનું સૂચન જણાવો. આ અભિધારણાઓની મર્યાદા જણાવો.
ઉત્તર : પ્રાચીન ગ્રીક તત્ત્વજ્ઞાનીઓ ડેમોક્રિટસ અને લ્યુસિપસે સૂચવ્યું કે જો દ્રવ્યનું વધુ ને વધુ વિભાજન કરવામાં આવે, તો અંતે પ્રાપ્ત થયેલા કણોનું વધુ વિભાજન શક્ય બનશે નહિ. આ અવિભાજ્ય કણોને તેમણે ૫૨માણુઓ કહ્યા.
મર્યાદા : આ વિચારો માત્ર માન્યતાઓ પર આધારિત હતા. તેમને માન્ય કરવા માટે કોઈ વધુ પ્રાયોગિક કાર્યો તે સમયમાં થયા ન હતા.
8.1 રાસાયણિક સંયોગીકરણના નિયમો
પ્રશ્ન 4. રાસાયણિક સંયોગીકરણ એટલે શું? રાસાયણિક સંયોગીકરણના નિયમો કયા કયા છે? [2 ગુણ]
અથવા
રાસાયણિક સંયોગીકરણ વિશે પ્રાથમિક સમજૂતી આપો.
ઉત્તર : રસાયણવિજ્ઞાનની પ્રયોગશાળામાં બે કે તેથી વધુ પદાર્થો એકબીજા સાથે રાસાયણિક પ્રક્રિયાથી સંયોજન બનાવે તેને રાસાયણિક સંયોગીકરણ કહે છે.
→ રાસાયણિક સંયોગીકરણના બે મહત્ત્વના નિયમોની રજૂઆત એન્ટોની એલ. લેવોઇઝરે અને જોસેફ એલ. પ્રાઉસ્ટે કરી હતી.
→ આ નિયમો નીચે મુજબ છે :
(1) દળ-સંચયનો નિયમ (દ્રવ્ય-સંરક્ષણનો નિયમ)
(2) નિશ્ચિત પ્રમાણનો નિયમ
3.1.1 દળ-સંચયનો નિયમ
પ્રશ્ન 5. દળ-સંચયનો નિયમ સમજાવો. [3 ગુણ]
અથવા
દ્રવ્ય-સંરક્ષણનો નિયમ સમજાવો.
ઉત્તર : નિયમ : કોઈ પણ રાસાયણિક પ્રક્રિયામાં દ્રવ્યનું સર્જન કે વિનાશ થતો નથી.
સમજૂતી : પાણીમાં x ગ્રામ લેડ નાઇટ્રેટ ઉમેરી દ્રાવણ બનાવવામાં આવે છે. આ દ્રાવણમાં ૫ ગ્રામ સોડિયમ ક્લોરાઇડ ઉમેરવામાં આવે છે. જેથી દ્રાવણમાં સફેદ અવક્ષેપ મળે છે. આ અવક્ષેપનું વજન (x + y) ગ્રામ જેટલું મળે છે, જે શરૂઆતમાં લીધેલાં દ્રાવણોના વજન જેટલું જ છે.
→ આ હકીકત દર્શાવે છે કે રાસાયણિક પ્રક્રિયા દરમિયાન દ્રવ્યનું સર્જન કે વિનાશ થતો નથી.
3.1.2 નિશ્ચિત પ્રમાણનો નિયમ
પ્રશ્ન 6. નિશ્ચિત પ્રમાણનો નિયમ લખી, ઉદાહરણ સહિત સમજાવો. [2 ગુણ]
ઉત્તર : નિયમ : રાસાયણિક પદાર્થમાં તત્ત્વો હંમેશાં દળથી નિશ્ચિત પ્રમાણમાં હાજર રહેલા હોય છે.
સમજૂતી : ( 1 ) પાણી જેવું સંયોજન અનેક સ્રોત દ્વારા મેળવી શકાય છે. પાણીનો સ્રોત કોઈ પણ હોય પરંતુ જો 9 g પાણીનું વિઘટન થાય ત્યારે હંમેશાં 1 g હાઇડ્રોજન અને 8g ઑક્સિજન ઉદ્ભવે છે. તેથી પાણીમાં હાઇડ્રોજન અને ઑક્સિજનનો દળથી ગુણોત્તર હંમેશાં 1 : 8 થાય છે.
( 2 ) એમોનિયામાં નાઇટ્રોજન અને હાઇડ્રોજનનો દળથી ગુણોત્ત૨ હંમેશાં 14 : 3 હોય છે.
પ્રશ્ન 7. ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની અભિધારણાઓ જણાવો. [3 ગુણ]
ઉત્તર : ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની અભિધારણાઓ નીચે મુજબ છે :
( 1 ) બધાં જ દ્રવ્યો ૫૨માણુના બનેલા છે, જે અતિસૂક્ષ્મ કણો છે.
( 2 ) પરમાણુ અવિભાજ્ય સૂક્ષ્મ કણ છે, જેનો રાસાયણિક પ્રક્રિયા દરમિયાન સર્જન કે વિનાશ શક્ય નથી.
( 3 ) એક જ તત્ત્વના પરમાણુઓના દળ અને રાસાયણિક ગુણધર્મો સમાન હોય છે.
( 4 ) જુદાં જુદાં તત્ત્વોના પરમાણુઓના દળ અને રાસાયણિક ગુણધર્મો જુદા જુદા હોય છે.
( 5 ) પરમાણુઓ નાની પૂર્ણાંક સંખ્યાના યોગ્ય ગુણોત્તરથી સંયોજાઈને સંયોજન (અણુ) બનાવે છે.
( 6 ) કોઈ પણ સંયોજનમાં પરમાણુઓની સાપેક્ષ સંખ્યા અને પ્રકા૨ નિશ્ચિત હોય છે.
Intext પ્રશ્નોત્તર
પ્રશ્ન 8. એક પ્રક્રિયામાં 5.3 g સોડિયમ કાર્બોનેટ 6 g ઇથેનૉઇક ઍસિડ (ઍસિટિક ઍસિડ) સાથે પ્રક્રિયા પામે છે તથા 2.2g કાર્બન ડાયૉક્સાઇડ, 0.9 g પાણી અને 8.2 g સોડિયમ ઇથેનઑએટ (સોડિયમ એસિટેટ) નીપજ મળે છે. દર્શાવો કે આ અવલોકનો દ્રવ્ય-સંચયના નિયમનું સમર્થન કરે છે. [3 ગુણ]
સોડિયમ કાર્બોનેટ + ઇથેનૉઇક ઍસિડ ; → સોડિયમ ઇથેનૉએટ + કાર્બન ડાયૉક્સાઇડ + પાણી
ઉત્તર :
પ્રશ્ન 9. પાણી બનાવવા માટે હાઇડ્રોજન અને ઑક્સિજન દળથી 1 : 8ના પ્રમાણમાં જોડાય છે, તો ૩૪ હાઇડ્રોજન વાયુ સાથે સંપૂર્ણ પ્રક્રિયા કરવા માટે ઑક્સિજનનો કેટલો જથ્થો જરૂરી છે? [2 ગુણ]
ઉત્તર : પાણી બનાવવા માટે,
1 g હાઇડ્રોજન માટે જરૂરી ઑક્સિજન = 8 g
∴ 3 g હાઇડ્રોજન માટે જરૂરી ઑક્સિજન = 8 × 3 g
= 24 g
આમ, 3 g હાઇડ્રોજન માટે જરૂરી ઑક્સિજનનું વજન 24 g
પ્રશ્ન 10. ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની કઈ અભિધારણા દ્રવ્ય-સંચયના નિયમનું પરિણામ છે? [2 ગુણ]
ઉત્તર : ‘દ્રવ્યનું સર્જન કે વિનાશ શક્ય નથી.” આ અભિધારણા દ્રવ્ય-સંચયના નિયમનું પરિણામ છે.
પ્રશ્ન 11. ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની કઈ અભિધારણા નિશ્ચિત પ્રમાણના નિયમની સમજૂતી આપે છે? [2 ગુણ]
ઉત્તર : ‘‘કોઈ પણ સંયોજનમાં પરમાણુઓની સાપેક્ષ સંખ્યા અને પ્રકાર નિશ્ચિત હોય છે.” આ અભિધારણા નિશ્ચિત પ્રમાણના નિયમની સમજૂતી આપે છે.
8.2 પરમાણુ શું છે?
પ્રશ્ન 12. પરમાણુ શું છે? સમજાવો. [2 ગુણ]
ઉત્તર : જેમ વિશાળ ઇમારતના પાયાનો એકમ ઈંટ છે તથા કીડીના દરના પાયાનો એકમ રેતીનો કણ છે, તેમ દરેક દ્રવ્યનો પાયાનો એકમ પરમાણુ છે. દ્રવ્યની રચના પરમાણુઓ દ્વારા થાય છે.
પ્રશ્ન 13. તત્ત્વમાં પરમાણુઓની ગોઠવણી કેવી હોય છે? [2 ગુણ]
ઉત્તર : આધુનિક તનિકોની મદદથી સપાટીની વિસ્તૃત તસવીર મેળવી શકાય છે.
→ સ્કેનિંગ ટનલિંગ માઇક્રોસ્કોપ(STM)ની મદદથી સિલિકોનની સપાટીની તસવીર નીચે મુજબની મેળવી શકાય છે ઃ
→ આ તસવીર પરથી કહી શકાય કે, તત્ત્વમાં ૫૨માણુઓની ગોઠવણી નિયમિત હોય છે.
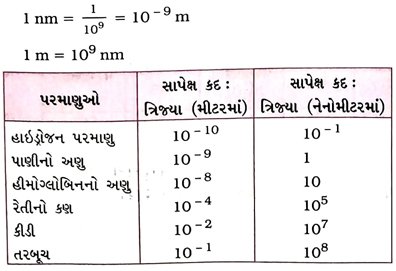
પ્રશ્ન 14, પરમાણ્વીય ત્રિજ્યાના માપન માટેનો એકમ જણાવો. જુદા જુદા પરમાણુઓની ત્રિજ્યા મીટર એકમમાં અને નેનોમીટર એકમમાં દર્શાવો. [3 ગુણ]
ઉત્તર : ૫૨માણુઓ અતિસૂક્ષ્મ હોય છે.
→ લાખો પરમાણુઓને જ્યારે એકની ઉ૫૨ એક એમ ઢગલા સ્વરૂપે ગોઠવીએ ત્યારે તે સ્તરની જાડાઈ માંડ કાગળની જાડાઈ જેટલી થાય છે.
→ પરમાણ્વીય ત્રિજ્યા નેનોમીટર (nm) એકમમાં મપાય છે.
3.2.1 વિવિધ તત્ત્વોના પરમાણુઓની આધુનિક સંજ્ઞાઓ
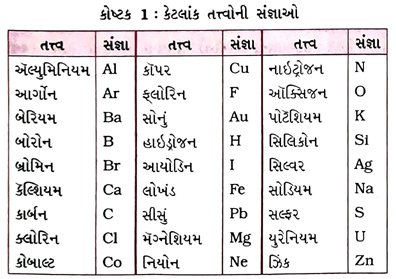
પ્રશ્ન 15. તત્ત્વની સંજ્ઞાઓનો વિશિષ્ટ રીતે ઉપયોગ કરનાર સૌપ્રથમ વૈજ્ઞાનિક કોણ હતા? ડાલ્ટન દ્વારા દર્શાવાયેલ કેટલાંક તત્ત્વોની સંજ્ઞા જણાવો. [૩ ગુણ]
ઉત્તર : તત્ત્વોની સંજ્ઞાઓનો વિશિષ્ટ રીતે ઉપયોગ કરનાર સૌપ્રથમ વૈજ્ઞાનિક ડાલ્ટન હતા.
→ તેમણે જ્યારે કોઈ તત્ત્વની સંજ્ઞાનો ઉપયોગ કર્યો ત્યારે તેમનો ઇશારો તત્ત્વના નિશ્ચિત જથ્થા તરફ હતો.
→ અર્થાત્ તત્ત્વની સંજ્ઞા એક પરમાણુને પ્રદર્શિત કરતી હતી.
→ બર્ઝેલિયસે સૂચવ્યું કે તત્ત્વોની સંજ્ઞાને તેમનાં નામના એક અથવા બે અક્ષરોથી દર્શાવી શકાય.
→ ડાલ્ટન દ્વારા દર્શાવાયેલી કેટલાંક તત્ત્વોની સંજ્ઞાઓ નીચે મુજબ છે :
પ્રશ્ન 16. પ્રાચીન સમયમાં તત્ત્વોનાં નામ કેવી રીતે અપાતાં હતાં? સમજાવો. [3 ગુણ]
ઉત્તર : શરૂઆતના (પ્રાચીન) સમયમાં તત્ત્વોનાં નામ તેમનાં પ્રાપ્તિસ્થાન કે જ્યાંથી તે સૌપ્રથમ મળ્યાં હતાં, તેનાં નામ પરથી અપાતાં હતાં.
દા. ત., કૉપરનું નામ સાયપ્રસ (Cyprus) પરથી આપવામાં આવ્યું હતું, કારણ કે કૉપર તે સ્થળેથી પ્રાપ્ત થયું હતું.
→ કેટલાંક તત્ત્વોનાં નામ તેમના વિશિષ્ટ રંગો પરથી આપવામાં આવ્યાં હતાં.
દા. ત., સોનાનું નામ ઓરમ રાખવામાં આવ્યું છે, કારણ કે, સોનાનો રંગ પીળો છે અને ઓરમનો અર્થ ‘પીળો’ થાય છે.
પ્રશ્ન 17. આધુનિક સમયમાં તત્ત્વનું નામ અને સંજ્ઞા કેવી રીતે આપવામાં આવે છે? સમજાવો. [3 ગુણ]
ઉત્તર : આધુનિક સમયમાં તત્ત્વનાં નામ અને સંજ્ઞાની મંજૂરી ‘ઇન્ટરનૅશનલ યુનિયન ઑફ પ્યોર ઍન્ડ એપ્લાઇડ કેમેસ્ટ્રી’ (International Union of Pure and Applied Chemistry – IUPAC) દ્વારા આપવામાં આવે છે.
→ મોટા ભાગનાં તત્ત્વોની સંજ્ઞા તે તત્ત્વોના અંગ્રેજી નામના એક અથવા બે અક્ષરોથી બનેલી છે.
→ કોઈ પણ તત્ત્વની સંજ્ઞાનો પ્રથમ અક્ષર હંમેશાં કૅપિટલ અક્ષરમાં અને બીજા અક્ષર હંમેશાં નાના (લઘુલિપિ – બીજી એબીસીડી) અક્ષરોમાં લખાય છે.
→ કેટલાંક તત્ત્વોની સંજ્ઞા તેમના અંગ્રેજી નામના પ્રથમ અક્ષર અને ત્યારબાદ આવતા કોઈ પણ અક્ષરને સંયુક્ત કરીને બનાવાય છે.
દા. ત., ( 1 ) ક્લોરિન (Chlorine) : Cl
( 2 ) ઝિંક (Zinc) : Zn
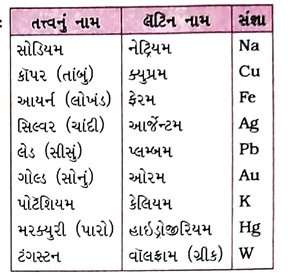
→ કેટલાંક તત્ત્વોની સંજ્ઞાઓ જે-તે તત્ત્વના લૅટિન, જર્મન અથવા ગ્રીક ભાષાના તેઓનાં નામ પરથી રાખવામાં આવે છે.
દા. ત., ( 1 ) લોખંડની સંજ્ઞા Fe, તેનાં લૅટિન નામ ફેરમ પરથી રાખવામાં આવી છે.
( 2 ) સોડિયમની સંજ્ઞા Na, તેનાં લૅટિન નામ નેટ્રિયમ પરથી રાખવામાં આવી છે.
( 3 ) ટંગસ્ટનની સંજ્ઞા W, તેનાં ગ્રીક નામ વૉલફ્રામ પરથી રાખવામાં આવી છે.
→ આમ, દરેક તત્ત્વનું એક નામ અને એક વિશિષ્ટ સંજ્ઞા હોય છે.
પ્રશ્ન 18. કેટલાંક તત્ત્વોનાં લૅટિન અથવા ગ્રીક નામ અને સંજ્ઞાઓ જણાવો. [2 ગુણ]
ઉત્તર :
3.2.2 પરમાણ્વીય દળ
પ્રશ્ન 19. ટૂંક નોંધ લખો : પરમાણ્વીય દળ [3 ગુણ]
ઉત્તર : ડાલ્ટનના મત મુજબ, દરેક તત્ત્વ લાક્ષણિક પરમાણ્વીય દળ ધરાવે છે.
→ અતિસૂક્ષ્મ કદ ધરાવતા પરમાણુનું દળ નક્કી કરવું ખૂબ જ મુશ્કેલ છે.
→ રાસાયણિક સંયોગીકરણના નિયમોના ઉપયોગ દ્વારા તેમજ ઉદ્ભવેલાં સંયોજનો દ્વારા પરમાણુનું સાપેક્ષ દળ નક્કી કરી શકાય છે.
→ શરૂઆતના સમયમાં પરમાણ્વીય દળ એકમને ટૂંકમાં amu (atomic mass unit) તરીકે દર્શાવાતો હતો. પરંતુ IUPACની ભલામણોને આધારે તેને u (યુનિફાઇડ માસ – એકીકૃત દળ) તરીકે દર્શાવવામાં આવે છે.
→ વિવિધ ૫૨માણ્વીય દળ એકમોની શોધ કરતા વૈજ્ઞાનિકોએ શરૂઆતમાં કુદરતી રીતે મળતા ઑક્સિજનના 1/16 મા ભાગના દળને એકમ તરીકે લીધું હતું.
→ ઈ. સ. 1961માં પરમાણ્વીય દળ નક્કી કરવા માટે કાર્બન-12ના સમસ્થાનિકને પ્રમાણિત સંદર્ભ તરીકે પસંદ કરવામાં આવ્યો.
→ કાર્બન-12 સમસ્થાનિકના એક પરમાણુના દળના 1/12 મા ભાગને માન્ય પરમાણ્વીય દળ એકમ તરીકે લેવાય છે.
→ કાર્બન-12 સમસ્થાનિકના એક પરમાણુના દળની સાપેક્ષે મળતા જે-તે તત્ત્વના દળને પરમાણ્વીય દળ કહે છે.
પ્રશ્ન 20. વૈજ્ઞાનિકોએ તત્ત્વનું પરમાણ્વીય દળ એકમ નક્કી કરવા ઑક્સિજનને મહત્ત્વ આપ્યું હતું. શા માટે? [2 ગુણ]
ઉત્તર : વિવિધ પરમાણ્વીય દળ એકમોની શોધ કરતા વૈજ્ઞાનિકોએ શરૂઆતમાં કુદરતી રીતે મળતાં ઑક્સિજનના 1/16 મા ભાગના દળને એકમ તરીકે લીધું. 16
→ નીચે દર્શાવેલાં કારણોને લીધે મહત્ત્વ આપવામાં આવ્યું :
( 1 ) ઑક્સિજન અનેક તત્ત્વો સાથે પ્રક્રિયા કરી સંયોજનો બનાવે છે.
( 2 ) આ પરમાણ્વીય દળ એકમ દ્વારા મહત્તમ તત્ત્વોના ૫૨માણ્વીય દળ પૂર્ણાંક સ્વરૂપે પ્રાપ્ત થાય છે.
3.2.3 પરમાણુ કેવી રીતે અસ્તિત્વ ધરાવે છે?
પ્રશ્ન 21. સામાન્ય રીતે પરમાણુ કયા સ્વરૂપે અસ્તિત્વ ધરાવે છે? [2 ગુણ]
ઉત્તર : મોટા ભાગનાં તત્ત્વોના પરમાણુઓ સ્વતંત્રરૂપે અસ્તિત્વ ધરાવતાં નથી.
→બે કે તેથી વધુ પરમાણુઓ એકબીજા સાથે રાસાયણિક બંધથી જોડાઈ અણુ અથવા આયનની રચના કરે છે.
→ આ અણુ અથવા આયન વધુ સંખ્યામાં જોડાઈને દ્રવ્ય બનાવે છે.
→ પરમાણુના આ સ્વરૂપને આપણે જોઈ શકીએ, અનુભવી શકીએ અથવા સ્પર્શ કરી શકીએ છીએ.
Intext પ્રશ્નોત્તર
પ્રશ્ન 22. પરમાણ્વીય દળ એકમને વ્યાખ્યાયિત કરો. [2 ગુણ]
ઉત્તર : કાર્બન-12 સમસ્થાનિકના એક પરમાણુના દળના 1/12 મા ભાગને પરમાણ્વીય દળ એકમ કહે છે.
→ તેને ‘u’સંજ્ઞા વડે દર્શાવવામાં આવે છે.
પ્રશ્ન 23. કોઈ એક પરમાણુને નરી આંખે જોવો શા માટે શક્ય નથી? [1 ગુણ]
ઉત્તર : દરેક તત્ત્વનો પરમાણુ અતિસૂક્ષ્મ હોવાથી નરી આંખે જોઈ શકાતો નથી.
3.3 અણુ શું છે?
પ્રશ્ન 24. સમજાવો : અણુ [2 ગુણ]
અથવા
અણુ વિશે સામાન્ય માહિતી આપો.
ઉત્તર : સામાન્ય રીતે બે કે તેથી વધુ તત્ત્વોના રાસાયણિક સંયોગીકરણથી પરમાણુઓ સંયોજાય છે, ત્યારે તેમાં પરમાણ્વીય પ્રમાણની સંખ્યા સાદા પૂર્ણાંકમાં હોય છે. આવા પરમાણ્વીય સંયોજનથી બનતા નાનામાં નાના કણને અણુ કહે છે.
→ અણુ તત્ત્વ અથવા સંયોજનનો નાનામાં નાનો કણ છે, જે સામાન્ય પરિસ્થિતિઓમાં સ્વતંત્ર રીતે અસ્તિત્વ ધરાવે છે અને પદાર્થના તમામ ગુણધર્મો દર્શાવે છે.
→ એક જ તત્ત્વના પરમાણુઓ અથવા જુદા જુદા તત્ત્વોના પરમાણુઓ પરસ્પર સંયોજાઈને અણુ બનાવે છે.
3.3.1 તત્ત્વના અણુઓ
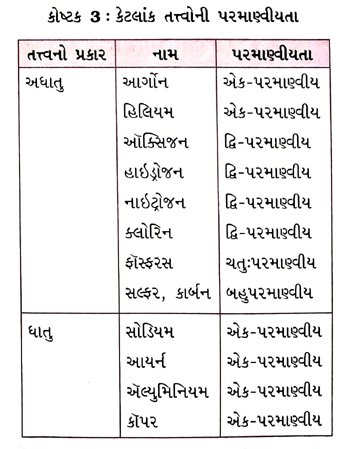
પ્રશ્ન 25. ટૂંક નોંધ લખો : પરમાણ્વીયતા [૩ ગુણ]
ઉત્તર : કેટલાંક અધાતુ તત્ત્વોના અણુ એક જ પરમાણુ દ્વારા બને છે. દા. ત., આર્ગોન (Ar), હિલિયમ (He)
→ મોટા ભાગનાં અધાતુ તત્ત્વોના અણુઓ એક કરતાં વધુ પરમાણુ દ્વારા બને છે. દા. ત., ઑક્સિજનનો એક અણુ ઑક્સિજનના બે પરમાણુઓથી બનેલો છે. તેથી જ તે દ્વિ-પરમાણ્વીય અણુ (O2) તરીકે જાણીતો છે. જો ઑક્સિજનના 2 પરમાણુના બદલે ૩ પરમાણુઓ સંયોજાય, તો ઓઝોન (O3) મળે છે.
→ ધાતુઓ અને કાર્બન જેવાં અન્ય તત્ત્વો સરળ બંધારણ ધરાવતા નથી. તેમાં મોટી અને અનિશ્ચિત સંખ્યામાં પરમાણુઓ એક્બીજા સાથે બંધથી જોડાયેલા હોય છે.
→ કોઈ પણ અણુના બંધારણમાં રહેલા પરમાણુઓની સંખ્યાને તે અણુની ૫૨માણ્વીયતા કહે છે.
3.3.2 સંયોજનના અણુઓ
પ્રશ્ન 26. સંયોજનનો અણુ એટલે શું? [2 ગુણ
ઉત્તર : જુદાં જુદાં તત્ત્વોના પરમાણુઓ એક નિશ્ચિત પ્રમાણમાં એકબીજા સાથે જોડાઈને જે અણુનું નિર્માણ કરે છે, તેને સંયોજનનો અણુ કહે છે.
દા. ત., પાણી (H2O), એમોનિયા (NH3) અને કાર્બન ડાયૉક્સાઇડ (CO2)
3.3.3 આયન એટલે શું?
પ્રશ્ન 27. આયન એટલે શું? તેમનું વર્ગીકરણ કરો. [3 ગુણ]
ઉત્તર : ધાતુ અને અધાતુયુક્ત સંયોજનો વીજભારિત ઘટકો(સ્પીસિઝ)ના બનેલા હોય છે. આ વીજભારિત ઘટકોને આયનો કહે છે.
→ આયનનું વર્ગીકરણ નીચે મુજબ કરવામાં આવે છે :
પ્રશ્ન 28. આયનીય સંયોજનો એટલે શું? ઉદાહરણ આપો. [2 ગુણ]
ઉત્તર : પરસ્પર ધન વીજભારિત અને ઋણ વીજભારિત આયનોના આકર્ષણ બળ દ્વારા જોડાઈને બનતાં સંયોજનોને આયનીય સંયોજનો કહે છે.
પ્રશ્ન 29. કેટલાક આયનોનાં નામ અને સંજ્ઞાઓ જણાવો. [3 ગુણ]
ઉત્તર : કેટલાક આયનોનાં નામ અને સંજ્ઞાઓ નીચે કોષ્ટક 6માં દર્શાવ્યા છે :
3.4 રાસાયણિક સૂત્રો લખવાં
પ્રશ્ન 30. સંયોજકતા એટલે શું? તેનું મહત્ત્વ જણાવો. [2 ગુણ]
ઉત્તર : કોઈ પણ તત્ત્વની બીજા તત્ત્વ સાથે સંયોજાવાની સાપેક્ષ શક્તિ(ક્ષમતા)ને તે તત્ત્વની સંયોજકતા કહે છે.
મહત્ત્વ : કોઈ એક તત્ત્વના પરમાણુઓ અન્ય તત્ત્વના પરમાણુઓ સાથે સંયોજાઈને કેવી રીતે સંયોજન બનાવે છે, તે સંયોજકતાના આધારે નક્કી કરી શકાય છે.
પ્રશ્ન 31. રાસાયણિક સૂત્ર એટલે શું? રાસાયણિક સૂત્ર લખતી વખતે કયા નિયમોનું પાલન કરવું જોઈએ? [3 ગુણ]
ઉત્તર : કોઈ પણ સંયોજનના બંધારણના સાંકેતિક નિરૂપણને રાસાયણિક સૂત્ર કહે છે.
→ જુદાં જુદાં સંયોજનોનાં રાસાયણિક સૂત્રો સરળતાથી લખી શકાય છે.
→ આ માટે તત્ત્વોની સંજ્ઞાઓ અને તેઓની સંયોજાવાની ક્ષમતાનો ખ્યાલ હોવો જરૂરી છે.
→ રાસાયણિક સૂત્રો લખતી વખતે નીચે દર્શાવેલ નિયમોનું પાલન કરવું જરૂરી છે :
(1) આયનની સંયોજકતા અથવા વીજભાર સંતુલિત હોવા જોઈએ.
(2) કોઈ સંયોજન ધાતુ અને અધાતુ બંને ધરાવતું હોય, તો પ્રથમ ધાતુની સંજ્ઞા અથવા નામ લખાય છે. દા. ત., કૅલ્શિયમ ઑક્સાઇડ (CaO), સોડિયમ ક્લોરાઇડ (NaCl), આયર્ન સલ્ફાઇડ (FeS), કૉપર ઑક્સાઇડ (CuO) વગેરે. અહીં કૅલ્શિયમ, સોડિયમ, આયર્ન અને કૉપર ધાતુઓ છે અને તેઓને ડાબી તરફ લખાય છે. જ્યારે ઑક્સિજન, ક્લોરિન અને સલ્ફર અધાતુઓ છે અને તેઓને જમણી તરફ લખાય છે.
(3) બહુપરમાણ્વીય આયનો દ્વારા બનતાં સંયોજનોમાં આયનને કૌંસમાં દર્શાવી કૌંસની બહાર તેનો ગુણોત્તર દર્શાવતી સંખ્યા લખાય છે.
→ જો બહુપરમાણ્વીય આયનની સંખ્યા એક હોય, તો કૌંસ દર્શાવવો જરૂરી નથી. દા. ત., NaOH
→ પરંતુ જો બહુપરમાણ્વીય આયનની સંખ્યા એકથી વધુ હોય, તો કૌંસ દર્શાવવો જરૂરી છે. દા. ત., (NH4)2SO4
3.4.1 સાદાં સંયોજનોનાં સૂત્રો
પ્રશ્ન 32. દ્વિઅંગી સંયોજનો એટલે શું? આ સંયોજનોનાં સૂત્રો કેવી રીતે લખવામાં આવે છે? [૩ ગુણ]
ઉત્તર : બે જુદાં જુદાં તત્ત્વોથી બનતાં સૌથી સરળતમ સંયોજનોને દ્વિઅંગી સંયોજનો કહે છે.
→ સંયોજનોનાં રાસાયણિક સૂત્રો લખવા માટે તે ઘટક તત્ત્વોની સંજ્ઞાની નીચે સંયોજકતા લખવામાં આવે છે.
→ ત્યારબાદ સંયોજાતા પરમાણુઓની સંયોજકતાનો ક્રૉસ કરવામાં આવે છે. દા. ત.,
પ્રશ્ન 33. આયનીય સંયોજનોનાં સૂત્રો કેવી રીતે લખવામાં આવે છે? ઉદાહરણ આપી સમજાવો. [2 ગુણ]
ઉત્તર : આયનીય સંયોજનોનાં સૂત્રો એ તેમના બંધારણમાં રહેલા ધન આયન અને ઋણ આયનના ગુણોત્તર દર્શાવતી પૂર્ણાંક સંખ્યા વડે લખવામાં આવે છે.
ઉદાહરણ : મૅગ્નેશિયમ ક્લોરાઇડનું સૂત્ર જાણવા સૌપ્રથમ આપણે ધનાયનની સંજ્ઞા (Mg2+) લખીએ છીએ. ત્યારબાદ ણાયનની સંજ્ઞા (Cl–) લખીએ છીએ. ત્યારબાદ આ આયનોને ત્રાંસા તીર દ્વારા જોડીને રાસાયણિક સૂત્ર મેળવીએ છીએ.
→ મૅગ્નેશિયમ ક્લોરાઇડનું સૂત્રઃ
તેથી મૅગ્નેશિયમ ક્લોરાઇડનું રાસાયણિક સૂત્ર MgCl2 છે.
આમ, મૅગ્નેશિયમ ક્લોરાઇડના અણુમાં પ્રત્યેક મૅગ્નેશિયમ (Mg2+) આયન માટે બે ક્લોરાઇડ (Cl–) આયનો રહેલા હોય છે.
→ અહીં ધન તેમજ ઋણ વીજભાર એકબીજાને સમતોલિત કરતાં હોવા જોઈએ અને સંપૂર્ણ બંધારણ વીજભારની દૃષ્ટિએ તટસ્થ હોવું જોઈએ.
→ રાસાયણિક સૂત્રમાં આયન પરનો વીજભાર દર્શાવવામાં આવતો નથી.
પ્રશ્ન 34. નીચેનાં સંયોજનોનાં રાસાયણિક સૂત્રો લખો : [પ્રત્યેકનો 1 ગુણ]
( 1 ) ઍલ્યુમિનિયમ ઑક્સાઇડ ( 2 ) કૅલ્શિયમ ઑક્સાઇડ ( 3 ) સોડિયમ નાઇટ્રેટ ( 4 ) કૅલ્શિયમ હાઇડ્રૉક્સાઇડ ( 5 ) સોડિયમ કાર્બોનેટ ( 6 ) એમોનિયમ સલ્ફેટ
ઉત્તર :
Intext પ્રશ્નોત્તર
પ્રશ્ન 35. રાસાયણિક સૂત્રો લખો : [2 ગુણ]
(i) સોડિયમ ઑક્સાઇડ
(ii) ઍલ્યુમિનિયમ ક્લોરાઇડ
(iii) સોડિયમ સલ્ફાઇડ
(iv) મૅગ્નેશિયમ હાઇડ્રૉક્સાઇડ
ઉત્તર :
પ્રશ્ન 36. નીચે દર્શાવેલ સૂત્રો ધરાવતાં સંયોજનોનાં નામ લખો : [2 ગુણ]
પ્રશ્ન 37. ‘રાસાયણિક સૂત્ર’ શબ્દનો અર્થ શું છે? [1 ગુણ]
ઉત્તર : સંયોજનમાં રહેલા ઘટકોનું સાપેક્ષ પ્રમાણ દર્શાવતા સૂત્રને રાસાયણિક સૂત્ર કહે છે.
પ્રશ્ન 38. નીચેનામાં કેટલા પરમાણુઓ હાજર છે? [2 ગુણ]
(i) H2S અણુ (ii) PO43- આયન
ઉત્તર : (i) H2Sમાં બે હાઇડ્રોજન અને એક સલ્ફર એમ કુલ ત્રણ પ૨માણુઓ હાજર છે.
(ii) PO43- આયનમાં એક ફૉસ્ફરસ અને ચાર ઑક્સિજન એમ કુલ પાંચ પરમાણુઓ હાજર છે.
3.5 આણ્વીય દળ અને મોલ-સંકલ્પના
3.5.1 આણ્વીય દળ
પ્રશ્ન 39. આણ્વીય દળ એટલે શું? તેનો એકમ જણાવો. [2 ગુણ]
ઉત્તર : અણુમાં રહેલા ૫૨માણુઓના પરમાણ્વીય દળનો ઉપયોગ કરી આણ્વીય દળ શોધવામાં આવે છે.
→ જો અણુનું આણ્વીય સૂત્ર જાણતા હોઈએ તો તેમાં રહેલા પરમાણુની સંખ્યાને તે પરમાણુના પરમાણ્વીય દળ વડે ગુણી તેમનો સરવાળો કરતા આણ્વીય દળ મળે છે.
→ કોઈ પણ પદાર્થનું આણ્વીય દળ તેમાં રહેલા બધા ઘટક પરમાણુઓના પરમાણ્વીય દળના સરવાળા જેટલું હોય છે.
→ આણ્વીય દળ = અણુમાં રહેલા પરમાણુઓના ૫૨માણ્વીય દળનો સરવાળો
→ આણ્વીય દળ એ અણુનું સાપેક્ષ દળ છે.
→ તેનો એકમ ‘u’ છે.
દા. ત., HClનું આણ્વીય દળ નીચે મુજબ નક્કી કરી શકાય છે :
HClનું આણ્વીય દળ = 1 (Hનું પરમાણ્વીય દળ) + 1 (Clનું પરમાણ્વીય દળ)
= 1 (1) +1 (35.5)
= 1 + 35.5
= 36.5 u
3.5.2 સૂત્ર એકમ દળ
પ્રશ્ન 40. સૂત્ર એકમ દળ એટલે શું? સમજાવો. [2 ગુણ]
ઉત્તર : કોઈ પણ પદાર્થનું સૂત્ર એકમ દળ એ પદાર્થમાં રહેલા તમામ ઘટક પરમાણુઓના ૫૨માણ્વીય દળનો સરવાળો છે.
→ પરંતુ ‘એકમ સૂત્ર’ શબ્દનો ઉપયોગ એવા પદાર્થો માટે થાય છે કે જેમાં ઘટક કણ તરીકે આયન હોય છે.
→ ટૂંકમાં, સંયોજન જ્યારે આયનીય સ્વરૂપમાં હોય ત્યારે તેના આણ્વીય દળને સૂત્ર એકમ દળ કહે છે.
→ તેનો એકમ ‘u’ છે.
→ દા. ત., સોડિયમ ક્લોરાઇડનું સૂત્ર એકમ NaCl છે. તેથી તેના સૂત્ર એકમ દળની ગણતરી નીચે મુજબ થાય છે ઃ
NaCl = 1 (Naનું પરમાણ્વીય દળ) + 1 (Clનું પરમાણ્વીય દળ)
= 1 (23) +1 (35.5)
= 23 + 35.5
= 58.5 u
Intext પ્રશ્નોત્તર
પ્રશ્ન 41. નીચેનાનાં આણ્વીય દળ ગણો : [ પ્રત્યેકનો 1 ગુણ)
H2,O2, Cl2, CO2, CH4, C2H6, C2H4, NH3, CH3OH
ઉકેલ : H૰નું આણ્વીય દળ = 2 (Hનું પરમાણ્વીય દળ)
= 2 (1) = 2 u
→ O2નું આણ્વીય દળ = 2 (Oનું પરમાણ્વીય દળ)
= 2 (16) = 32 u
→ Cl2નું આણ્વીય દળ = 2 (CIનું પરમાણ્વીય દળ)
= 2 (35.5) = 71 u
→ CO2નું આણ્વીય દળ
= 1 (Cનું પરમાણ્વીય દળ) + 2 (Oનું પરમાણ્વીય દળ)
= 1 (12) + 2 (16)
= 12 + 32 = 44 u
→ CH4(મિથુન)નું આણ્વીય દળ
= 1 (Cનું પરમાણ્વીય દળ) + 4 (Hનું પરમાણ્વીય દળ)
= 1 (12) + 4 (1)
= 16u
→ C2H6(ઇથેન)નું આણ્વીય દળ
= 2 (Cનું પરમાણ્વીય દળ) + 6 (Hનું પરમાણ્વીય દળ)
= 2 (12) + 6 (1)
= 24 + 6 = 30 u
→ C2H4 (થીન)નું આણ્વીય દળ
= 2 (Cનું પરમાણ્વીય દળ) + 4 (Hનું પરમાણ્વીય દળ)
= 2 (12) + 4 (1)
= 28 u
→ NH3(એમોનિયા)નું આણ્વીય દળ
= 1 (Nનું પરમાણ્વીય દળ) + 3 (Hનું પરમાણ્વીય દળ)
= 1 (14) + 3 (1) = 17 u
→ CH3OH(મિથેનોલ)નું આણ્વીય દળ
= 1 (Cનું પરમાણ્વીય દળ) + 4 (Hનું પરમાણ્વીય દળ) + 1 (Oનું પરમાણ્વીય દળ)
= 1 (12) + 4 (1) +1 (16)
= 32 u
પ્રશ્ન 42. ZnO, Na2O, K2CO3 માટે સૂત્ર એકમ દળની ગણતરી કરો : [પ્રત્યેકનો 1 ગુણ]
Znનું પરમાણ્વીય દળ = 65 u
Naનું પરમાણ્વીય દળ = 23 u
Kનું પરમાણ્વીય દળ = 39 u
Cનું પરમાણ્વીય દળ = 12 u
Oનું પરમાણ્વીય દળ = 16 u
ઉકેલ :
→ ZnOનું સૂત્ર એકમ દળ
= 1 (Znનું પરમાણ્વીય દળ) + 1 (Oનું પરમાણ્વીય દળ)
= 1 (65) +1 (16) = 81 u
→ Na2Oનું સૂત્ર એકમ દળ
= 2 (Naનું પરમાણ્વીય દળ) + 1 (Oનું પરમાણ્વીય દળ)
=2 (23) +1 (16) = 62 u
→ K2CO3નું સૂત્ર એકમ દળ
= 2 (Kનું પરમાણ્વીય દળ) + 1 (Cનું પરમાણ્વીય દળ) + 3 (Oનું પરમાણ્વીય દળ)
= 2 (39) +1 (12) + 3 (16)
= 78 +12 + 48 = 138 u
3.5.3 મોલ-સંકલ્પના
પ્રશ્ન 43. ટૂંકનોંધ લખો : મોલ-સંકલ્પના [3 ગુણ]
ઉત્તર : કોઈ પણ પદાર્થની માત્રા(જથ્થા)ને તેના દળ અથવા અણુઓની સંખ્યાને આધારે દર્શાવી શકાય; પરંતુ રાસાયણિક પ્રક્રિયા સમીકરણ પ્રત્યક્ષ રીતે પ્રક્રિયામાં ભાગ લેતા અણુઓ કે પરમાણુઓની સંખ્યા સૂચવે છે.
→ પદાર્થના જથ્થાને દળના સંદર્ભમાં દર્શાવવા કરતાં અણુઓ કે પરમાણુઓની સંખ્યાના સંદર્ભમાં દર્શાવવું વધુ અનુકૂળ છે.
→ આથી વૈજ્ઞાનિકોએ પદાર્થના દળ અથવા વજન અથવા જથ્થાને સંખ્યા સાથે સંબંધિત કરવા માટે એક સંક્લ્પના રજૂ કરી, જેને મોલ-સંકલ્પના કહે છે.
→ જેમ કે, 1 ડઝન = 12 નંગ,
1 કોડી = 20 નંગ,
1 ગ્રોસ = 144 નંગ
તેમ 1 મોલ = 6.022 × 1023 સંખ્યા
→ કોઈ પણ પદાર્થના 1 મોલ જથ્થામાં હાજર રહેલા ઘટકો(અણુઓ, પરમાણુઓ કે આયનો)ની સંખ્યા 6.022 × 1023 જેટલી નિશ્ચિત હોય છે. તે પ્રાયોગિક રીતે મેળવેલ મૂલ્ય છે.
→ ઇટાલિયન વૈજ્ઞાનિક એમેડિયો ઍવોગેડ્રોના માનમાં આ સંખ્યાને ઍવોગેડ્રો અચળાંક અથવા ઍવોગેડ્રો અંક કહે છે. તેને No દ્વારા દર્શાવાય છે.
→ આ મુજબ, 1 મોલ ઑક્સિજન પરમાણુ
= 6.022 × 1023 ઑક્સિજન પરમાણુની સંખ્યા
1 મોલ હાઇડ્રોજન અણુ = 6.022 × 1023 હાઇડ્રોજન અણુની સંખ્યા
1 મોલ Na↑ આયન = 6.022 × 1023 Na+ આયનોની સંખ્યા
→ ટૂંકમાં, 1 મોલ XYZ = 6.022 × 1023 XYZ કણોની સંખ્યા
→ એક મોલ એટલે 6.022 × 1023 કણો. આમ, મોલ એ સંખ્યા છે અને સંખ્યાને એકમ હોતો નથી. આથી મોલને પણ એકમ હોય નહિ.
→ મોલની સંખ્યા નક્કી કરવા જો પરમાણુ હોય તો તેનું પરમાણ્વીય દળ, અણુ હોય તો તેનું આણ્વીય દળ, આયન હોય તો તેનું આમીય દળ, સંયોજન હોય તો તેનું સંયોજનળ તેના સૂત્ર પ્રમાણ ગણી મોલની ગણતરી કરી શકાય.
→ કાવનના સ્થાયી સમાયિક -12ના પરમવીય ફળ 12 ( રહેલા પરમાણુઓની સંખ્યા 6,022 × 1023 વીકારવામાં આવેલી છે. આ સંખ્યાને મોલ કહે છે,
→ પાથના દળ પરથી કોલ અને મોલ પર વાગડો એક હાશ કણોની સંખ્યા ગણી શકાય.
છે, ચાલુની અને નો
પ્રશ્ન 14. મોલ એટલે શું? તેનો એકમ શું છે? [3 ગુપ્ત)
ઉત્તર : ઈ. સ. 1896ની આસપાસ વહેમ મોચાર્ટ મોલ’ શબ્દનો પરિચય આપ્યો. તે એક ટિન શબ્દ મોલ્સ પરથી આવેલો છે. તેનો અર્થ ‘ઢગલો’ અથવા ‘પ્પી’ થાય છે.
→ ઈ. સ. 1967માં એક એકમ તરીકે મોલની સ્વીકૃતિ થઇ. જેના દ્વારા પરમાણુઓ અને અણુઓની મોટી સંખ્યાને સરળ રીતે દર્શાવી શકાય છે.
→ રસાયણશાસ્ત્રીઓને કોઈ પણ રાસાયણિક પ્રક્રિયા કરતી વખતે અણુઓ કે પરમાણુઓની સંખ્યાની જરૂર પડે છે. તે માટે તેઓને દળનો સંબંધ ગ્રામમાં લીધેલ સંખ્યાઓ સાથે કરવો પડે, જે નીચે પ્રમાણે થઈ શકે છે :
1 મોલ = 6.022 × 1023
= ગ્રામમાં સાપેક્ષા દળ
→ આમ, રસાયણશાસ્ત્રીઓએ દર્શાવેલ ગણતરીનો એકમ મૌલ છે. તેને કોઈ એકમ નથી.
પ્રશ્ન 45. સમજાવો : મોલર દળ [3 ગુણ)
ઉત્તર : કોઈ પણ પદાર્થના । મોલ જથ્થાનું દળ એ ગ્રામમિ દર્શાવેલું તેનું સાપેક્ષા પરમાણ્વીય દળ કે આણ્વીય દળ છે.
→ પદાર્થનું પરમાણ્વીય દળ એ એક પરમાણુનું દળ છે, પરમાણ્વીય દળનો એકમ ‘u’ છે.
→ પદાર્થના એક મોલ પરમાણુઓના દળને મોલ૨ દળ કહે છે.
→ તેનો એકમ ‘u’ ને બદલે ‘હુ દર્શાવવામાં આવે છે.
→ પરમાણુના આણ્વીય દળને ગ્રામ પરમાણ્વીય દળ પણ કહે છે.
દા. ત., હાઇડ્રોજનનું પરમાણ્વીય દળ = 1 u
∴ હાઇડ્રોજનનું ગ્રામ પરમાણ્વીય દળ = 1 g
→ 1 u હાઇડ્રોજન માત્ર એક જ હાઇડ્રોજન પરમાણુ ધરાવે છે, જ્યારે 1 g હાઇડ્રોજન 1 મોલ પરમાણુ એટલે કે 6.022 × 1023 જેટલા હાઇડ્રોજન પરમાણુઓ ધરાવે છે.
→ 16u ઑક્સિજન માત્ર એક જ ઑક્સિજન પરમાણુ ધરાવે છે, જ્યારે 16 g આઑક્સિજન 1 મોલ પરમાણુ એટલે કે 6.022 × 1023 જેટલા ઑક્સિજન પરમાણુઓ ધરાવે છે.
સ્વાધ્યાયના પ્રશ્નોત્તર
(1) ઑક્સિજન અને બોરોન ધરાવતા એક સંયોજનના 0.24 g નમૂનામાં 0.096 ઠ્ઠ બોરોન અને 0.144 g ઑક્સિજન હાજર છે, તો વજનથી સંયોજનના ટકાવાર પ્રમાણની ગણતરી કરો. [2 ગુણ]
ઉકેલ :
આમ, બોરોન અને ઑક્સિજન ધરાવતા સંયોજનમાં ટકાવાર પ્રમાણ અનુક્રમે 40 અને 60 છે.
(2) 8 g ઑક્સિજનમાં જ્યારે 3g કાર્બનનું દહન કરવામાં આવે ત્યારે 11 g કાર્બન ડાયૉક્સાઇડ બને છે. જ્યારે 3 g કાર્બનને 50 ઑક્સિજનમાં દહન કરવામાં આવે ત્યારે કેટલા ગ્રામ કાર્બન ડાયૉક્સાઇડ બનશે? રાસાયણિક સંયોગીકરણનો કયો નિયમ તમારા જવાબ માટે દિશા સૂચવે છે? [3 ગુણ]
ઉકેલ : કાર્બનનું ઑક્સિજનની હાજરીમાં દહન સમીકરણ નીચે મુજબ છે :
(3) બહુપરમાણ્વીય આયન એટલે શું? ઉદાહરણ આપો. [2 ગુણ]
ઉત્તર : પરમાણુઓનો સમૂહ કે જે આયનની માફક વર્તે છે, તેને બહુપરમાણ્વીય આયન કહે છે.
અથવા
એક કરતાં વધુ પરમાણુ ધરાવતા આયનને બહુપરમાણ્વીય આયન કહે છે.
(4) નીચે દર્શાવેલાં સંયોજનોનાં રાસાયણિક સૂત્રો લખો : [પ્રત્યેકનો 1 ગુણ]
(a) મૅગ્નેશિયમ ક્લોરાઇડ
(b ) કૅલ્શિયમ ઑક્સાઇડ
(c) કૉપર નાઇટ્રેટ
(d) ઍલ્યુમિનિયમ ક્લોરાઇડ
(e) કૅલ્શિયમ કાર્બોનેટ
ઉત્તર :
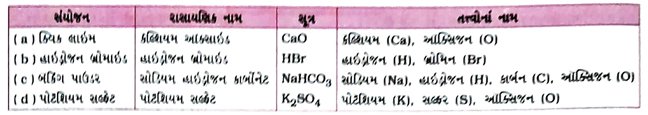
(5) નીચે દર્શાવેલાં સંયોજનોમાં હાજર રહેલ તત્ત્વોનાં નામ જણાવો : [ પ્રત્યેકનો 1 ગુણ
(a ) ક્વિક લાઇમ
(b) હાઇડ્રોજન બ્રોમાઇડ
(c) બૅકિંગ પાઉડર
(d) પોટૅશિયમ સલ્ફેટ
ઉત્તર :
હેતુલક્ષી પ્રશ્નોત્તર
પ્રશ્ન 1. નીચેના પ્રશ્નોના ટૂંકમાં ઉત્તર આપો : [પ્રત્યેકનો 1 ગુણ)
(1) દળ-સંચયનો નિયમ લખો.
ઉત્તર : કોઈ પણ રાસાયણિક પ્રક્રિયામાં દ્રવ્યનું સર્જન કે વિનાશ શક્ય નથી.
(2) કયો સિદ્ધાંત દ્રવ્ય-સંચય અને નિશ્ચિત પ્રમાણના નિયમની સમજૂતી પૂરી પાડે છે?
ઉત્તર : ડાલ્ટનનો પરમાણ્વીય સિદ્ધાંત દ્રવ્ય-સંચય અને નિશ્ચિત પ્રમાણના નિયમની સમજૂતી પૂરી પાડે છે.
(3) IUPACનું પૂર્ણ નામ લખો.
ઉત્તર : ઇન્ટરનૅશનલ યુનિયન ઑફ પ્યોર ઍન્ડ એપ્લાઇડ કેમેસ્ટ્રી
(4) ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની મર્યાદા લખો.
ઉત્તર : કેન્દ્રીય પ્રક્રિયાઓ અને સમસ્થાનિકોની શોધના સંદર્ભમાં ડાલ્ટનના નિયમની મહત્તા રહેતી નથી.
(5) નિશ્ચિત સંરચનાના નિયમની મર્યાદા લખો.
ઉત્તર : સમસ્થાનિકોના સંદર્ભમાં નિશ્ચિત સંરચનાનો નિયમ લાગુ પાડી શકાતો નથી.
(6) કયા વૈજ્ઞાનિકે સૂચવ્યું કે તત્ત્વોની સંજ્ઞાને તેમનાં નામના એક અથવા બે અક્ષરોથી દર્શાવી શકાય છે?
ઉત્તર : બર્ઝેલિયસે સૂચવ્યું કે તત્ત્વોની સંજ્ઞાને તેમનાં નામના એક અથવા બે અક્ષરોથી દર્શાવી શકાય છે.
(7) પરમાણ્વીય દળ કયા સાધનની મદદથી ચોકસાઈપૂર્વક માપી શકાય છે?
ઉત્તર : દ્રવ્યમાન સ્પેક્ટ્રૉમિટર નામના સાધનની મદદથી ૫૨માણ્વીય દળ ચોકસાઈપૂર્વક માપી શકાય છે.
(8) એકમ સૂત્ર દળ કયાં સંયોજનો માટે ઉપયોગી છે?
ઉત્તર : આયનીય સંયોજનોના આણ્વીય દળ માટે એકમ સૂત્ર દળ ઉપયોગી છે.
(9) CO2માં કાર્બન અને ઑક્સિજનનો દળથી ગુણોત્તર કેટલો છે?
ઉત્તર : CO2માં કાર્બન અને ઑક્સિજનનો દળથી ગુણોત્તર = 12 : 32 = 3 : 8 છે.
(10) CO2માં કાર્બન અને ઑક્સિજનનો દળ ગુણોત્તર ૩: 8 છે, તો 6 ઠ્ઠ કાર્બન સાથે કેટલા ગ્રામ ઑક્સિજન સંયોજાઈ શકે?
ઉત્તર : CO2માં કાર્બન અને ઑક્સિજનનો દળ ગુણોત્તર ૩: હોવાથી 6 g કાર્બન સાથે 16g ઑક્સિજન સંયોજાઈ શકે.
(11) મૅગ્નેશિયમ ઑક્સાઇડમાં કેટાયન અને એનાયન અનુક્રમે જણાવો.
ઉત્તર : મૅગ્નેશિયમ ઑક્સાઈડમાં કેટાયન અને એનાયન અનુક્રમે Mg2+ અને O2- છે,
પ્રશ્ન 2. વ્યાખ્યા આપો : [પ્રત્યેકનો 1 ગુણ]
( 1 ) અણુ ( 2 ) પરમાણ્વીય દળ ( 3 ) આણ્વીય દળ ( 4 ) મોલર દળ ( 5 ) પરમાણ્વીયતા ( 6 ) સંયોજકતા ( 7 ) બહુપરમાણ્વીય આયન
ઉત્તર :
(1) અણુ : તત્ત્વ કે સંયોજનના નાનામાં નાના કણને અણુ કહે છે.
(2) પરમાણ્વીય દળ : કાર્બન-12 સમસ્થાનિકના એક પરમાણુના દળના 1/12 મા ભાગને માન્ય પરમાણ્વીય દળ કહે છે.
(3) આણ્વીય દળ : તત્ત્વ કે સંયોજનના અણુમાં રહેલા બધા પરમાણુઓના પરમાણ્વીય દળના સરવાળાને આણ્વીય દળ કહે છે.
(4) મોલર દળ : પદાર્થના એક મોલ જથ્થાના ગ્રામમાં દર્શાવેલા દળને મોલર દળ કહે છે.
(5) પરમાણ્વીયતા : કોઈ પણ અણુના બંધારણમાં રહેલા પરમાણુઓની સંખ્યાને તે અણુની પરમાણ્વીયતા કહે છે.
(6) સંયોજક્તા : કોઈ પણ તત્ત્વની બીજા તત્ત્વ સાથે સંયોજાવાની સાપેક્ષ શક્તિ(ક્ષમતા)ને તે તત્ત્વની સંયોજકતા કહે છે.
(7) બહુપરમાણ્વીય આયન ઃ પરમાણુઓનો સમૂહ કે જે આયનની માફક વર્તે છે, તેને બહુપરમાણ્વીય આયન કહે છે.
પ્રશ્ન 3. ખાલી જગ્યા પૂરો : [પ્રત્યેકનો 1 ગુણ]
(1) રાસાયણિક સંયોગીકરણના નિયમો ……… આપ્યા.
(2) એમોનિયામાં નાઇટ્રોજન અને હાઇડ્રોજનનો દળથી ગુણોત્તર ……… હોય છે.
(3) પરમાણુઓ નાની પૂર્ણાંક સંખ્યાના યોગ્ય ગુણોત્તરથી જોડાઈને સંયોજન બનાવે છે. સંયોજનના આ નાનામાં નાના ભાગને ……. કહે છે.
(4) પાણીના અણુની ત્રિજ્યા આશરે ……… m છે.
(5) હીમોગ્લોબિનના અણુની ત્રિજ્યા આશરે …….. નેનોમીટર છે.
ઉત્તર :
(1) લેવોઇઝરે
(2) 14 : 3
(3) અણુ
(4) 10−9
(5) 10
પ્રશ્ન 4. માગ્યા મુજબ ઉત્તર આપો ઃ [પ્રત્યેકનો 1 ગુણ] :
(1) મૅગ્નેશિયમ ઑક્સાઇડમાંના કેટાયન અને એનાયન અનુક્રમે જણાવો.
ઉત્તર : મૅગ્નેશિયમ ઑક્સાઇડમાં કેટાયન (ધનાયન) Mg+ અને એનાયન (ઋણાયન) O2- છે.
(2) તત્ત્વ Xનો પરમાણ્વીય ક્રમાંક અને પરમાણ્વીય દળાંક અનુક્રમે 2 અને 4 છે, તો તત્ત્વ ત્ની સંયોજકતા જણાવો.
ઉત્તર : શૂન્ય
(3) મીઠામાં રહેલાં તત્ત્વોની સંજ્ઞા જણાવો.
ઉત્તર : Na અને Cl
(7) એમોનિયમ સલ્ફેટનું આણ્વીય સૂત્ર જણાવો.
ઉત્તર : (NH4)2SO4
પ્રશ્ન 5. નીચેના દરેક પ્રશ્ન માટે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરી ઉત્તર લખો : [ પ્રત્યેકનો 1 ગુણ]
1. K2Cr2O7 ની પરમાણ્વીયતા = …….
A. 9
B. 11
C. 10
D. 12
2. ક્વિક લાઇમનું આણ્વીય સૂત્ર છે.
A. CaCl2
B. CaCO3
C. Ca(OH)2
D. CaO
3. બધા જ નિષ્ક્રિય વાયુઓની પરમાણ્વીયતા કેટલી છે?
A. એક
B. બે
C. ત્રણ
D. ચાર
4. NH3માં N પરમાણુની સંયોજકતા …….. છે.
A. 1
B. 3
C. 4
D. 5
5. ઇથેનોલનું આણ્વીય સૂત્ર C2H5OH છે, તો તેનું આણ્વીય દળ શોધો.
A. 46 u
B. 34 u
C. 34 g
D. 46 g
6. કૅડ્મિયમ તત્ત્વની સંજ્ઞા ……. છે.
A. Ca
B. Cu
C. Cd
D. Cm
7. 28 g નાઇટ્રોજન વાયુમાં નાઇટ્રોજન પરમાણુના મોલ કેટલા છે?
A. 1
B. 2
C. 2.3
D. 5
8. નીચેના પૈકી કઈ અભિધારણા ડાલ્ટનના સિદ્ધાંતની નથી?
A. પરમાણુનું સર્જન કે વિનાશ શક્ય નથી.
B. જુદાં જુદાં તત્ત્વોના ૫૨માણુઓ જુદા જુદા કદ, દળ અને રાસાયણિક વર્તણૂક ધરાવે છે.
C. એક જ તત્ત્વના પરમાણુઓ એક જ પ્રમાણમાં જોડાઈને અનેક સંયોજનો રચી શકે છે.
D. પરમાણુ એ અતિસૂક્ષ્મ અવિભાજ્ય કણ છે.
9. ઓઝોન, સલ્ફર, ફૉસ્ફરસ અને હિલિયમની પરમાણ્વીયતા અનુક્રમે જણાવો.
A. 8, 3, 4, 1
B. 1, 3, 4, 8
C. 4, 1, 8, 3
D. 3, 8, 4, 1
10. થરમૉમીટરમાં વપરાતી ધાતુની સંજ્ઞા …….. છે.
A. Ag
B. Hg
C. Mg
D. Sg
11. નીચેના પૈકી કયા તત્ત્વનું પરમાણ્વીય દળ અને આણ્વીય દળ સમાન છે?
A. નાઇટ્રોજન
B. નિયૉન
C. ઑક્સિજન
D. ક્લોરિન
12. હાઇડ્રોજન પેરૉક્સાઇડ(H2O2)માં હાઇડ્રોજન અને ઑક્સિજનનું દળથી પ્રમાણ …….. છે.
A. 1 : 8
B. 1 : 16
C. 8 : 1
D. 16 : 1
ઉત્તર :
1. 11
2. CaO
3. એક
4. 3
5. 46 u
6. Cd
7. 2
8. એક જ તત્ત્વના પરમાણુઓ એક જ પ્રમાણમાં જોડાઈને અનેક સંયોજનો રચે છે.
9. 3, 8, 4, 1
10. Hg
11. નિયૉન
12. 1 : 16
મૂલ્યો આધારિત પ્રશ્નોત્તર (Value Based Questions with Answers)
(1) મોટા ભાગના લોકો ઘરગથ્થુ વપરાશમાં આયોડિનયુક્ત મીઠાનો ઉપયોગ કરે છે. જ્યારે કેટલાક લોકો આયોડિનયુક્ત મીઠાનો ઉપયોગ કરતા નથી. આ લોકોમાં આયોડિનની ઊણપ રહે છે. જેથી તેઓ ગૉઇટર અને થાઇરૉઇડથી પીડાય છે. આયોડિન દરિયાઈ ક્ષારમાં હોય છે.
(a) શા માટે આયોડિનયુક્ત મીઠાનો ઉપયોગ કરવો જોઈએ?
(b) આયોડિન ધાતુ કે અધાતુ તત્ત્વ છે?
(c) આયોડિનની (મૌતિક સ્થિતિ અને રંગ જણાવો.
(d) હાઇપોથાઇરૉડિઝમનો અર્થ શું છે?
ઉત્તર :
(a) આયોડિનની ઊણપથી ગૉઇટર અને થાઇરૉઇડનો રોગ થાય છે. આથી આયોડિનયુક્ત મીઠાનો ઉપયોગ કરવો જોઈએ.
(b) આયોડિન અધાતુ તત્ત્વ છે.
(c) તે જાંબલી રંગનો ઘન પદાર્થ છે.
(d) હાઇપોથાઇરૉડિઝમ એ થાઇરૉક્સિન અંતઃસ્રાવની ઊણપથી થતો રોગ છે. જેનાથી વ્યક્તિનું વજન સતત વધે છે.
(2) હીમોગ્લોબિનમાં આયર્ન તત્ત્વ આવેલું છે, જે આપણા શરીરમાં અક્સિજનવાહક તરીકેનું કાર્ય કરે છે. તેની ઊણપથી એનેમિયાનો રોગ થાય છે, આયર્ન આપણને ખોરાક દ્વારા મળી રહે છે.
(a) આયર્નયુક્ત ફળનાં નામ જણાવો.
(b) આયર્નયુક્ત શાકભાજીનું નામ જણાવો.
(c) તમે વિદ્યાર્થીઓને કેવી રીતે આયર્નયુક્ત ખોરાક લેવાનું માર્ગદર્શન આપશો?
(d) એનેમિયાથી પીડાતી વ્યક્તિ માટે કઈ દવા યોગ્ય છે?
(e) આયર્ન ધાતુ છે કે અધાતુ તે જણાવો.
ઉત્તર :
(a) સફરજન
(b) પાલક
(c) આયર્નથી થતા ફાયદાના પોસ્ટર્સ લગાવી, માર્ગદર્શન પૂરું પાડી શકાય.
(d) ફૉલિક ઍસિડ
(e) આયર્ન એ ધાતુતત્ત્વ છે.
हमसे जुड़ें, हमें फॉलो करे ..