अम्ल, भस्म तथा लवण | Class 10Th Chemistry Chapter – 2 Notes | Model Question Paper | अम्ल, भस्म तथा लवण Solutions
अम्ल, भस्म तथा लवण | Class 10Th Chemistry Chapter – 2 Notes | Model Question Paper | अम्ल, भस्म तथा लवण Solutions
अम्ल, भस्म तथा लवण (Acid, Base and Salt)
स्मरणीय तथ्य : एक दृष्टिकोण
(MEMORABLE FACTS’: APA GLANCE)
- वे यौगिक जिनके पास एक या एक से अधिक हाइड्रोजन परमाणु होते हैं और जो जलीय घोल में धन आवेशित आयन (H3O+) उत्पन्न करते हैं उन्हें अम्ल कहते हैं।
- अम्ल का जलीय विलयन स्वाद में खट्टा होता है।
- भस्म वह पदार्थ है जिसका जलीय विलयन स्वाद में कड़वा होता है तथा अम्ल को उदासीन कर लवण बनाता है।
- आरहेनियस के अनुसार अम्ल जल में घुलकर हाइड्रोजन आयन (H+) देते हैं तथा भस्म व्रत में घुलकर हाइड्रॉक्साइड आयन (OH–) देते हैं ।
- प्रबल अम्ल जल में पूर्णत: आयनित होते हैं तथा दुर्बल अम्ल जल में आंशिक रूप से आयनित होते हैं।
- अम्ल नीले लिटमस पत्र को लाल करता है तथा क्षार लाल लिटमस पत्र को नीला करता है।
- लिटमस थैलोफाइटा वर्ग के लाइकेन (lichen) पौधे से निकाला गया गुलाबी रंग का उदासीन अर्क (extract) होता है ।
- अम्ल तथा भस्म की अभिक्रिया से लवण जल बनता है।
- 6 – 8% ऐसीटिक अम्ल को सिरका कहते हैं।
- अम्ल तथा भस्म के जलीय विलयन विद्युत के सुचालक होते हैं।
- जो बेसिक हाइड्रोक्साइड जल में घुल कर हाइड्रॉक्सिल (OH–) आयन बनाते हैं उन्हें क्षार कहते हैं।
- अम्ल धातु से अभिक्रिया कर हाइड्रोजन गैस मुक्त करता है।
- जिस अम्लों को प्रायः पौधों से प्राप्त किया जाता है उन्हें कार्बनिक अम्ल कहते हैं।
- अम्ल जिन्हें खनिजों से प्राप्त किया जाता है उन्हें अकार्बनिक अम्ल कहते अम्ल धातु के कार्बोनेट एवं बाइकार्बोनेट से अभिक्रिया कर कार्बन डाइऑक्साइड देता है।
- धातु के ऑक्साइड मूलतः भस्म होते हैं ।
- अधातु के ऑक्साइड अम्लीय होते हैं।
- सांद्र अम्ल में अम्ल की अधिक मात्रा जल के अल्प मात्रा में घुली होती है।
- प्रबल अम्ल तथा प्रबल भस्म से बने लवण का जलीय विलयन उदासीन होता है।
- अम्ल, भस्म तथा लवण के जलीय विलयन विद्युत के सुचालक होते हैं।
- तनु अम्ल में अम्ल की अल्प मात्रा अधिक जल में होती है ।
- प्रबल अम्ल तथा दुर्बल भस्म से बने लवण का जलीय विलयन अम्लीय होता है।
- किसी विलयन के pH का मान उसमें उपस्थित H+ आयनों की मोलर सांद्रता के लघुगणक का ऋणात्मक मान है।
pH = –log [H+]
- किसी विलयन के pH का निर्धारण यूनिवर्सल सूचक द्वारा किया जाता है।
- दुर्बल अम्ल तथा प्रबल भस्म से बने लवण का जलीय विलयन क्षारीय होता है।
- उदासीन विलयन का pH मान 7 के बराबर, अम्लीय विलयन का pH मान 7 से कम तथा क्षारीय विलयन का pH मान 7 से अधिक होता है।
- हमारे देश में 95% साधारण नमक समुद्री जल के वाष्पीकरण द्वारा प्राप्त किया जाता है।
- बेकिंग पाउडर में खाने का सोडा (NaHCO3) तथा टार्टरिक अम्ल का मिश्रण होता है।
- खाने का सोडा (NaHCO3) तथा धोने का सोडा (Na2CO3) अमोनिया सोडा विधि या साल्वे विधि द्वारा बनाया जाता है।
- शुष्क बूझे हुए चूने [Ca(OH)2] तथा Cl2 की अभिक्रिया से विरंजक चूर्ण बनाया जाता है।
- सोडियम हाइड्रॉक्साइड क्लोर-ऐल्कली विधि द्वारा बनाया जाता है जिसमें सोडियम क्लोराइड के संतृप्त जलीय विलयन का विद्युत अपघटन किया जाता है।
- जल का स्थायी खारापन दूर करने में Na2CO3 का उपयोग किया जाता है।
अभ्यासार्थ प्रश्नो
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर ( क, ख, ग, या घ) लिखें।
1. निम्नांकित में कौन एक अम्ल है।
(क) Na2O
(ख) Ca(OH)2
(ग) CuO
(घ) HNO3
उत्तर – (घ)
2. निम्नांकित में कौन भर नहीं है ?
(क) KOH
(ख) ZnO
(ग) Al(OH)3
(घ) NaCl
उत्तर – (घ)
3. निम्नांकित में कौन लवण है ?
(क) HCl
(ख) NaCl
(ग) NaOH
(घ) KOH
उत्तर – (ख)
4. निम्नांकित में किसमें अम्ल के गुण नहीं होते ?
(क) जो लाल लिटमस पत्र को नीला करते हैं ।
(ख) जिनका स्वाद खट्टा होता है।
(ग) जो धातु से अभिक्रिया करते हैं।
(घ) जो क्षार से अभिक्रिया करते हैं।
उत्तर – (क)
5. जल में घुलनशील भस्म क्या कहलाते हैं ?
(क) अम्ल
(ख) क्षार
(ग) लवण
(घ) इनमें कोई नहीं
उत्तर – (ख)
6. कार्बन डाइऑक्साइड जल से अभिक्रिया करके बनाता है –
(क) सल्फ्यूरस अम्ल
(ख) कार्बोनिक अम्ल
(ग) सल्फ्यूरिक अम्ल
(घ) कार्बोलिक अम्ल
उत्तर – (ख)
7. ऐसीटिक अम्ल दुर्बल अम्ल है क्योंकि
(क) इसका जलीय विलयन अम्लीय है ।
(ख) यह पूर्णत: आयनित होता है।
(ग) यह आंशिक रूप से आयनित होता है।
(घ) इसमें –COOH समूह होता है।
उत्तर – (ग)
8. निम्नांकित में कौन प्रबल भस्म है ?
(क) NH4OH
(ख) NaOH
(ग) Mg(OH)2
(घ) Cu(OH)2
उत्तर – (ख)
9. निम्नलिखित किस लवण में रवाजल नहीं रहता है।
(क) नीला थोथा
(ख) बेकिंग सोडा
(ग) जिप्सम
(घ) धोनेवाला सोडा
उत्तर – (ख)
10. निम्नांकित में कौन अम्लीय ऑक्साइड है ?
(क) कैल्सियम ऑक्साइड
(ख) मैग्नीशियम ऑक्साइड
(ग) सल्फर डाइऑक्साइड
(घ) सोडियम ऑक्साइड
उत्तर – (ग)
11. निम्नांकित में कौन भास्मिक ऑक्साइड है ?
(क) CO4
(ख) Na2O
(ग) OS2
(घ) P2O2
उत्तर – (ख)
12. सोडियम सल्फेट का जलीय विलयन
(क) उदासीन होगा
(ख) क्षारीय होगा
(ग) अम्लीय होगा
(घ) बफर होगा
उत्तर – (क)
13. आरहेनियस अम्ल जलीय विलयन में
(क) [OH–] बढ़ाता है
(ख) [H+] बढ़ाता है
(ग) लवण बनाता है
(घ) इनमें कोई नहीं
उत्तर – (ख)
14. निम्नांकित में किस अवस्था में ऐसोटिक अम्ल विद्युत का संचालन करता है ?
(क) टॉलूइन के विलयन में
(ख) जल के विलयन में
(ग) किरोसिन में
(घ) इनमें कोई नहीं
उत्तर – (ख)
15. जलीय विलयन में ऐसीटिक अम्ल का आयतन
(क) नहीं होता है
(ख) आंशिक रूप में होता है
(ग) पूर्णत: होता है
(घ) अनुत्क्रमणीय होता है
उत्तर – (ख)
16. एक जलीय विलयन लाल लिटमस पत्र को नीला कर देता है। इस विलयन में निम्नलिखित में सिक अधिक मात्रा में मिलाया जाए कि वह विलयन नीले लिटमस पत्र को लाल कर दे ?
(क) हाइड्रोक्लोरिक अम्ल
(ख) सोडियम कार्बोनेट
(ग) चूना-जल
(घ) अमोनियम हाइडॉक्साइड
उत्तर – (क)
17. निम्नांकित में कौन हाइड्रॉनियम आयन है ?
(क) H3O+
(ख) H3O–
(ग) OH–
(घ) OH+
उत्तर – (क)
18. बेकिंग पाउडर का एक अवयव सोडियम बाइकोर्बोनेट है। इसका दूसरा अबवन है
(क) ऐसीटिक अम्ल
(ख) जिंक सल्फेट
(ग) टार्टरिक अम्ल
(घ) चूना-जल
उत्तर – (ग)
19. किसी विलयन के pH का मान 4 है तो विलयन
(क) अम्लीय होगा
(ख) क्षारीय होगा
(ग) उदासीन होगा
(घ) इनमें कोई नहीं
उत्तर – (क)
20. निम्नांकित में कौन विलयन प्रबल अम्लीय होगा ?
(क) pOH=4.5
(ख) pH=0
(ग) pHO=14
(घ) ‘ख’ एवं ‘ग’ दोनों
उत्तर – (घ)
21. उदासीन विलयन का pH होता है
(क) 6
(ख) 7
(ग) 8
(घ) 9
उत्तर – (ख)
22. अभिक्रिया H2O + HCl → H3O+ + Cl– में H2O का आचरण कैसा होगा ?
(क) अम्ल जैसा
(ख) भस्म जैसा
(ग) लवण जैसा
(घ) ‘क’ एवं ‘ख’ दोनों जैसा
उत्तर – (ख)
23. एक विलयन नीले लिटमस को लाल करता है तो विलयन का pH निम्नांकित में क्या होगा ?
(क) 8
(ख) 10
(ग) 12
(घ) 6
उत्तर – (घ)
24. उत्फुल्लन लवण होते हैं
(क) अनाई, लवण जो वायु के जलवाष्प को अवशोषित करते हैं।
(ख) जलयोजित लवण जो वायुमंडल में जल के अणु त्यागते हैं।
(ग) नीले लिटमस पत्र को लाल रंग में परिवर्तित करते हैं।
(घ) लाल लिटमस पत्र को नीले रंग में परिवर्तित करते हैं।
उत्तर – (ख)
25. निम्नलिखित में प्रकृति अम्लीय है ?
(क) मानव रक्त
(ख) चूना-जल
(ग) ऐंटासिड
(घ) लाइम जूस
उत्तर – (घ)
26. अगर आपको शंका है कि मिट्टी की अम्लीयता के कारण गंमले में फूल का पौधा ठीक से विकसित नहीं हो रहा है तो निम्नांकित में किस पदार्थ को मिट्टी में मिलाएँगे ?
(क) चाय पत्ती
(ख) बेकिंग पाउडर
(ग) नमक
(घ) चीनी
उत्तर – (ख)
27. नींबू के खट्टा स्वाद को खत्म करने के लिए निम्न में किसका उपयोग सबसे अधिक उपयुक्त होगा ?
(क) चीनी
(ख) एक पदार्थ जिसका pH मान 7 के बराबर हो
(ग) एक पदार्थ जिसका pH मान 6 से नीचे हो T
(घ) एक पदार्थ जिसका pH मान 8 से अधिक हो
उत्तर – (घ)
II. रिक्त स्थानों की पूर्ति करें।
1. अम्ल जलीय विलयन में ………आयन प्रदान करता है तथा भस्म …….. आयन।
उत्तर – H+, OH–
2. हाइड्रोजन आयन (H+) जल के अणुओं के साथ जुड़कर ……… आयन का निर्माण करता है।
उत्तर – H3O+
3. अम्ल तथा भस्म के अभिक्रिया से बनाए ……… जाते हैं।
उत्तर – लवण
4. जल में घुले भस्म को ……….. कहते हैं।
उत्तर – क्षार
5. 6-8% ऐसीटिक अम्ल को ………… कहते हैं।
उत्तर – सिरका
6 . लवण ……… (H+ को छोड़कर) तथा ………(OH– को छोड़कर) के बने होते हैं।
उत्तर – धनायन, ऐनायन
7. शुद्ध जल विद्युत का ………….. नहीं करते
उत्तर – संचालन
8. ऐसीटिक अम्ल के जलीय विलयन में विद्युत का संचालन ……… होता है।
उत्तर – कम
9. HCl के जलीय विलयन में विद्युत का संचालन ……….. होता है।
उत्तर – अधिक
10. वैसे पदार्थ जिनका जलीय विलयन विद्युत का संचालन करते हैं वे ………. कहलाते हैं।
उत्तर – विद्युत अपघट्य
11. वैसे पदार्थ जो जल में आयन नहीं देते वे ………… कहलाते हैं।
उत्तर – विद्युत अनपघटय
12. वैसे भस्म जो जल में पूर्णत: आयनित होते हैं वे .. ‘भस्म कहलाते हैं तथा वैसे अम्ल जो जल में आंशिक रूप से आयनित होते हैं वे……… अम्ल कहलाते हैं।
उत्तर – प्रवल, दुर्बल
13. बेकिंग पाउडर ……… तथा ………का मिश्रण होता है।
उत्तर – सोडियम बाइकार्बोनेट, टार्टरिक अम्ल
14. सक्रिय धातु अम्ल से अभिक्रिया कर ………… तथा ……….. गैस बनाते हैं।
उत्तर – लवण, हाइड्रोजन
15. NaHSO4 एक ……….. लवण होता है।
उत्तर – अम्लीय
III. सही / गलत का चयन करें।
1. ऐल्कोहॉल जल में घुलकर आयन नहीं देते।
उत्तर – सही
2. फॉस्फोरिक अम्ल प्रबल अम्ल है।
उत्तर – गलत
3. ऐंटासिड मूलत: अम्लीय होते हैं।
उत्तर – गलत
4. गृह निर्मित सूचक अस्थायी होते हैं।
उत्तर – सही
5. शुद्ध एवं शुष्क HCl गैस शुष्क नीले लिटमस पत्र को लाल करता है ।
उत्तर – गलत
6. जल की अनुपस्थिति में अम्ल विद्युत के सुचालक होते हैं।
उत्तर – गलत
7. विशुद्ध अम्ल में आयन नहीं पाए जाते ।
उत्तर – सही
8. तनु H2SO4 बनाने के लिए सांद्र H2SO4 में जल को मिलाया जाता है।
उत्तर – गलत
9. बोरिक अम्ल एक दुर्बल अम्ल है।
उत्तर – सही
10. ऐसीटिक अम्ल की शक्ति हाइड्रोक्लोरिक अम्ल की तुलना में कई गुणा अधिक होता है
उत्तर – गलत
11. उदासीन विलयन का pH शून्य होता है।
उत्तर – गलत
12. pH मान 1 उच्च अम्लीयता को दर्शाता है।
उत्तर – सही
13. NH4Cl सामान्य लवण है।
उत्तर – सही
14. NaCN का जलीय विलयन उदासीन होता है।
उत्तर – गलत
15. ईनो लवण (eno’s salt) सोडियम बाइकार्बोनेट तथा सिट्रिक अम्ल का मिश्रण होता है।
उत्तर – सही
16. सोडियम बाइकार्बोनेट का उपयोग अग्निशामक यंत्रों से किया जाता है।
उत्तर – सही
17. जल का स्थायी खारापन दूर करने के लिए Na2CO3 का उपयोग होता है।
उत्तर – सही
18. नमक एक जलयोजित लवण है।
उत्तर – गलत
अतिलघु उत्तरीय प्रश्न
1. तीन खनिज अम्ल का सूत्र लिखें।
उत्तर – (i) ऑक्सेलिक अम्ल, (ii) ऐसीटिक अम्ल, (iii) सट्रिक अम्ल ।
2. एक कार्बनिक अम्ल का सत्र लिखें।
उत्तर – कार्बनिक अम्ल (H2CO3) ।
3. सिरका में कौन-सा अम्ल होता है ?
उत्तर – सिरका में ऐसीटिक अम्ल (CH5COOH) होता है।
4. बैटरी अम्ल क्या है ?
उत्तर – बैटरी अम्ल सल्फ्यूरिक अम्ल है।
5. उस अभिक्रिया का नाम बताएँ जिसमें अम्ल तथा भस्म की अनुक्रिया से लवण तथा जल बनता है |
उत्तर – NaOH + HCl → NaCl + H2O
सोडियम हाइड्रोक्लोरिक नमक जल
डाइऑक्साइड अम्ल
6. सामान्य लवण, अम्लीय लवण तथा भास्मिक लवण के एक-एक उदाहरण लिखें।
उत्तर – सामान्य लवण के उदाहरण— Na2SO4 अम्लीय लवण के उदाहरण—NaHSO4 भास्मिक लवण के उदाहरण— Ba(OH)Cl
7. CO2 का जलीय विलयन अम्लीय होता है या भास्मिक ?
उत्तर – CO2 का जलीय विलयन अम्लीय होता है।
8. सोडियम कार्बोनेट की अभिक्रिया हाइड्रोक्लोरिक अम्ल से कराने पर कौन-सी गैस निकलती हैं ?
उत्तर – सोडियम कार्बोनेट की अभिक्रिया हाइड्रोक्लोरिक अम्ल से कराने पर कार्बन डाइऑक्साइड गैस निकलती है।
9. NH4Cl के जलीय विलयन का लिटमस पत्र पर क्या प्रभाव पड़ता है ?
उत्तर – NH4Cl का जलीय विलयन नीला लिटमस पत्र को लाल कर देता है ।
10. गृह निर्मित किन्हीं दो सूचक के नाम बताएँ ।
उत्तर – (i) लाल गोभी का पत्ता, (ii) हल्दी ।
11. दो रंगीन पदार्थ (सूचक) के नाम बताएँ जो किसी अज्ञात द्रव के क्षारीय ज अम्लीय प्रकृति बनाने में सक्षम हो।
उत्तर – (i) मेथिल ऑरेंज, (ii) फिनॉल्फ्थैलीन।
12. किस द्वार के लवण में धात्विक आयन नहीं होते हैं ?
उत्तर – अधात्विक ऑक्साइड में धात्विक आयन नहीं होते हैं।
13. निम्नलिखित अभिक्रिया को पूरा करें।
Zn + H2SO4 →
Fe + 2HCl →
उत्तर – Zn + H2SO4 → ZnSO4 +H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
14. यदि विलयन का pH मान 3 है तो विलयन की प्रकृति क्या होगी ?
उत्तर – यदि विलयन का pH मान 3 है तो विलयन अम्लीय होगी।
15. pH मान 6 तथा pH मान 2 वाले विलयन में अधिक अम्लीय कौन है ?
उत्तर – pH मान 2 वाला विलयन अधिक अम्लीय होगा।
16. क्या pH मान 8 वाले विलयन जल से अधिक भास्मिक होंगे ?
उत्तर – हाँ, pH मान 8 वाले विलयन जल से अधिक भास्मिक होंगे।
17. निम्नांकित में अम्लीय लवण, भास्मिक लवण तथा उदासीन लवण को चुनें।
NaCl, NaHCO3, Mg(OH)Cl
उत्तर – अम्लीय लवण → NaHCO3
भास्मिक लवण → Mg(OH)Cl
उदासीन लवण → NaCl
18. निम्नलिखित अभिक्रिया को पूरा करें।
Zn + NaOH →
CaSO4 + NaOH →
उत्तर – Zn + NaOH → Na2ZnO2 + H2
CaSO4 + NaOH → Ca(OH)2 + Na2SO4
19. जस्ता तथा तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया से अम्ल का कौन-सा तत्व धातु से विस्थापित होता है ?
उत्तर – जस्ता तथा तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया से अम्ल का हाइड्रोजन तत्व धातु से विस्थापित होता है।
20. एक सूचक का नाम बताएँ जो विलयनों में विभिन्न हाइड्रोजन आयन (H+) की सान्द्रता के स्तर को बताने में सक्षम हो।
उत्तर – फिनाल्पथैलिन ।
21. प्रयोगशाला में निर्मित एक गैस जल में घुलनशील है। इसके जलीय विलयन में फिनॉल्फ्थैलीन सूचक का एक बूँद डालने से विलयन का रंग गुलाबी हो जाता है, तो विलयन किस प्रकृति का है ?
उत्तर – क्षारीय ।
22. रवाकरण-जल की अवस्था में वाशिंग सोडा (धोने का सोडा) एवं तूतिया का रासायनिक सूत्र बताएँ।
उत्तर – वाशिंग सोडा — Na2CO3 · 10H2O
तूतिया — CuSO4 · 5H2O
23. क्या होता है जब तनु सल्फ्यूरिक अम्ल का ठोस सोडियम कार्बोनेट में मिलाते हैं ?
उत्तर – जब तनु सल्फ्यूरिक अम्ल को ठोस सोडियम कार्बोनेट में मिलाते हैं तो सोडियम सल्फेट, जल तथा कार्बन डाइ ऑक्साइड गैस प्राप्त हेता है।
24. किसी विलयन में H+ जलीय आयनों की सांद्रता बढ़ाने पर उस विलयन के pH मान पर क्या प्रभाव पड़ता है ?
उत्तर – किसी विलयन में H+ जलीय आयनों की सांद्रता बढ़ाने पर उस विलयन का pH मान बढ़ता है।
25. वायुमंडल में जल के अणु त्यागने वाले जलयोजित लवण क्या कहलाते
उत्तर – अम्लीय लवण ।
26. पौधों के संतोषजनक वृद्धि के लिए मिट्टी के pH का मान कितना होना चाहिए ?
उत्तर – संतोषजनक वृद्धि लिए मिट्टी के pH का मान 7 होना चाहिए।
27. दो सूचक का नाम लिखें।
उत्तर – लिटमस, मेथिलऑरेंज।
28. साधारण नमक में किस यौगिक को मिलाकर आयोडीन युक्त नमक बनाया जाता है ?
उत्तर – साधारण नमक में KIO3 या KI की थोड़ी-सी मात्रा मिलाकर आयोडीन नमक प्राप्त किया जाता है। का सूत्र लिखें।
29. एक प्रस्वेद्य लवण
उत्तर – NaCl
30. अम्ल जल में क्या प्रदान करता है ?
उत्तर – H+ आयन प्रदान करते हैं ।
लघु उत्तरीय प्रश्न
1. निम्नलिखित में कौन-से अम्ल पाए जाते हैं ?
निम्बू रस, इमली, सिरका, विटामिन C की गोली, खट्टा दूध ।
उत्तर – इदार्थ उपस्थित अम्ल
निम्बू का रस सिट्रिक अम्ल
इमली टार्टरिक अम्ल
सिरका ऐसीटिक अम्ल
विटामिन C की गोली एस्कोर्बिक अम्ल
खट्टा दूध लैक्टिक अम्ल
2. क्या होता है जब
(i) तनु सल्फ्यूरिक अम्ल की अभिक्रिया जस्ता से होती है।
(ii) तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया मैग्नीशियम से होती है।
(iii) तनु सल्फ्यूरिक अम्ल की अभिक्रिया ऐल्युमीनियम के साथ होती है।
(iv) तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया लोहा से होती है।
उत्तर – (i) जब तनु सल्फ्यूरिक अम्ल को जस्ता से अभिक्रिया कराया जाता है तो जिंक सल्फेट या लवण तथा हाइड्रोजन गैस बनता है।
Zn + H2SO4 → ZnSO4 + H2 ↑
जिंक सल्फ्यूरिक अम्ल जिंक सल्फेट
(ii) जब तनु हाइड्रोक्लोरिक अम्ल को मैग्नीशियम से अभिक्रिया कराया जाता है तो मैग्नीशियम क्लोराइड का लवण तथा हाइड्रोजन गैस बनता है ।
Mg + 2HCl → MgCl2 + H2 ↑
मैग्नीशियम हाइड्रोक्लोरिक अम्ल मैग्नीशियम क्लोराइड
(iii) जब तनु सल्फ्यूरिक अम्ल की अभिक्रिया ऐल्युमीनियम के साथ कराया जाता है तब ऐल्युमीनियम सल्फेट का लवण के रूप में प्राप्त होता है तथा हाइड्रोजन गैसें निकलता है।
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑
ऐल्युमीनियम सल्फ्यूरिक अम्ल ऐल्युमीनियम सल्फेट
(iv) जब लोहा को तनु सल्फ्यूरिक अम्ल से अभिक्रिया कराया जाता है तो फेरस सल्फेट का लवण तथा हाइड्रोजन गैस मुक्त होता है।
2Fe + H2SO4 → Fe2SO4 + H2 ↑
सल्फ्यूरिक अम्ल फेरस सल्फेट
3. ऐसीटिक अम्ल एक दुर्बल अम्ल है तथा अमोनिया एक दुर्बल भस्म है। यहाँ दुर्बल शब्द का क्या तात्पर्य है ?
उत्तर – वैसे अम्ल जो जल में घुलकर सिर्फ आशिक रूप में ही आयनित होते हैं। दुर्बल अम्ल कहलाते हैं। जबकि वे भस्म जो जलीय विलयन में सिर्फ अंशतः आयनित होकर कम मात्रा में हाइड्रोक्साइड आयन (OH–) प्रदान करते हैं दुर्बल भस्म या क्षार कहलाते हैं। दुर्बल अम्ल आशिक रूप से आयनित होने के कारण इनके जलीय विलयन में H+ आयनों की संख्या अपेक्षाकृत कम होती है। इस कारण इसकी विद्युत चालकता कम होती है।
4. (i) प्रबल अम्ल तथा सांद्र अम्ल में भेद बतायें।
उत्तर – प्रबल अम्ल-वे अम्ल जो जल में घुलकर लगभग पूर्णतः आयनित होकर हाइड्रोजन आयन (H+) प्रदान करते हैं, प्रबल अम्ल कहलते हैं। उदाहरण के लिये, हाइड्रोक्लोरिक अम्ल (HCl), नाइट्रिक अम्ल (HNO3) और सल्फ्यूरिक अम्ल (H2SO4) प्रबल अम्ल हैं।
सांद्र अम्ल जब विलयन में अम्ल की मात्रा अधिक होती है तो उसे सांद्र अम्ल या विलयन कहते हैं।
प्रबल अम्ल तथा सांद्र अम्ल में अन्तर इस प्रकार है

(ii) प्रबल भस्म तथा दुर्बल भस्म में भेद बतायें।
उत्तर – प्रबल भस्म तथा दुर्बल भस्म के भेद हैं –

5. कार्बोनेट का उदासीनीकरण ऑक्साइड तथा हाइड्रॉक्साइड के उदासीनीकरण से भिन्न कैसे होता है ?
उत्तर – अम्ल एवं क्षारक की अभिक्रिया के परिणामस्वरूप लवण तथा जल प्राप्त होते हैं तथा इसे उदासीनीकरण अभिक्रिया कहते हैं। सामान्यतः उदासीनीकरण अभिक्रिया को इस प्रकार लिख सकते हैं –
क्षारक + अम्ल → लवण + जल
सोडियम हाइड्रोजन कार्बोनेट गर्म करने पर सोडियम कार्बोनेट, कार्बन डाइऑक्साइड और जल में विघटित हो जायेगा। ये अम्लीय प्रकृति के होते हैं।
क्षारक एवं अम्लं की अभिक्रिया के समान ही धात्विक ऑक्साइड अम्ल के साथ अभिक्रया करके लवण एवं जल प्रदान करते हैं। अतः धातु ऑक्साइड और क्षारकीय ऑक्साइड भी कहते हैं।
कैल्सियम हाइड्रॉक्साइड जो एक क्षारक है, कार्बन डाइऑक्साइड के साथ अभिक्रिया करके लवण एवं जल का निर्माण करता है। चूँकि यह क्षारक एवं अम्ल के बीच होने वाली अभिक्रिया के समान है। अतः हम यह निष्कर्ष निकाल सकते हैं कि अधात्विक ऑक्साइड अम्लीय प्रकृति के होते हैं। इस प्रकार उपरोक्त कथनों से यह स्पष्ट होता है कि कार्बोनेट का उदासीनीकरण ऑक्साइड तथा हाइड्रॉक्साइड के उदासीनीकरण से भिन्न होता है।
6. pH प्रतीक में p तथा H क्या संकेत करते हैं ? pH – स्केल क्या सूचित करते हैं ?
उत्तर – साधारण सूचक द्वारा अम्ल तथा भस्म की पहचान तो हो जा सकती है, लेकिन यह कदापि नहीं कहा जा सकता है कि अम्ल या भस्म कितना प्रबल है। अम्ल की शक्ति उसके H+ आयन प्रदान करने की क्षमता पर निर्भर करती है। अतः किसी विलयन की अम्लीय शक्ति उसमें उपस्थित H+ आयन पर निर्भर करती है। किसी विलयन में H+ आयन सांद्रण के निर्धारण के लिये सौरेंसन (1909) ने एक स्केल दिया जिसे pH स्केल कहा जाता है।
pH स्केल से स्पष्ट है कि उदासीन विलयन का pH मान 7 के बराबर, अम्लीय विलयन का pH मान 7 से अधिक होता है, उदाहरणार्थ- pH मान 1 उच्च अम्लीयता को दर्शाता है, pH मान 3 उससे कम अम्लीयता को तथा pH मान 6 बहुत कम अम्लीयता को दर्शाता है | pH का मान 7 से अधिक विलयन की क्षारीयता को दर्शाता है।
pH प्रतीक (Symbol) में p की व्युत्पत्ति शब्द portenz से हुयी है जिसका अर्थ शक्ति (power) होता है। इस प्रकार pH का मान (Value) विलयन में हाइड्रोजन आयन की शक्ति को निरूपित करता है। अतः किसी विलयन के pH का मान उसमें उपस्थित H+ आयनों की सांद्रता के लघुगणक (logarithm) का ऋणात्मक मान है।
7.. अच्छे फसल के लिए मिट्टी का pH मान 5.5-7.0 होना चाहिए। किसान मिट्टी में चूना क्यों मिलाते हैं ? समझाएँ ।
उत्तर – अच्छे फसल के लिए मिट्टी का pH मान 5.5-7.0 होना चाहिए। मिट्टी का pH मान 5.5 से कम हो जाने पर उसमें अम्लीयता का गुण आ जाता है जो फसलों के लिए हानिकारक होता है। अत: किसान मिट्टी में चूना मिलाते हैं ताकि उसकी अम्लीयता कम हो जाए और वह • उर्वरक बन जाए।
8. अम्ल पित्त ( gastric juice) का pH मान 1 से 3 के बीच होता है, तो बताएँ।
(i) अम्ल पित्त अम्लीय है या क्षारीय ?
(ii) अम्ल पित्त का pH मान 1 से 3 के बीच किस पदार्थ के कारण होता है ?
उत्तर – (i) अम्ल पित्त अम्लीय होता है।
(ii) अम्ल पित्त का pH मान 1-3 के बीच हाइड्रोक्लोरिक अम्ल के कारण होता है।
9. उत्फुल्लन से क्या समझते हैं ? उत्फुल्लन प्रदर्शित करने वाले किसी यौगिक का नाम लिखें। एक अभिक्रिया देकर इसे समझाएँ।
उत्तर – किसी जलयोजित लवण को वायु में खुला रखने पर उसमें से क्रिस्टल जल के मुक्त होकर वायुमण्डल में चले जाने की प्रक्रिया को में चले जाने की प्रक्रिया को उत्फुल्लन कहते हैं।
वाशिंग सोडा से क्रिस्टल उत्फुल्लन की प्रक्रिया दर्शाते हैं।
10. किसी विलयन में H आयन की सांद्रता 10-5 है तो pH मान ज्ञात करें और विलयन की प्रकृति बताएँ।
उत्तर –
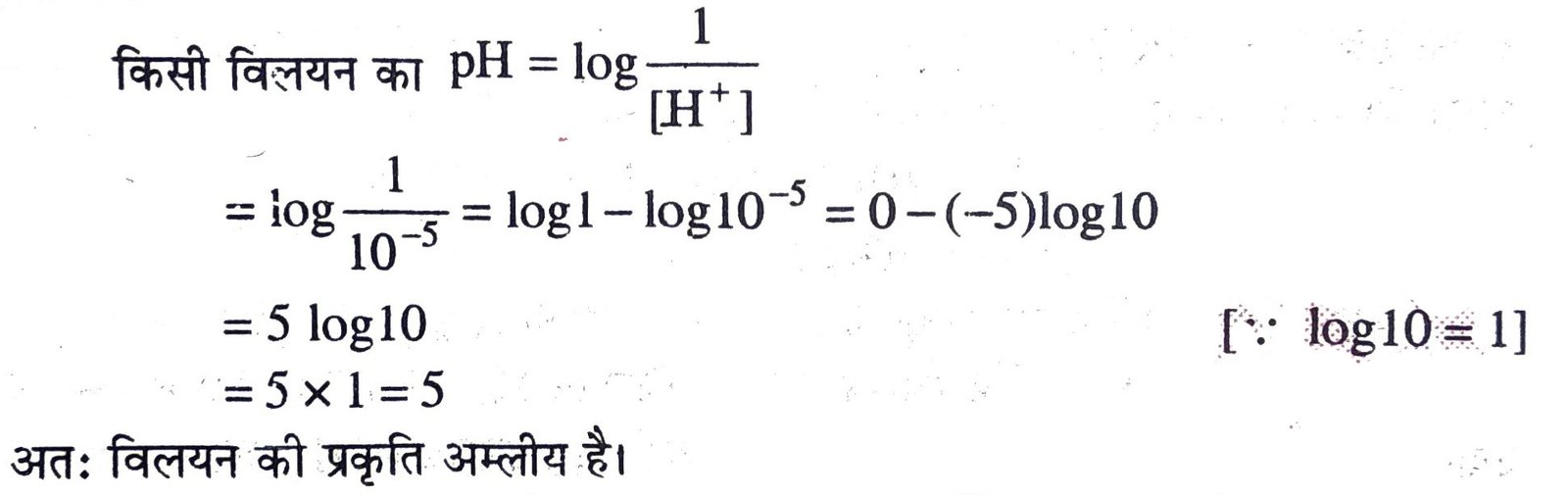
11. यौगिकों के संबंध उनके उपयोग से स्थापित करें।
(i) सोडियम कार्बोनेट (क) साँचै बनाने के लिए
(ii) सोडियम बाइकार्बोनेट (ख) कपड़े साफ करने के लिए पुग
(iii) प्लास्टर ऑफ पेरिस (ग) बेकिंग पाउडर बनाने के लिए
उत्तर – (i) – (ख), (ii)–(ग), (iii)-(क) ।
दीर्घ उत्तरीय प्रश्न
1. गृह निर्मित सूचक आप कैसे बनायेंगे ?
उत्तर – छात्र स्वयं करें।
2. प्राकृतिक सूचक क्या होते हैं ? इनसे अम्ल तथा भस्म की जाँच कैसे की जाती है ?
उत्तर – अम्ल तथा भस्म कुछ रंजकों (dyes) के रंग में परिवर्तन करने में सक्षम होते हैं। इनमें से एक रासायनिक सूचक लिटमस है जिसे थैलोफाइटा वर्ग के लाइकेन (lichen) पौधे से निकाला गया गलाबी रंग का उदासीन अर्क (extract) होता है। लिटमस अम्लीय विलयन में लाल रंग देता है तथा क्षारीय विलयन में नीला रंग देता है। फिल्टर पेपर के टुकड़े को लिटमस के अम्लीय तथा क्षारीय विलयन में डालकर सुखा लिया जाता है जिससे नीला लिटमस पत्र तथा लाल लिटमस पत्र प्राप्त होता है। किसी विलयन में यदि नीला लिटमस पत्र लाल हो जाता है तो विलयन अम्लीय है और यदि लाल लिटमस पत्र नीला हो जाता है तो विलयन क्षारीय कहलाता है। लिटमस एक प्राकृतिक सूचक है। साथ ही हल्दी भी एक प्राकृतिक सूचक है।
अन्य प्राकृतिक पदार्थ जैसे— लाल गोभी का पत्ता, हल्दी, कुछ फूलों के पत्ते (पिटूनिया तथा जेरेनियम) आदि के विलयन (extract) भी अम्ल तथा क्षार की उपस्थिति को दर्शाने में सक्षम होते हैं। इन्हें भी अम्ल – भस्म सूचक के रूप में व्यवहार किया जा सकता है। किन्तु लिटमस को छोड़कर इन सबों का उपयोग प्रयोगशाला में नहीं हो पाता, क्योंकि ये पदार्थ हवा में उपस्थित ऑक्सीजन से धीरे-धीरे नष्ट हो जाते हैं। वैसे रंजक, जिनका अम्ल तथा भस्म द्वारा रंग परिवर्तन होता है, उन्हें सूचक (indicator) कहा जाता है। सूचक का उपयोग मुख्य रूप से उदासीनीकरण अभिक्रिया के समापन को दर्शाने के लिये किया जाता है। सूचक के रूप में लिटमस का उपयोग नहीं हो पाता क्योंकि लिटमस का लाल से नीला रंग में परिवर्तन तीक्ष्ण नहीं होता।
3. अम्ल, भस्म और लवण क्या है ? प्रत्येक का दो-दो उदाहरण दें।
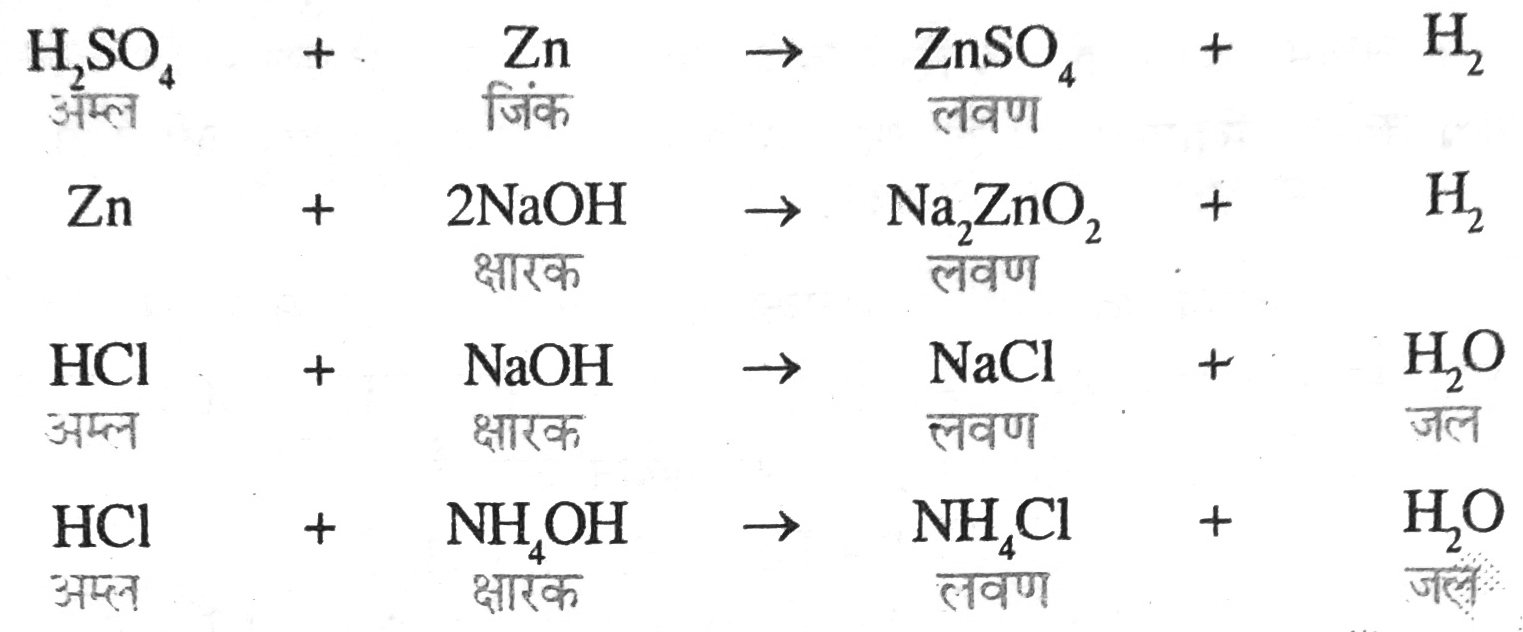
उत्तर – अम्ल – अम्ल वह पदार्थ है जिसका जलीय विलयन स्वाद में खट्टा होता है तथा धातु से अभिक्रिया कर हाइड्रोजन गैस मुक्त करता है। जैसे — HCl, CH3,COOH, H2SO4 इत्यादि अम्ल हैं। सभी अम्ल जल में घुलकर H+ आयन प्रदान करते हैं।
2HCl + Fe → Fe Cl2 + H2 ↑
2CH2CoOH + Fe → (CH3CoO)2 Fe + H ↑
अम्ल का जलीय विलयन विद्युत का संचालन करते हैं। अर्थात् इनका विद्युत अपघटन होता है।
भस्म – भस्म वह पदार्थ है जिसका जलीय विलयन स्वाद में कड़वा होता है तथा अम्ल को उदासीन कर लवण बनाता है। भस्म जल में घुलकर हाइड्रॉक्साइड (OH–) आयन देता है। जैसे— NaOH, KOH, NH4OH, Ba(OH)2, Ca(OH)2 इत्यादि। भस्म तीव्र नाशक होता है। टूथपेस्ट भस्म होता है जो हमारे मुँह में उपस्थित अम्ल को उदासीन कर दाँत की रक्षा करता है। जल में विलेय भस्म क्षार कहलाता है।
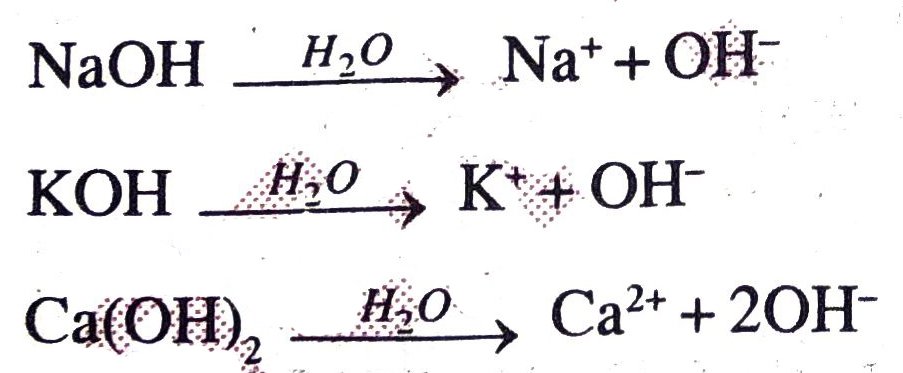
लवण – अम्लों एवं भस्मों की अभिक्रिया के फलस्वरूप बने पदार्थ लवण कहलाते हैं। लवण में दो मूलक होते हैं। जो मूलक भस्म से प्राप्त होते हैं उसे भास्मिक मूलक कहते हैं। भास्मिक मूलक धन आवेशित होते हैं। जो मूलक अम्ल से हाइड्रोजन के विस्थापन के फलस्वरूप प्राप्त होता है। उन्हें अम्लीय मूलक कहते हैं। अम्लीय ऋण आवेशित होते हैं।
जैसे – NaCl, NaHSO4, Na2SO4, Na3PO4, CuSO4, NH4Cl इत्यादि लवण हैं।

4. लवण किसे कहते हैं ? दो अम्लीय तथा दो सामान्य लवणों के नाम लिखें।
उत्तर – लवण – लवण वैसे यौगिक हैं जो अम्ल के अणु में विद्यमान हाइड्रोजन परमाणु या परमाणुओं के धातु या धातु के सदृश आचरण करनेवाले तत्त्वों के परमाणुओं के समूह, अर्थात के मूलक (अमोनियम मूलक, NH4+ ) के द्वारा अंशतः या पूर्णतः विस्थापित होने पर बनते हैं।
लवण के उदाहरण –
इस प्रकार स्पष्ट होता है कि अम्ल और क्षारक के बीच की अभिक्रिया के फलस्वरूप जल के साथ बना दूसरा यौगिक लवण कहलाता है। लवण में दो मूलक विद्यमान होते हैं। एक मूलक क्षारक से प्राप्त होता है जिसे क्षारकीय मूलक कहते हैं। क्षारकीय मूलक धन आवेशित होते हैं। दूसरा मूलक अम्ल से हाइड्रोजन के विस्थापन के फलस्वरूप प्राप्त होता है जिसे अम्लीय मूलक कहते हैं। अम्लीय मूलक ऋण आवेशित होते हैं। NaCl में Na+ आयन क्षारकीय मूलक तथा Cl– आयन अम्लीय मूलक है।
दो सामान्य लवण- सोडियम सल्फेट (Na2SO4) और पोटैशियम क्लोराइड (KCl)।
दो अम्लीय लवण- सोडियम बाइकार्बोनेट (NaHCO3) और सोडियम डाइहाइड्रोजन फॉस्फेट (NaH2PO3)।
5. उदासीनीकरण अभिक्रिया क्या है ? उदाहरण देकर समझाएँ।
उत्तर – अम्ल और क्षारक की अभिक्रिया के फलस्वरूप लवण एवं जल बनते हैं। अभिक्रिया निम्नांकित प्रकार से होती है।

6. अम्लों की शक्ति के बारे में आप क्या जानते हैं ? किन-किन तरीकों से अम्लों की शक्ति की तुलना की जा सकती है ?
उत्तर – अम्लों की शक्ति – अम्लों की शक्तियों को निम्न रूप में जाना जा सकता है-
प्रबल और दुर्बल अम्ल (Strong and Weak acids) — अम्ल के जलीय विलयन में अम्ल द्वारा प्रदत्त हाइड्रोजन आयनों की मात्रा से इसकी अम्लीय शक्ति का निर्धारण होता है ।
वे अम्ल जो जल में घुलकर लगभग पूर्णत: आयनित होकर हाइड्रोजन आयन (H+) प्रदान करते हैं, प्रबल अम्ल कहलाते हैं। उदाहरण के लिये, हाइड्रोक्लोरिक अम्ल (HCl), नाइट्रिक अम्ल (HNO3) और सल्फ्यूरिक अम्ल (H2SO4) प्रबल अम्ल हैं। दूसरी ओर वे अम्ल जो जल में घुलकर सिर्फ आंशिक रूप में ही आयनित होते हैं, पूर्णतः नहीं दुर्बल अम्ल कहलाते हैं। उदाहरण के लिये, कार्बोनिक अम्ल (H2CO3), ऐसीटिक अम्ल (CH3COOH) आदि दुर्बल अम्ल हैं।
सांद्र और तनु अम्ल (Concentrated and dilute acids) — विलयन में उपस्थित अम्ल की मात्रा के अनुसार अम्ल, सांद्र और तनु हो सकते हैं। जब विलयन में अम्ल की अधिक मात्रा उपस्थित रहती है, तो उसे सांद्र विलयन कहा जाता है। दूसरी ओर, जब विलयन में अम्ल की मात्रा अपेक्षाकृत कम रहती है, तो उसे तनु विलयन कहा जाता है, अतः सांद्र विलयन में जल की मात्रा कम-से-कम रहती है, जबकि तनु विलयन में जल की मात्रा अपेक्षाकृत अधिक रहती है।
7. के आरहेनियस सिद्धांत की व्याख्या करें। इस सिद्धांत की सीमाओं का भी उल्लेख करे ।
उत्तर – अम्त और के. कसंबंधी आरहेनियस का आयनिक सिद्धांत – अम्ल वे पदार्थ हैं जो जल में घुलकर हाइड्रोजन आयन प्रदान करते हैं और क्षारक वे पदार्थ हैं जो जल में घुलकर हाइड्रॉक्सिल (OH–) आयन प्रदान करते हैं।
उदाहरण –

सीमाएँ — यह सिद्धांत जलीय विलयनों में अम्ल- क्षारक संबंधी अनेक गुणों की सफल व्याख्या करता है। किंतु, यह दूसरे अजलीय विलायकों (जैसे—तरल अमोनिया, तरल SO2 आदि) में अम्ल- क्षारक संबंधी गुणों की व्याख्या करने में बुरी तरह असफल हो जाती है। यह सिद्धांत पदार्थों की उभयधर्मिता के गुणों की भी व्याख्या नहीं कर पाती है।
9. दैनिक जीवन में pH का महत्त्व बताएं।
उत्तर – pH का हमारे दैनिक जीवन में बहुत अधिक महत्त्व है।
- मानव और जंतु जगत में हमारे शरीर की अधिकांश क्रियाएँ 7.0 से 7.8pH परास के बीच काम करती हैं। हम इसी संकीर्ण परास में ही जीवित रह सकते हैं। हमारे रक्त, आँसुओं, लार आदि का pH लगभग 7.4 होता है। यदि यह 7.0 से कम हो जाता है या 7.8 से बढ़ जाता है तो जीवन असंभव – सा हो जाता है। वर्षा के जल से pH का मान जब 7 से कम होकर 5.6 हो जाता है तो उसे अम्लीय वर्षा कहते हैं। अम्लीय वर्षा का जल जब नदियों में बहता है तो नदी के जल का pH का मान कम हो जाता है जिस कारण जलीय जीवधारियों का जीवन कठिन हो जाता है।
- पेड़-पौधों के लिए पेड़-पोधों की अच्छी वृद्धि और अच्छी उपज के लिए मिट्टी के pH परास की विशेषता बनी रहनी चाहिए। यदि यह अधिक अम्लीय या क्षारीय हो जाए तो उपज पर कुप्रभाव पड़ता है।
- पाचन तंत्र — हमारे पेट में HCl उत्पन्न होता रहता है जो हमें बिना हानि के पाचन में सहायक होता है। अपच की स्थिति में इसमें अम्ल की मात्रा अधिक जिस कारण पेट में दर्द और जलन अनुभव होता है। इस दर्द से छुटकारा पाने के लिए ऐटैसिड जैसे क्षारकों का प्रयोग करना पड़ता है। इसके लिए प्राय: मिल्क ऑफ मैग्नीशियम जैसे दुर्बल क्षारक का प्रयोग करना आवश्यक हो जाता है।
- दंत – क्षय – हमारे मुँह के pH का 5.5 से कम होने पर दाँतों का क्षय शुरू हो जाता W है। हमार दाँत कैल्सियम फॉस्फेट से बने होते हैं जो शरीर का सबसे कठोर पदार्थ है। यह जल मं नहीं घुलता पर मुँह की pH का 5.5 से कम होने पर यह नष्ट होने लगता है। मुँह में उपस्थित जीवाणु, अवशिष्ट शर्करा और खाद्य पदार्थों के निम्नीकरण से अम्ल उत्पन्न होते हैं। इनसे छुटकारा पाने के लिए क्षारकीय दंत मंजन का प्रयोग किया जाना चाहिए। इससे अम्ल की अधिकता उदासीन हो जाती है और दाँत क्षय से रोके जा सकते हैं।
- जीव-जंतुओं के डंक से रक्षा- जब जीव जंतु कभी डंक मार देते हैं तो वे हमारे शरीर में विशेष प्रकार के अम्ल छोड़ देते हैं। मधुमक्खी भिरंड, चींटी आदि मेथैनॉइक अम्ल हमारे शरीर में डंक के माध्यम से पहुँचा देते हैं। इससे उत्पन्न पीड़ा से मुक्ति के लिए डंक मारे गए अंग पर बेकिंग सोडा जैसे दुर्बल क्षारक का प्रयोग करना चाहिए ।
- विशेष पौधों से रक्षा — नेटल (Nettle) पौधे के पत्तों पर डंकनुमा बाल होते हैं। उन्हें छू जाने से डंक़ जैसा दर्द होता है। इन बातों से मेथैनॉइक अम्ल का स्राव होता है जो दर्द का कारण बनता है। पारंपरिक तौर पर इस पीड़ा मुक्ति डॉक पौधे की पत्तियों को डंक वाले स्थान पर रगड़ कर पाई जाती है।
10. अम्लों के पाँच गुणों का उल्लेख करें।
उत्तर – (i) इनका स्वाद खट्टा होता है।
(ii) ये नीले लिटमस को लाल कर देते हैं।
(iii) ये धातुओं के साथ क्रिया करके हाइड्रोजन गैस बनाते हैं।
(iv) ये कार्बोनेट के साथ क्रिया करके कार्बन डाइऑक्साइड उत्पन्न करते हैं।
(v) अम्ल, क्षारकों से क्रिया करके लवण और पानी बनाते हैं ।
11. भस्म के पाँच गुणों का उल्लेख करें।
उत्तर – (i) इनका स्वाद कड़वा होता है।
(ii) ये लाल लिटमस को नीला कर देते हैं।
(iii) ये हल्दी के रंग को भूरा लाल कर देते हैं ।
(iv) ये अम्लों के साथ अभिक्रिया करके लवण तथा पानी बनाते हैं।
(v) ये फिनॉलफ्थेलिन के घोल को गुलाबी कर देते हैं।
12. ब्लीचिंग पाउडर का रासायनिक सूत्र लिखें। ब्लीचिंग पाउडर को किस प्रकार बनाया जाता है ? कागज बनाने की फैक्टरियों में ब्लीचिंग पाउडर का उपयोग किस कार्य के लिए होता है ?
उत्तर – ब्लीचिंग पाउडर या विरंजक चूर्ण का रासायनिक सूत्र Ca(OCl) Cl होता है। शुष्क बुझे हुए चुने [Ca(OH)2] को 40°C तक तप्त कर उसके ऊपर क्लोरीन गैस प्रवाहित करने पर विरंजक चूर्ण प्राप्त होता है।

यह सफेद रंग का होता है। इससे क्लोरीन की गंध निकलती है।
विरंजक चूर्ण का उपयोग-
(i) कीटाणुनाशक के रूप में
(ii) क्लोरीन, क्लोरोफार्म आदि बनाने में।
(iii) कागज एवं कपड़ों के विरंजन में।
कागज बनाने वाली फैक्ट्रियों में ब्लीचिंग पाउडर हाइड्रो-क्लोरिक अम्ल के साथ अभिक्रिया कराया जाता है। ब्लीचिंग पाउडर हाइड्रोक्लोरिक अम्ल से अभिक्रिया कर क्लोरीन गैस देता है। क्लोरीन कपड़ा तथा कागज का उपयोग कागज की फैक्ट्रियों में विरंजक के रूप में किया जाता है।

13. (i) विरंजक चूर्ण का रासायनिक नाम तथा सूत्र लिखें।
(ii) हवा में खुला छोड़ने पर विरंजक चूर्ण से क्लोरीन की गंध क्यों आती है ?
(iii) तनु हाइड्रोक्लोरिक अम्ल की विरंजक चूर्ण पर क्रिया दर्शाने के लिए रासायनिक समीकरण लिखें।
उत्तर – (i) विरंजक चूर्ण का रासायनिक नाम ब्लीचिंग पाउडर है। इसका रासायनिक सूत्र Ca(OCI) CI होता है।
(ii) हवा में विरंजक चूर्ण को खुला रखने पर क्लोरीन की गंध निकलती है। यह अत्यंत अस्थायी यौगिक है। यह वायुमंडल से CO, एवं आर्द्रता ग्रहण कर क्लोरीन गैस देता है। इस कारण क्लोरीन की गंध आती है।
Ca(OCl) Cl + CO2 → CaCO3 + Cl2 ↑
(iii) ब्लीचिंग पाउडर तनु हाइड्रोक्लोरिक अम्ल से अभिक्रिया कर कैल्सियम क्लोराइड तथा क्लोरीन गैस देता है।
Ca(OCl) Cl + 2HCl → CaCl2 + Cl2
अन्य महत्त्वपूर्ण प्रश्न एवं उनके उत्तर
वस्तुनिष्ठ प्रश्न
I. सही उत्तर का संकेताक्षर ( क, ख, ग या घ) लिखें।
1. एक विलयन लाल लिटमस को नीला कर देती है। इस विलयन का pH मान संभवतः होगा
(क) 7 से कम
(ख) 7 से अधिक
(ग) 7 के बराबर
(घ) इनमें से कोई नहीं
उत्तर – (ख)
2. निम्नांकित में कौन क्षारक है ?
(क) ZnO
(ख) SO2
(ग) HNO3
(घ) CO2
उत्तर – (क)
3. निम्नांकित में कौन एक क्षारक है ?
(क) KOH
(ख) NaCl
(ग) H2SO4
(घ) SO3
उत्तर – (क)
4. अम्लीय विलयन का pH मान होता है
(क) 7
(ख) 7 से कम
(ग) 7 से अधिक.
(घ) 10
उत्तर – (ख)
5. कोई विलयन अंडे के पिसे हुए कवच से अभिक्रिया करके एक गैस उत्पन्न करता है जो चूना-जल को दुधिया कर देती है। यह विलयन निम्नांकित में से किसका विलयन है ?
(क) NaCl
(ख) LiCl
(ग) HCl
(घ) KCl
उत्तर – (ग)
6. बहुक्षारक अम्ल (polybasic acid) के आंशिक उदासीनीकरण से प्राप्त होता है
(क) अम्ल लवण
(ख) क्षारकीय लवण
(ग) सामान्य लवण
(घ) मिश्रित लवण
उत्तर – (क)
7. निम्नांकित में कौन अम्लीय ऑक्साइड है ?
(क) CaO
(ख) SO2
(ग) MgO
(घ) CuO
उत्तर – (ख)
8. NaOH का 10mL विलयन, HCl के 8 mL विलयन से पूर्णत: उदासीन हो जाता है। यदि NaOH के उसी विलयन का 20 mL लिया जाए तो इसे उदासीन करने के लिए HCl के उसी विलयन के कितने आयतन की आवश्यकता होगी ?
(क) 4mL
(ख) 8mL
(ग) 12mL
(घ) 16mL
उत्तर – (घ)
9. निम्नांकित में कौन क्षारकीय ऑक्साइड है ?
(क) SO2
(ख) NO2
(ग) P2O5
(घ) Na2O
उत्तर – (घ)
10. दानेदार जिंक पर तनु सल्फ्यूरिक अम्ल की क्रिया से एक गैस निकलती है। गैस के निकट जलती हुई एक तीली ले जाने पर वह फट-फट की ध्वनि के साथ जलने लगती है। यह गैस है
(क) हाइड्रोजन
(ख) क्लोरीन
(ग) ऑक्सीजन
(घ) कार्बन डाइऑक्साइड
उत्तर – (क)
11. सभी धातु कार्बोनेट एवं बाइकोर्बोनेट अम्ल के साथ अभिक्रिया करके अनुरूप लवण, जल एवं एक गैस बनाते हैं। यह गैस चूना-जल को दुधिया कर देती है। यह गैस है
(क) O2
(ख) NO2
(ग) CO2
(घ) H2
उत्तर – (ग)
12. अभिक्रिया H2O + HCl → H3O+ + Cl– में H2O का आचरण होता है
(क) अम्ल जैसा
(ख) क्षारक जैसा
(ग) लवण जैसा
(घ) इनमें किसी के जैसा नहीं
उत्तर – (ख)
13. धोने के सोडा का रासायनिक सूत्र है
(क) CuSO4 · 5H2O
(ख) Na2CO3 · 10H2O
(ग) CaSO4 · 2H2O
(घ) CaSO4 · ½H2O
उत्तर – (ख)
14. विरंजक चूर्ण का रासायनिक सूत्र है
(क) CaCl2
(ख) CaO
(ग) CaOCl2
(घ) CaOCl
उत्तर – (ग)
15. हमारा शरीर pH मान के किस परिसर में सही तरीके से कार्य करता है ?
(क) 2-3
(ख) 5-7
(ग) 7.0-7.8
(घ) 9-9.5
उत्तर – (ग)
16. अम्लीय वर्षा कहलाने के लिए आवश्यक है कि वर्षा के जल का pH मान
(क) 7 से कम हो जाए
(ख) 5.6 से कम हो जाए
(ग) 8.6 से अधिक हो जाए
(घ) 10 हो जाए
उत्तर – (ख)
17. रवाकरण के जलयुक्त कुछ लवणों के रवों को वायु में खुला छोड़ देने पर वे रवाकरण के जल के अणुओं को खो देते हैं तथा स्वयं चूर्ण में बदल जाते हैं। यह क्रिया कहलाती है
(क) प्रस्वेदन
(ख) उत्फुल्लन
(ग) पसीजना
(घ) इनमें कोई नहीं
उत्तर – (ख)
18. अपच का उपचार करने के लिए निम्नांकित में किस औषधि का उपयोग होता है ?
(क) ऐंटिबायोटिक (प्रतिजैविकी)
(ख) ऐनालजेसिक (पीड़ाहारी)
(ग) ऐन्टैसिड (प्रत्यम्ल)
(घ) ऐन्टिसेप्टिक (रोगाणुरोधक)
उत्तर – (ग)
19. मिल्क ऑफ मैग्नीशिया अर्थात [Mg(OH)2] के जलीय विलयन का निम्नांकित में किस रूप में उपयोग होता है ?
(क) ऐन्टैसिड
(ख) ऐनालजेसिक
(ग) ऐंटिबायोटिक
(घ) ऐंटिसेप्टिक
उत्तर – (क)
20. अम्लीय एवं क्षारकीय विलयनों की पहचान निम्नांकित में किसके द्वारा की जाती है ?
(क) उत्प्रेरक के द्वारा
(ख) सूचक के द्वारा
(ग) उपधातु के द्वारा
(घ) इनमें किसी के द्वारा नहीं
उत्तर – (ख)
21. निम्नांकित में प्राकृतिक सूचक कौन हैं ?
(क) हल्दी
(ख) मेथिल ऑरेंज
(ग) फिनॉल्फ्थैलीन
(घ) इनमें कोई नहीं
उत्तर – (क)
22. निम्नांकित में संश्लेषित सूचक कौन है ?
(क) लिटमस पत्र
(ख) हल्दी
(ग) लाल पत्ता गोभी
(घ) मेथिल ऑरेंज
उत्तर – (घ)
23. अम्लों का स्वाद होता है
(क) मीठा
(ख) कड़वा
(ग) खट्टा
(घ) नमकीन
उत्तर – (ग)
24. क्षारकों का स्वाद होता है
(क) कड़वा
(ख) खट्टा
(ग) मीठा
(घ) तीता
उत्तर – (क)
25. क्षारक अम्लों से अभिक्रिया कर जल के साथ-साथ एक अन्य पदार्थ भी बनाते हैं। वह पदार्थ कहलाता है
(क) अम्ल
(ख) क्षारक
(ग) लवण
(घ) यौगिक
उत्तर – (ग)
26. आरहेनियस अम्ल जलीय विलयन में
(क) H+ आयन प्रदान करता है
(ख) OH– आयन प्रदान करता है
(ग) SO42– आयन प्रदान करता है
(घ) Al3+ आयन प्रदान करता है
उत्तर – (क)
27. जलीय विलयन में हाइड्रोजन आयन वस्तुतः
(क) H+ रूप में उपस्थित रहता है
(ख) OH– के रूप में उपस्थित रहता है।
(ग) H3O+ के रूप में उपस्थित रहता है
(घ) H2O के रूप में उपस्थित रहता है
उत्तर – (ग)
28. जल में घुलनशील क्षारक क्या कहलाते हैं ?
(क) अम्ल
(ख) क्षार
(ग) लवण
(घ) इनमें कोई नहीं,
उत्तर – (ख)
29. निलम्बन में निलम्बित कणों का आकार होता है
(क) 10-5 सेमी
(ख) 10-4 सेमी
(ग) 10-3 सेमी
(घ) इनमें से कोई नहीं
उत्तर – (ख)
30. [H2O+] [OH] निम्नलिखित में से किसको निरूपित करता है ?
(क) pH को
(ख) जल की घुलनशीलता को
(ग) Pka को
(घ) जल के आयनी गुणनफल को
उत्तर – (घ)
31. मोलर सान्द्रण का सही अर्थ निम्नांकित में से कौन-सा है ?
(क) सान्द्रण ग्राम प्रतिशत में
(ख) सान्द्रण ग्राम प्रति लिटर में
(ग) सान्द्रण ग्राम अणु प्रति लिटर में
(घ) इनमें से कोई नहीं
उत्तर – (ग)
32. जल का pH मान होता है
(क) 14
(ख) 0
(ग) 7
(घ) 10
उत्तर – (ग)
33. किसी विलयन में हाइड्रोजन आयन [H+] का सन्द्रिण 10-5 ग्राम अणुभार प्रति लिटर है, इस विलयन का pH मान है –
(क) 9
(ख) -9
(ग) -5
(घ) 5
उत्तर – (घ)
34. क्षारीय घोल का pH होता है
(क) -13
(ख) 13
(ग) 7
(घ) -7
उत्तर – (ख)
35. कठोर जल को मुदु करने के लिए किस सोडियम यौगिक का उपयोग किया जाता है ?
(क) धोवन सोडा
(ख) क्षारक
(ग) अम्लीय
(घ) इनमें से कोई नहीं
उत्तर – (क)
36. धात्विक ऑक्साइड को किस नाम से पुकार सकते हैं ?
(क) धोवन सोडा
(ख) क्षारक
(ग) क्षारकीय ऑक्साइड
(घ) इनमें से कोई नहीं
उत्तर – (ग)
37. क्षारक जल में कौन-सा आयन उत्पन्न करते हैं ?
(क) धोवन सोडा
(ख) हाइड्रॉक्साइड (OH–) आयन
(ग) क्षारकीय ऑक्साइड
(घ) इनमें से कोई नहीं
उत्तर – (ख)
38. शुद्ध जल pH स्केल पर क्या मान दिखाता
(क) 7
(ख) 1
(ग) 9
(घ) 0
उत्तर – (क)
39. धोवन सोडा का जलीय विलयन है –
(क) अम्लीय
(ख) जलीय
(ग) क्षारीय
(घ) इनमें से कोई नहीं
उत्तर – (ग)
II. रिक्त स्थानों की पूर्ति करें।
1. जल में विलेय करने पर अम्ल ……….आयनों को उत्पन्न करते हैं।
उत्तर – हाइड्रोजन
2. जल में विलेय करने पर क्षारक ………. आयनों को उत्पन्न करते हैं।
उत्तर – हाइड्रॉक्साइड
3. किसी अम्लीय विलयन का pH मान 7 से ………. होता है।
उत्तर – कम
4. समीकरण को पूरा कीजिए: Ca(OH)2 + Cl2 →
उत्तर – CaOCl2 + H2O
5. अम्ल का ऐनायन और क्षारक का कैटायन संयोग करके ……… बनाते हैं।
उत्तर – लवण
6. अम्ल स्वाद में……….. ‘तथा क्षारक स्वाद में …….. होते हैं।
उत्तर – खट्टा, कड़वे
7. ……… सिरका में विद्यमान है जबकि नींबू में ………… ।
उत्तर – ऐसीटिक अम्ल, सिट्रिक अम्ल
8. हल्दी एक ……….. सूचक है जबकि मेथिल ऑरेंज ……….. सूचक।
उत्तर – प्राकृतिक, संश्लेषित
9. अम्ल नीले लिटमस को ……….. कर देते हैं जबकि क्षारक लाल लिटमस को …………. कर देते हैं
उत्तर – लाल, नीला
10. धातुएँ अम्लों से ……….. का विस्थापन करती है।
उत्तर – हाइड्रोजन
11. चूना-जल का रासायनिक नाम ………. है।
उत्तर – कैल्सियम हाइड्रॉक्साइड
12. कार्बन डाइऑक्साइड गैस को चूना- जल से गुजारने पर चूना-जल ……….. हो जाता है
उत्तर – दुधिया
13. सोडियम हाइड्रॉक्साइड सल्फ्यूरिक अम्ल से अभिक्रिया करके ……….बनाता है।
उत्तर – सोडियम सल्फेट, जल
14. उदासीन विलयन के pH का मान ……….. होता है
उत्तर – 7
15. अम्लीय विलयन के pH का मान …….. तथा क्षारीय विलयन के pH का मान …………. होता है।
उत्तर – 7 से कम 7 से अधिक
16. हमारा शरीर ………… से ……….. pH परिसर के बीच कार्य करता है।
उत्तर – 7, 7.8
17. वर्षा के जल के pH का मान जब 5.6 से कम हो जाता है तो वह ………. कहलाती है।
उत्तर – अम्लीय वर्षा
18. शुक्र ग्रह का वायुमंडल ………. अम्ल के मोटे श्वेत एवं पीले बादलों से बना है।
उत्तर – सल्फ्यूरिक
19. सोडियम क्लोराइड के जलीय विलयन से विद्युत धारा प्रवाहित करने पर सोडियम हाइड्रॉक्साइड के बनने की प्रक्रिया को ………… अभिक्रिया कहते हैं ।
उत्तर – क्लोर-क्षार
20. सोडियम हाइड्रोजन (या बाइ) कार्बोनेट का बाजारू नाम ………. है।
उत्तर – बेकिंग सोडा
21. धोनेवाले (या धोबिया) सोडा का उपयोग जल की ………… कठोरता को हटाने के लिए होता है।
उत्तर – स्थायी
III . सही / गलत का चयन करें।
1. भस्म का जलीय विलयन खट्टा होता है ।
उत्तर – गलत
2. 6-8% ऐसीटिक अम्ल को सिरका कहते हैं।
उत्तर – सही
3. धातु के ऑक्साइड मूलतः भस्म होते हैं ।
उत्तर – सही
4. चाय में मौलिक अम्ल पाया जाता है।
उत्तर – गलत
5. शुद्ध जल का pH मान 7 होता है।
उत्तर – सही
6. प्लास्टर ऑफ पेरिस का रासायनिक सूत्र Ca(OCl)Cl होता है।
उत्तर – गलत
7. हमारे देश में 95% साधारण नमक समुद्री जल के वाष्पीकरण द्वारा प्राप्त किया जाता है।
उत्तर – सही
8. अम्ल नीले लिटमस पत्र को लाल कर देता है ।
उत्तर – सही
9. अम्ल धातु से अभिक्रिया कर कार्बन डाइऑक्साइड गैस मुक्त करता है।
उत्तर – गलत
10. अम्ल तथा भस्म के जलीय विलयन विद्युत के सुचालक होते हैं।
उत्तर – सही
अतिलघु उत्तरीय प्रश्न
1. खट्टे स्वाद वाली वस्तुओं में कौन-सा पदार्थ पाया जाता है ?
उत्तर – अम्ला
2. क्षारकीय पदार्थों का स्वाद क्या होता है ?
उत्तर – कड़वा (खारा) ।
3. चींटी के डंक एवं नेटल के डंक में कौन-सा अम्ल होता है ?
उत्तर – मेथैनॉइक अम्ल
4. लिटमस क्या है ?
उत्तर – यह लिचेन से निर्मित एक सूचक है यह अम्लीय माध्यम में लाल हो जाता है जबकि क्षारकीय माध्यम में नीला।
5. नेटल से क्या समझते हैं ?
उत्तर – यह एक जंगली पौधा है जिसमें डंक जैसे रोम होते हैं जिनमें मेथैनॉइक अम्ल होता है ये जब शरीर के संपर्क में आते हैं तो तेज डंक का अनुभव होता है।
6. नम नीले लिटमस पत्र को लाल कर देनेवाला पदार्थ क्या कहलाता है ?
उत्तर – अम्ल।
7. नम लाल लिटमस पत्र को नीला कर देनेवाला पदार्थ क्या कहलाता है ?
उत्तर – क्षारक।
8. पेट में उत्पन्न अम्लता के उपचार हेतु आप नींबू-पानी, सिरका एवं बेकिंग सोडा के जलीय विलयन में से किसके उपयोग का सुझाव देंगे ?
उत्तर – पेट में उत्पन्न अम्लता के उपचार हेतु बेकिंग सोडा के जलीय विलयन का उपयोग करना चाहिए।
9. नींबू में कौन-सा अम्ल विद्यमान होता है ?
उत्तर – नींबू में सिट्रिक अम्ल विद्यमान होता है।
10. दो प्राकृतिक सूचकों के नाम लिखें।
उत्तर – (i) लिटमस विलयन और (ii) हल्दी ।
11. दो संश्लेषित सूचकों के नाम लिखें।
उत्तर – (i) मेथिल ऑरेंज और (ii) फेनॉल्फ्थैलिन ।
12. एक कार्बनिक अम्ल का नाम एवं सूत्र लिखें।
उत्तर – ऐसीटिक अम्ल (CH3COOH ) ।
13. अम्ल एवं क्षारक की उपस्थिति को सूचित करनेवाले पदार्थ को क्या कहा जाता है ?
उत्तर – अम्ल- क्षारक सूचक या सूचक ।
14. लिटमस विलयन किस समूह के पौधे से प्राप्त होता है तथा उसका नाम क्या है ?
उत्तर – लिटमस विलयन थैलोफाइटा समूह के लिचेन (lichen) पौधे से निकाला जाता है।
15. बॅटरी अम्ल क्या हे ?
उत्तर – सल्फ्यूरिक अम्ल बैटरी अम्ल है।
16. जिंक तन सल्फ्यूरिक अम्न से अभिक्रिया करके एक गैस उत्सर्जित करता है। इस गैस के निकट एक जलती हुई संठी ले जाने पर वह पॉप की आवाज के साथ जलने लगती “है। इस गैस का नाम बतलाएँ।
उत्तर – जिंक तनु सल्फ्यूरिक अम्ल से अभिक्रिया करके हाइड्रोजन गैस उत्सर्जित करता है।
17. डॉक पौधा से क्या समझते हैं ?
उत्तर – इस प्रकार के पौधों में क्षारकीय पदार्थ पाया जाता है। जिसका उपयोग अम्लीय डंक जैसे कि मधुमक्खी का डंक, के उपचार में किया जाता है।
18. संतरा एवं इमली में कौन-सा अम्ल होता है ?
उत्तर – सतरा-सिट्रिक अम्ल, इमली-टार्टरिक अम्ल ।
19. लिटमस का स्रोत क्या है ?
उत्तर – लिचेन।
20. लिटमस का प्राकृतिक रंग क्या है ?
उत्तर – बैंगनी ।
21. CaOCl2 यौगिक का प्रचलित नाम क्या है ?
उत्तर – विरंजक चूर्ण।
22. उस पदार्थ का नाम बताएँ जो क्लोरीन से क्रिया करके विरंजक चूर्ण बनाता है।
उत्तर – Ca(OH)2 (शुष्क बुझा हुआ चूना ) ।
23. प्लास्टर ऑफ पेरिस की जल के साथ अभिक्रिया के लिए समीकरण लिखे।
उत्तर – 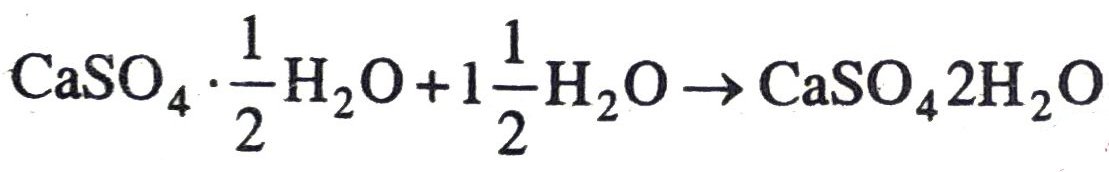
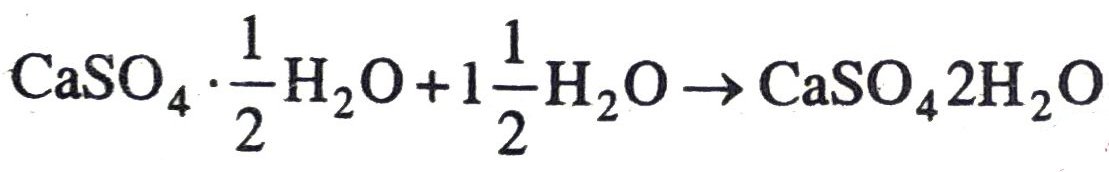
24. NaOH का 10ml विलयन, HCl 8ml विलयन से पूर्णतः उदासीन हो जाता है। यदि हम NaOH के उसी विलयन का 20 ml लें तो इसे उदासीन करने के लिए HCl के उसी विलयन की कितनी मात्रा की आवश्यकता होगी ?
उत्तर – 16ml.
25. अपचू का उपचार करने के लिए किस औषधि का उपयोग होता है ?
उत्तर – ऐन्टैसिड।
26. विरंजक चूर्ण का रासायनिक नाम एवं सूत्र लिखें।
उत्तर – रासायनिक नाम-कैल्सियम ऑक्सीक्लोराइर्ड, रासयनिक सूत्र —CaOCl2
27. बेकिंग सोडा का रासायनिक सूत्र एवं नाम लिखें।
उत्तर – रासायनिक सूत्र—NaHCO3
रासायनिक नाम – सोडियम हाइड्रोजन कार्बोनेट ।
28. धोने के सोड़ा का रासायनिक सूत्र लिखें।
उत्तर – Na2CO3 10H2O.
29. क्रिस्टलन का जल क्या होता है ?
उत्तर – लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
30. धोबून सोडा का जलीय घोल अम्लीय होता है या क्षारीय ।
उत्तर – क्षारीय।
31. उदासीन विलयन का pH मान क्या है ?
उत्तर – pH मान 7
32. शुद्ध जल का pH मान क्या होता है ?
उत्तर – 7
33. NaCl विलयन का pH क्या होता है ?
उत्तर – 7
34. समुद्र – जल में उपस्थित प्रमुख लवण का नाम लिखिए।
उत्तर – सोडियम क्लोराइड |
35. एक धातु कार्बोनेट का नाम बताइए जो जल में घुलनशील है।
उत्तर – सोडियम कार्बोनेट ।
36. pH स्केल का परास क्या होता है ?
उत्तर – 0-14 के बीच।
37. किस pH परास में हमारा शरीर कार्य करता है ?
उत्तर – 7.0 से 7.8 के बीच।
38. जल में क्षार मिलाने से उसकी pH कैसे बदलती है ?
उत्तर – pH का मान बढ़ती है और वह 7 से ज्यादा होती है।
39. पेट ( उदर) में किस अम्ल का निर्माण होता है ?
उत्तर – हाइड्रोक्लोरिक अम्ल ।
40. लिटमस पत्र पर अम्ल का क्या प्रभाव पड़ता है
उत्तर – अम्ल नीला लिटमस पत्र को लाल कर देता है।
41. क्षार का लिटमस पत्र पर क्या प्रभाव पड़ता है ?
उत्तर – लाल को नीला करता है।
42. धातु के साथ अम्ल की अभिक्रिया होने से कौन-सी गैस निकलती है ?
उत्तर – हाइड्रोजन गैस (H2)।
43. आरहेनियस ने किस पदार्थों को अम्ल कहा ?
उत्तर – आरहेनियस के अनुसार अम्ल वे पदार्थ हैं जो जल में घुलकर हाइड्रोजन (H+) आयन करते हैं।
44. दो संक्षारक अम्लों के नाम बतलाएँ।
उत्तर – (i) सल्फ्यूरिक अम्ल एवं (ii) नाइट्रिक अम्ल ।
45. क्षारक की आहेनियस परिभाषा लिखें।
उत्तर – आर्हेनियस के अनुसार, क्षारक वे पदार्थ हैं जो जल में घुलकर हाइड्रॉक्साइड आयन (OH–) प्रदान करते हैं।
46. साधारण नमक को आयोडीनयुक्त बनाने के लिए उसमें कौन-सा पदार्थ मिलाया जाता है ?
उत्तर – साधारण नमक में पोटैशियम आयोडेट (KIO3) या पोटैशियम आयोडाइड (KI) की अल्प मात्रा मिलाकर उसे आयोडीनयुक्त किया जाता है।
47. जल में विलेय क्षारक क्या कहलाते हैं ?
उत्तर – जल में विलेय क्षारक क्षार ( alkali) कहलाते हैं ।
48. अम्लीय विलयन का pH मान क्या होता है ?
उत्तर – अम्लीय विलयन का pH मान 7 से कम होता है।
49. क्षारीय विलयन का pH मान क्या होता है ?
उत्तर – क्षारीय विलयन का pH मान 7 से अधिक होता है।
50. खानेवाला सोडा क्या है ?
उत्तर – सोडियम बाइकार्बोनेट को खानेवाला सोडा कहते हैं।
लघु उत्तरीय प्रश्न
1. सूचक क्या है ?
उत्तर – वैसा पदार्थ जो अपने रंग परिवर्तन के द्वारा पदार्थ की प्रकृति अम्लीय या क्षारीय या उदासीन होने की सूचना देता है उसे सूचक कहते हैं।
जैसे — (i) मेथिल ऑरेंज, (ii) फिनॉल्फथेलिन।
2. गंधीय सूचक क्या हैं ? दो गंधीय सूचक का नाम बताएँ ।
उत्तर – ऐसे पदार्थ जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है। इन्हें गंधीय सूचक कहते हैं।
दो गंधीय सूचक–(i) प्याज, (ii) वैनिला ।
3. pH स्केल किसे कहते हैं ?
उत्तर – किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया है जिसे pH स्केल कहते हैं।
4. आसवित जल विद्युत का चालक क्यों नहीं होता जबकि वर्षा जल होता है
उत्तर – आसवित जल में कोई आयनिक यौगिक विलेय नहीं होते हैं जिसके कारण ये आयनों में विघटित नहीं होते हैं। वर्षा जल वायुमंडल से होते हुए भूमि पर गिरते समय वायु के अम्लीय गैसें CO2, SO2, NO2 इत्यादि को घुला लेता है जिससे विभिन्न कार के अम्ल क्रमशः कार्बोनिक अम्ल (H2CO3), सल्फ्यूरस अम्ल (H2SO3), नाइट्स अम्ल (HNO2) या नाइट्रिक अम्ल (HNO3 बनाते हैं। ये अम्ल आयनों में विघटित होते हैं। इसलिए वर्षा जल विद्युत के चालन करते हैं ।
5. जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है ?
उत्तर – अम्ल केवल जल की उपस्थिति में हाइड्रोजन आयन उत्पन्न करते हैं। हाइड्रोजन आयन की उपस्थिति के कारण अम्लों का व्यवहार अम्लीय होता है। अतः जल की अनुपस्थिति में हाइड्रोजन आयन नहीं बनते हैं, इस कारण अम्ल अपना अम्लीय व्यवहार नहीं करता है।
6. परखनली A एवं B में समान लम्बाई को मैग्नीशियम की पट्टी लें। परखनली में हाइड्रोक्लोरिक अम्ल तथा परखनली B में ऐसीट्रिक अम्ल (CH3COOH) डालें। किस परखनली में अधिक तेजी से बुदबुदाहट होगी तथा क्यों ?
उत्तर – चूँकि हाइड्रोक्लोरिक अम्ल एक प्रबल अम्ल है और ऐसीटिक अम्ल एक दुर्बल अम्ल । प्रबल अम्ल में अधिक हाइड्रोजन आयन (H+) होते हैं। इसलिए परखनली A में अधिक तेजी से बुदबुदाहट होगी क्योंकि अधिक हाइड्रोजन गैस निकलेगी।
Mg + 2HCl → MgCl2 + H2
7. ताजा दूध का pH मान 6 होता है। दही बन जाने पर pH के मान में क्या परिवर्तन होगा ?
उत्तर – दही में लैक्टिक अम्ल होता है, अर्थात् जब दूध से दही बन जाता है तो वह अम्लीय हो जाता है। इसलिए pH का मान 6 से कम हो जाएगा।
8. एक ग्वाला ताजे दूध में थोड़ा बेकिंग सोडा मिलाता है –
(a) ताजा दूध के pH के मान को 6 से बदलकर थोड़ा सा क्षारीय क्यों बना देता है ?
(b) दूध को दही बनने में अधिक समय क्यों लगता है ?
उत्तर – (a) बेकिंग सोडा क्षारीय होता है। इसलिए बेकिंग सोडा मिलाने पर ताजे दूध का pH का मान 6 से थोड़ा क्षारकता की ओर हो जाता है। इसलिए दूध से दही नहीं बनता है ।
(b) बेकिंग सोडा मिलाने से दूध की pH की क्षारकता की तरफ बढ़ जाती है। इसलिए pH का मान को कम होने में समय लगता है और दूध से दही बनने में अधिक समय लगता है।
9. कोई किसान खेत की मृदा की किस परिस्थिति में बिना बुझा हुआ चूना ( कैल्सियम ऑक्साइंड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट ) का उपयोग करेगा ?
उत्तर – चूँकि बिना बुझा हुआ चूना, बुझा हुआ चूना या चॉक तीनों क्षारक हैं। इसलिए खेत में इसे तब डाला जाता है जब मृदा अम्लीय हो जाती है। अतः किसान को जब यह पता चल जाता है कि खेत की मृदा अम्लीय हो गई है तब वे बिना बुझा हुआ चूना या बुझा हुआ चूना या चॉक खेत में डालते हैं।
10. प्लास्टर ऑफ पेरिस को आर्द्र-रोधी बर्तन में क्यों रखा जाना चाहिए ?
उत्तर – प्लास्टर ऑफ पेरिस आसानी से जल को अवशोषित कर लेता है और कठोर जिप्सम का निर्माण करता है। इसलिए प्लास्टर ऑफ पेरिस को आर्द्र-रोधी बर्तन में रखा जाता है नहीं तो कुछ समय बाद इसकी पूरी मात्रा जिप्सम में बदल जाएगी ।
11. धोने का सोडा के दो उपयोग बताएँ।
उत्तर – (i) घरों में साफ-सफाई में।
(ii) जल की स्थायी कठोरता दूर करने में।
12. बेकिंग सोडा के दो उपयोग बताएँ।
उत्तर – (i) सोडा अम्ल अग्निशामक में।
(ii) बेकिंग पाउडर बनाने में।
13. पीतल एवं ताँबे के बर्तनों में दही एवं खट्दे पदार्थ क्यों नहीं रखने चाहिए ?
उत्तर – दही एवं खट्टे पदार्थों में अम्ल होता है। अम्ल धातुओं के साथ अभिक्रिया करके लवण एवं हाइड्रोजन गैस बनाते हैं। अतः यदि ऐसे पदार्थों को ताँबे के बर्तनों में रखा जाता है तो अम्ल की अभिक्रिया के कारण बर्तन संक्षारित हो जाएगा।
14. खनिज नमक किसे कहते हैं ?
उत्तर – समुद्री जल में कई प्रकार के लवण घुले होते हैं। इन लवणों से NaCl को पृथक किया जाता है। विश्व के कई भागों में भी ठोस लवण निक्षेप होता है। बड़े आकार के यह क्रिस्टल प्रायः अपद्रव्यों के कारण भूरे रंग के होते हैं, जिसे खनिज नमक कहते हैं।
15. क्लोर-क्षार प्रक्रिया क्या है ?
उत्तर – सोडियम के जलीय विलयन (लवण, जल) से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रॉक्साइड उत्पन्न करता है। इस प्रक्रिया को क्लोर- क्षार प्रक्रिया कहते हैं, क्योंकि इससे निर्गत उत्पाद क्लोरीन (क्लोर) एवं सोडियम हाइड्रॉक्साइड (क्षार) होते हैं।
2NaCl + 2H2O → 2NaOH + Cl2 + H2 (g)
16. विरंजक चूर्ण के क्या-क्या महत्वपूर्ण उपयोग हैं ?
उत्तर – (i) कपड़ों के विरंजन के लिए।
(ii) रासायनिक उद्योगों में एक उपचायक के रूप में।
(iii) पीनेवाले जल को जीवाणुओं से मुक्त करने के लिए रोगाणुनाशक के रूप में।
17. बेकिंग सोडा किस प्रकार बनाया जाता है ?
उत्तर – कच्चे पदार्थों में सोडियम क्लोराइड का उपयोग कर बेकिंग सोडा का निर्माण किया जाता है।
NaCl + H2O + CO2 + NH3 → NH4Cl +NaHCO3
18. धोने वाले सोड़े का निर्माण किस प्रकार होता है ?
उत्तर – सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह एक क्षारकीय लवण है।
Na2CO3 + 10H2O → Na2CO3 10H2O
19. कैल्सियम सल्फेट अर्द्धहाइड्रेट को प्लास्टर ऑफ पेरिस क्यों कहा जाता है ?
उत्तर – जिप्सम मुख्यतः पेरिस मॉन्ट मात्रे नाम पर्वत में पाया जाता था। यह पर्वत पेरिस में है। इसी तथ्य पर कैल्सियम सल्फेट अर्द्धहाइड्रेट को प्लास्टर ऑफ पेरिस नाम रखा गया।
20. प्लास्टर ऑफ पेरिस के उपयोग बताएँ।
उत्तर – (i) चिकित्सा के क्षेत्र में (डॉक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं
(ii) खिलौना बनाने में।
(iii) सजावट का सामान बनाने के लिए।
(iv) सतह को चिकना बनाने के लिए।
21. HCl, HNO, आदि जलीय हैं जबकि ऐल्कोहॉल एवं ग्लूकोज जैसे विलयन में अम्लीय अभिलक्षण क्यों प्रदर्शित करते यौगिकों के विलयनों में अम्लीयता के अभिलक्षण नहीं प्रदर्शित होते हैं ?
उत्तर – HCI, HNO30आदि अम्ल जलीय विलयनों में वियोजित होकर हाइड्रोजन आयनों (H+) को उत्पन्न करते हैं। इसलिए ये अम्लीय अभिलक्षण प्रदर्शित करते हैं। ऐल्कोहॉल, ग्लूकोज जल में विलेय होने पर हाइड्रोजन आयनों के रूप में उनकी हाइड्रोजन पृथक नहीं होती है अर्थात् ये जल में घुलकर हाइड्रोजन आयन नहीं बनाते हैं। इसलिए उसके विलयनों में अम्लीयता के लक्षण नहीं प्रदर्शित होते हैं।
22. दंत क्षूय में pH के महत्त्व का वर्णन कीजिए।
उत्तर – मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय आरंभ हो जाता है। दाँतों का इनैमल कैल्सियम फॉस्फेट का बना होता है, जो शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता किंतु मुँह की pH का मान 5.5 से कम होने पर यह संक्षारित हो जाता है। मुँह में उपस्थित बैक्टीरिया, भोजन के पश्चात् मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों को निम्नीकरण करके अम्ल उत्पन्न करते हैं। भोजन के बाद मुँह साफ करने से इससे बचा जा सकता है। मुँह को साफ करने के लिए क्षारकीय दंतमंजन का उपयोग करने अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है। फलतः दाँत के क्षय को रोका जा सकता है।
23. साधारण नमक के उपयोग लिखिए।
उत्तर – 1. नमक हमारे भोजन का अनिवार्य भाग है।
2. यह अनेक भोज्य पदार्थों को सुरक्षित रखने में काम आता है।
3. यह साबुन उद्योग, पॉटरी आदि में प्रयुक्त होता है।
4. यह हिमकारी मिश्रण बनाने में प्रयुक्त होता है।
5. इसका उपयोग धोबन सोडा, विरंजक चूर्ण, कास्टिक सोडा, हाइड्रोक्लोरिक अम्ल, मीठा सोडा आदि बनाने में किया जाता है।
24. आसवित जल विद्युत् चालून क्यों नहीं होता जबकि वर्षा जल होता है ?
उत्तर – वर्षा जल में CO2, SO2 जैसी गैसें घुली होती हैं जो कार्बोनिक अम्ल (H2CO3) सल्फ्यूरस अम्ल (H2SO3) आदि बनती है। इनका आयनों में विच्छेदन होता है। इसीलिए वर्षा जल में विद्युत् का चालन होता है। आसवित जल में घुलनशील लवण या गैसें नहीं होतीं इसलिए इसका आयनीकरण नहीं होता और इमें विद्युत का चालन नहीं होता ।
25. जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है ?
उत्तर – जल किसी अम्ल के विच्छेदन में सहायक होता है जिससे हाइड्रोनियम (H3O+) आयन उत्पन्न होता है। जल की अनुपस्थिति में आयन उत्पन्न नहीं होते। इसलिए जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय नहीं होता।
26. आप के पास दो विलयन ‘A’ एवं ‘B’ हैं। विलयन ‘A’ के pH का मान 6 है एवं विलयन ‘B’ के pH का मान 8 है। किस विलयन में हाइड्रोजन आयन की सांद्रता अधिक है। इनमें से कौन अप्लीय है तथा कौन क्षारकीय ?
उत्तर – विलयन ‘A’ के pH का मान 6 है एवं विलयन ‘B’ के pH का मान 8 है। इसलिए विलयन ‘A’ की H+ सांद्रता 1 × 10-6 M है तथा विलयन ‘B’ की 1 × 10-8 M है। अतः विलयन ‘A’ की हाइड्रोजन आयन सांद्रता विलयन ‘B’ की अपेक्षा अधिक है। विलयन A का pH मान 7 से कम है इसलिए वह अम्लीय है। विलयन B का pH मान 7 से अधिक है। इसलिए वह क्षारकीय है ।
27. साधारण नमक सोडियम हाइड्रॉक्साइड किस प्रकार तैयार किया जाता है ?
उत्तर – साधारण नमक (NaCl) के जलीय विलेयन में विद्युत प्रवाहित करने से यह वियोजित हो जाता है और सोडियम हाइड्रॉक्साइड उत्पन्न करता है। इस प्रक्रिया को क्लोर-क्षार प्रक्रिया कहते ‘ हैं, क्योंकि इससे निर्मित उत्पाद क्लोरीन (क्लोर) और सोडियम हाइड्रॉक्साइड (क्षार) होते हैं।
2NaCl (aq) + 2H2O(l) → 2NaOH (aq) + Cl2(g) + H2(g)
ये सभी उत्पाद औद्योगिक दृष्टि से अति महत्त्वपूर्ण हैं। हाइड्रोजन और क्लोरीन इस प्रक्रिया से प्राप्त होने वाले सह-उत्पाद हैं।
28. क्षारक क्या है ? सूचकों पर इसका प्रभाव बताएँ।
उत्तर – वैसे पदार्थ, जिनका जलीय विलयन स्वाद कड़वा होता है, लाल लिटमस पत्र को में नीला कर देता है तथा अम्ल से अभिक्रिया कर लवण बनाता है, क्षारक कहा जाता है।
क्षारक लाल लिटमस पत्र को नीला, मेथिल ऑरेंज को पीला तथा फिनॉल्फ्थैलीन को हल्का गुलाबी बना देते हैं।
29. सबल एवं निर्बल अम्ल से क्या समझते हैं ? प्रत्येक के दो-दो उदाहरण दें।
उत्तर – सबल अम्ल – जो अम्ल जलीय विलयन में लगभग पूर्णरूप से आयनित होकर H+ सबल अम्लआयन देते हैं, उन्हें सबल अम्ल कहते हैं।
उदाहरण – हाइड्रोक्लोरिक अम्ल (HCl) और नाइट्रिक अम्ल (HNO3) ।
निर्बल अम्ल – जो अम्ल जलीय विलयन में आंशिक रूप से आयानित होकर H+ आयन देते है उन्हें निर्बल अम्ल कहते हैं ।
उदाहरण – कार्बोनिक अम्ल (H2CO3) और ऐसीटिक अम्ल (CH3COOH)।
30. सबल क्षारक एवं निर्बल क्षारक से क्या समझते हैं ? प्रत्येक के दो-दो उदाहरण दें।
उत्तर – सबल क्षारक – जो क्षारक जलीय विलयन में लगभग पूर्णरूप से आयनित होकर (OH– आयन देते हैं, उन्हें सबल क्षारक कहते हैं।
उदाहरण – सोडियम हाइड्रॉक्साइड (NaOH) और पोटैशियम हाइड्रॉक्साइड (KOH) ।
निर्बल क्षारक – निर्बल जो क्षारक जलीय विलयन में आंशिक रूप से आयनित होकर OH– आयन क्षारकदेते हैं, उन्हें निर्बल क्षारक कहते हैं।
उदाहरण – कैल्सियम हाइड्रॉक्साइड [Ca(OH)2)] और अमोनियम हाइड्रॉक्साइड (NH4OH)।
31. क्षार क्या हैं ? दो उदाहरण दें। क्या सभी क्षारक क्षार होते हैं ?
उत्तर – क्षार वे क्षारक जो जल में विलयशील होते हैं, क्षार कहलाते हैं।
उदाहरण- (i) सोडियम हाइड्रॉक्साइड (NaOH)
(ii) पोटैशियम हाइड्रॉक्साइड (KOH)
सभी क्षारक क्षार नहीं हो सकते, क्योंकि सभी क्षारक जल में विलयशील नहीं होते हैं।
32. C2H5OH,C6H12O6 आदि जैसे यौगिक जलीय विलयन में अम्लीय गुण प्रदर्शित क्यों नहीं करते हैं ?
उत्तर – C2H5OH,C6H12O6 आदि जैसे यौगिक जलीय विलयन में आयनित होकर H+ आयन प्रदान नहीं करते हैं। आर्हेनियस के अनुसार, अम्ल जलीय विलयन में आयनित होकर H+ आयन प्रदान करते हैं। इसलिए, C2H5OH,C6H12O6 आदि जैसे यौगिक जलीय विलयन में अम्लीय गुण नहीं दर्शाते हैं ।
33. हाइड्रोजन आयन (H+) जल में किस रूप में विद्यमान रहते हैं ?
उत्तर – हाइड्रोजन आयन (H+) स्वतंत्र रूप में नहीं रह सकते हैं, किंतु ये जल के अणुओं के साथ मिलकर रह सकते हैं। ये जल के अणुओं के साथ संयोग करके हाइड्रोनियम आयन (H3O+) बनाते हैं। इसलिए हाइड्रोज़न आयन को सदैव H+(aq) या H3O+ के रूप में व्यक्त किया जाता है।
H+ + H2O → H3O+
34. शुष्क हाइड्रोजन क्लोराइड गैस लिटमस पत्र के रंग को क्यों नहीं बदलती है ?
उत्तर – शुष्क हाइड्रोजन क्लोराइड (HCl) गैस आयनित होकर H+ आयन प्रदान नहीं कर सकती है। अतः यह अम्लीय गुण नहीं दर्शा सकती है। इस कारण से यह लिटमस पत्र के रंग को प्रभावित नहीं कर जल विलायक की उपस्थिति अनिवार्य है।
35. अम्ल को तनुकृत करते समय अम्ल को जल में मिलाना चाहिए, न कि जल को सकती है। इसके अम्लीय गुण के लिए अम्ल में, क्यों ?
उत्तर – जल में अम्ल के घुलने की प्रक्रिया अत्यंत ऊष्माक्षेपी होती है। सांद्र अम्ल को जल में मिलाने पर अत्यधिक ऊष्मा उत्पन्न होती है जिससे अम्ल छलक कर बाहर आ जाता है तथा हमें जला सकता है। अतः, सांद्र अम्ल को तनु करते समय सावधानीपूर्वक सांद्र अम्ल की थोड़ी-थोड़ी मात्रा जल में डाली जाती है तथा जल के पात्र को लगातार हिलाया जाता है। सांद्र H2SO4 में जल कभी भी नहीं डालनी चाहिए।
HX + H2O → H3O+ + X– + ऊष्मा
36. सोडियम हाइड्रॉक्साइड के विलयन में क्षारक को आधिक्य में मिलाने पर OH– आयन की सांद्रता किस प्रकार प्रभावित होती है ?
उत्तर – क्षारक जलीय विलयन में आयनित होकर OH– आयन प्रदान करते हैं। NaOH एक क्षारक हैं जो जलीय विलयन से आयनित होकर Na+ और OH– आयन प्रदान करता है।
NaOH + जल → Na+(aq) + OH– (aq)
क्षारक, जिसमें NaOH के समान OH– आयन है, को आधिक्य में मिलाने से NaOH का एक आयन कम जाता है तथा विलयन में OH– आयन की सांद्रता कम जाती है।
37. बेकिंग सोडा (baking soda) का रासायनिक नाम और सूत्र लिखिए।
उत्तर – बेकिंग सोडा (baking soda) का रासायनिक नाम सोडियम हाइड्रोजन कार्बोनेट या सोडियम बाइकार्बोनेट है। इसका रासायनिक सूत्र NaHCO3 है।
38. सोडियम हाइड्रोजन कार्बोनेट विलेयन को गर्म करने पर क्या होता है ? इसमें प्रयुक्त रासायनिक अभिक्रिया का समीकरण दीजिए।
उत्तर – जब सोडियम हाइड्रोजन कार्बोनेट के घोल को गर्म किया जाता है तब वह कार्बन डाइऑक्साइड को उत्पन्न करता है और सोडियम कार्बोनेट को बनाता है।
39. यदि पेरिस प्लास्टर के निर्माण के समय गर्म करने की प्रक्रिया को नियंत्रित न किया जाए तो क्या पदार्थ बनता है ?
उत्तर – प्लास्टर ऑफ पेरिस तैयार करते समय तापमान 373 K होना चाहिए। यदि तापमान पर नियंत्रण न रखा जाए तो अजलीय कैल्सियम सल्फेट (CaSO4) बन जाएगा जिसमें प्लास्टर ऑफ पेरिस के गुण नहीं होते। इसे मृत जला प्लास्टर (Dead burnt Plaster) कहते हैं।
40. कुछ परिचित विलयनों के लगभग pH मान बताइए।
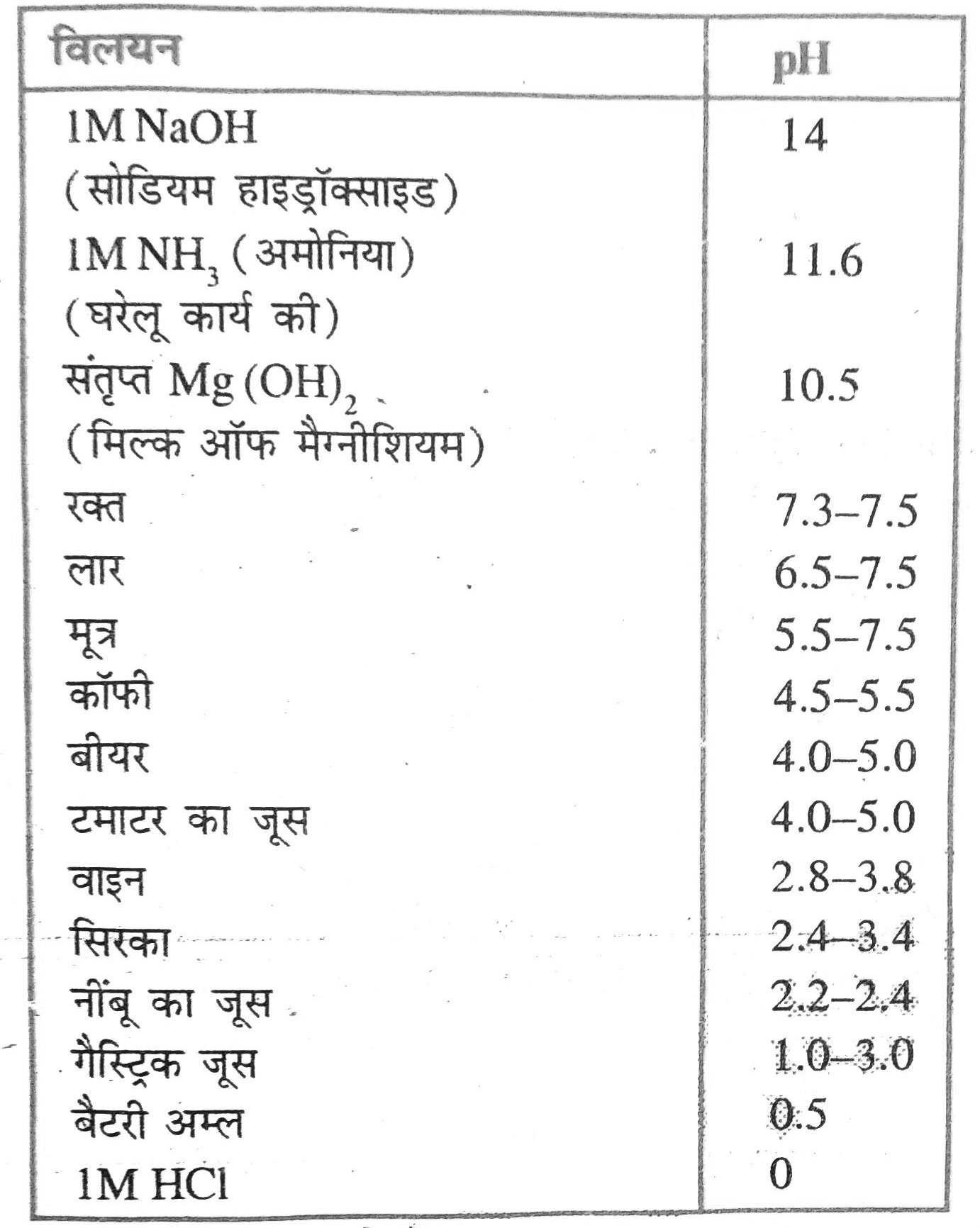
उत्तर –
41. क्या लवण के क्रिस्टल वास्तव में शुष्क होते हैं ? स्पष्ट कीजिए।
उत्तर – शुष्क दिखने वाले कॉपर सल्फेट क्रिस्टलों में उनमें क्रिस्टलन का जल होता है। वे शुष्क प्रतीत होते हैं। पर शुष्क होते हैं नहीं। जब हम क्रिस्टल को गर्म करते हैं तो यह जल हट जाता है एवं लवण का रंग श्वेत हो जाता है। यदि आप क्रिस्टल को पुनः जल से भिंगोते हैं तो क्रिस्टल का नीला रंग वापस आ जाता है।
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं। कॉपर सल्फेट के एक सूत्र इकाई में जल के पाँच अणु उपस्थित होते हैं। जलीय कॉपर सल्फेट का रासायनिक सूत्र CuSO4. 5H2O है। Na2CO3. 10H2O में दस अणु जल के होते हैं।
जिप्सम एक अन्य लवण है जिसमें क्रिस्टलन का जल होता है। इसमें क्रिस्टलन के जल का दो अणु होता है। इसका सूत्र CuSO4. 2H2O है।
42. धोवन सोडा किस प्रकार तैयार किया जाता है ? इसके उपयोग लिखिए।
उत्तर – धोवन सोडा (Na2CO3. 10H2O) एक रसायन जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है। बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता 1 सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह भी एक क्षारकीय लवण है।
Na2CO3. + 10H2O → Na2CO3. 10H2O
(सोडियम कार्बोनेट)
सोडियम कार्बोनेट एवं सोडियम हाइड्रोजन कार्बोनेट, कई औद्योगिक प्रक्रियाओं के लिए उपयोगी रसायन है।
धोवन् सोडा के उपयोग –
(i) सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज उद्योगों में होता है।
(ii) इसका उपयोग बोरेक्स जैसे सोडियम यौगिक के उत्पादन में होता है।
(iii) सोडियम कार्बोनेट का उपयोग घरों में साफ-सफाई के लिए होता है।
(iv) जल की स्थाई कठोरता को हटाने के लिए इसका उपयोग होता है।
दीर्घ उत्तरीय प्रश्न
1. आयनीकरण के आधार पर अम्लों का विभाजन किन वर्गों में किया जाता है ? संक्षेप में लिखिए।
उत्तर – आयनीकरण के आधार पर अम्लों का विभाजन दो वर्गों में किया जाता है — प्रबल अम्ल और दुर्बल अम्ल ।
(I) प्रबल अम्ल- वे अम्ल जो जलीय विलयन में पूरी तरह से आयनीकृत हो जाते हैं और हाइड्रोनियम आयन (H2O+) की उच्च सांद्रता उत्पन्न करते हैं उन्हें प्रबल अम्ल कहते हैं।
उदाहरण हाइड्रोक्लोरिक अम्ल (HCl), सल्फ्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3)। ये तीनों खनिज अम्ल हैं और प्रबलतम माने जाते हैं।
(II) दुर्बल अम्ल-वे अम्ल जो जलीय विलयन में आंशिक या अधूरा रूप से आयनीकृत होते हैं और हाइड्रोनियम-आयन (H3O+) का निम्न सांद्रता उत्पन्न करते हैं उन्हें दुर्बल अम्ल कहते हैं।
उदाहरण – एसिटिक अम्ल (CH3COOH), कार्बनिक अम्ल (H2CO3)
फ़ॉर्मिक अम्ल (HCOOH), ऑक्जेलिक अम्ल [(COOH)2]
हाइड्रो आयोडिक अम्ल (HI), सल्फ्यूरस अम्ल (H2SO3)
2. सोडियम कार्बोनेट के पाँच उपयोग बताएँ।
उत्तर – सोडियम कार्बोनेट का उपयोग निम्नांकित कार्यों में होता है।
(क) खारा जल में सोडियम कार्बोनेट मिलाने पर जल में उपस्थित Ca2+ और Mg2+ आयन CO32- आयनों से संयोग कर क्रमश: CaCO3 और MgCO3 बनाते हैं जो जल में अविलेय होने के कारण अवक्षेपित हो जाते है। अतः, सोडियम कार्बोनेट का उपयोग जल का खारापन दूर करने में होता है।
(ख) सोडियम कार्बोनेट का उपयोग काँच, साबुन, कॉस्टिक सोडा, दवा, रंग और मृत्तका – पात्रों के निर्माण में परोक्ष या प्रत्यक्ष रूप से बड़े पैमाने पर होता है ।
(ग) सोडियम कार्बोनेट प्रयोगशाला में आयतनी विश्लेषण द्वारा अम्लों की मात्रा निर्धारित करने में प्राथमिक मानक के रूप में व्यवहृत होता है।
(घ) उद्योगों में काँच, कागज, साबुन आदि के उत्पादन में इसका उपयोग होता है।
(ङ) कपड़ा आदि साफ करने में इसका प्रयोग किया जाता है।
3. ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होते हैं लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे साबित करें।
उत्तर – ऐल्कोहॉल एवं ग्लूकोज जल में घुलने पर हाइड्रोजन आयनों (H+) के रूप हाइड्रोजन को पृथक नहीं करते हैं अर्थात् ये आयनों में विघटित नहीं होते हैं। इसलिए इसके घोल विद्युत का चालन नहीं करते हैं ।
चित्रानुसार उपकरण को सजाकर बीकर में एल्कोहॉल का घोल लेते हैं और विद्युत धारा प्रवाहित करते हैं तो हम पाते हैं कि बल्ब नहीं जलता है। इससे सिद्ध होता है कि ऐल्कोहॉल का घोल विद्युत का चालन नहीं करता है।

अब हम बीकर में ग्लूकोज का घोल लेकर प्रयोग को दोहराते हैं। बल्ब फिर भी नहीं जलता है। इससे सिद्ध होता है कि ग्लूकोज का घोल भी विद्युत का चालन नहीं करता है। अतः ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों में हाइड्रोजन होते हुए भी इनका वर्गीकरण अम्ल की तरह नहीं होता है।
4. निम्न अभिनय के लिए पहले शब्द समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिए
(a) तनु सल्फ्यूरिक अम्ल, दानेदार जिंक के साथ अभिक्रिया करता है ।
(b) तनु हाइड्रोक्लोरिक अम्ल, मैग्नीशियम पट्टी के साथ अभिक्रिया करता है।
(c) तनु सल्फ्यूरिक अम्ल, ऐलुमिनियम चूर्ण के साथ अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल, लौह के रेतन के साथ अभिक्रिया करता है।
उत्तर –

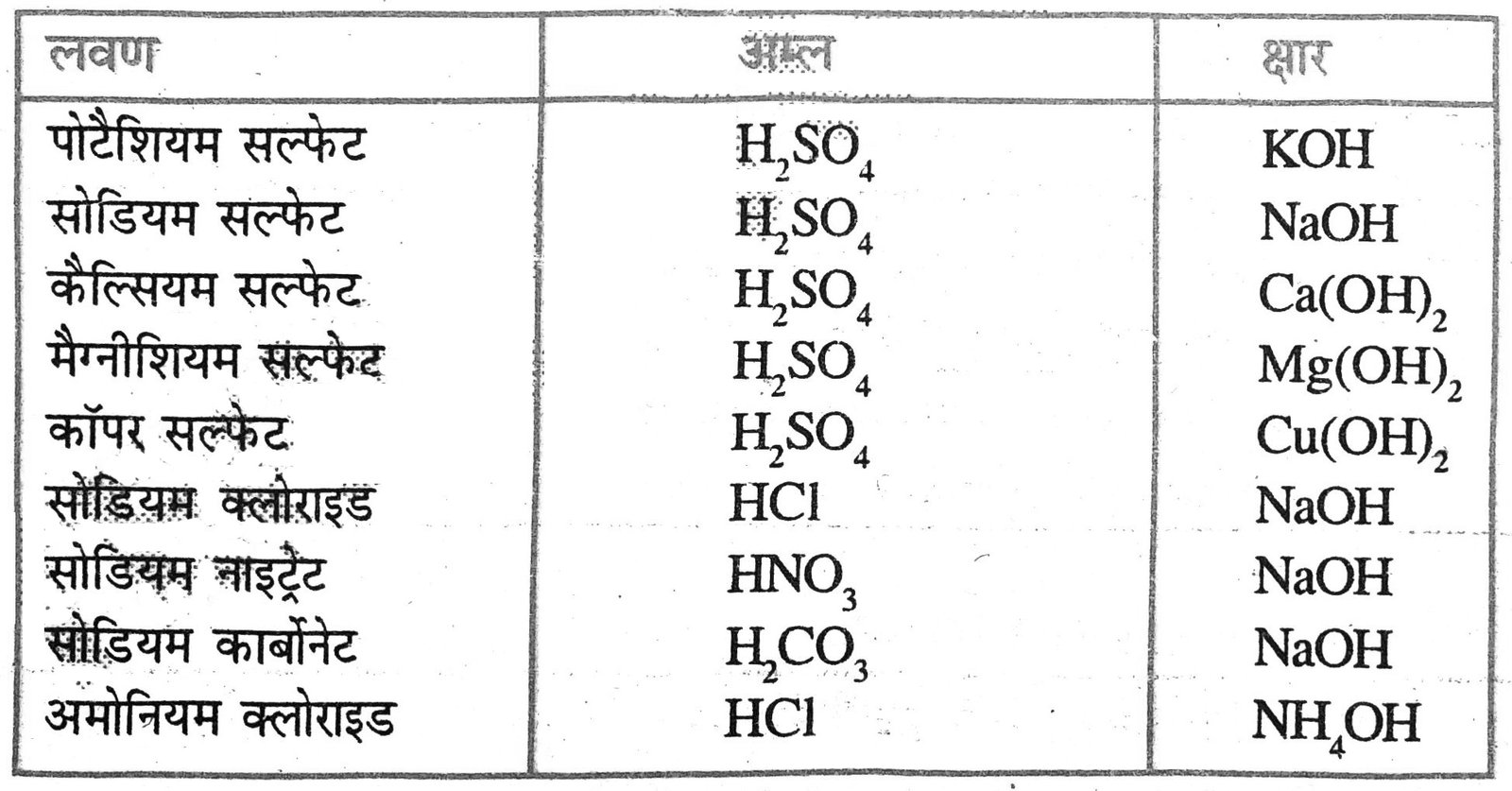
5. नीचे दिए गए लवणों के सूत्र लिखिए : पोटैशियम सल्फेट, सोडियम सल्फेट, कैल्सियम सल्फेट, मैग्नीशियम सल्फेट, कॉपर सल्फेट, सोडियम क्लोराइड, सोडियम नाइट्रेट, सोडियम कार्बोनेट एवं अमोनियम क्लोराइड ।
उत्तर –

6. उन अम्ल एवं क्षारकों की पहचान कीजिए जिससे उपरोक्त लवण प्राप्त किये जा सकते हैं।
उत्तर –
7. अम्लों और क्षारकों में अंतर स्पष्ट करने के लिए आप किन-किन परीक्षणों को महत्त्व देंगे ?
उत्तर – अम्लों और क्षारकों में अंतर स्पष्ट करने वाले अनेक परीक्षण हैं। सूचकों की विशेषताओं और गुणों के आधार पर इनके दो भाग किए जाते हैं —
1. अम्लीय और क्षारकीय माध्यमों को रंग देने वाले सूचक ।
2. अम्लीय और क्षारकीय माध्यमों को गंध देने वाले सूचक ।
1. रंग देने वाले सूचक –
(क) लिटमस विलयन–लिचेन पौधों से प्राप्त किया जाने वाला लिटमस बैंगनी रंग का होता है। यह नीले और लाल रंग में विलयन या पत्र के रूप में मिलता है। नीला लिटमस अम्ल की उपस्थिति को लाल रंग में बदल कर प्रदर्शित करता है और लाल लिटमस क्षारक को नीले रंग में बदलता है। लिटमस स्वयं न तो अम्लीय होता है और न क्षारीय
(ख) टरमैरिक (हल्दी)– हल्दी का घोल क्षारकों को लाल-भूरा रंग में बदल देता है। इसी के कारण कपड़े पर लगा सब्जी का निशान क्षारकीय साबुन से धोने पर लाल-भूरा हो जाता है।
(ग) फिनॉलफ्थेलिन यह संश्लिष्ट सूचक है। यह क्षारकों के साथ गुलाबी रंग बनाता है।
(घ) मिथाइल आरेंज- यह भी संश्लिष्ट सूचक है। यह अम्लीय विलयन को गुलाबी रंग में बदलता है और क्षारक को पीले रंग में परिवर्तित करता है।
2. गंधीय सूचक- प्याज के कटे हुए छोटे-छोटे टुकड़े व नीला गंध और लौंग का तेल अम्लों और क्षारकों के साथ भिन्न गंध उत्पन्न कर इनके परीक्षण में सहायक सिद्ध होते हैं।
9. विरंजक चूर्ण किस प्रकार तैयार किया जाता है ? इसके सामान्य गुण और उपयोग लिखिए।
उत्तर – विरंजक चूर्ण का निर्माण शुष्क बुझे हुए चूने पर क्लोरीन की क्रिया से होता है।
Ca(OH)2(s) + Cl2(g) → CaOCl2(s) + H2O(l)
बड़ी मात्रा में इसके निर्माण के लिए एक विशेष टावर लेते हैं जिसमें ऊपर से होपर (Hopper) से शुष्क बुझा हुआ चूना डाला जाता है और नीचे से क्लोरीन गैस तथा गर्म वायु प्रवाहित करते हैं। क्लोरीन ऊपर तक पहुँचते-पहुँचते पूर्णतया अवशोषित हो जाती है और बुझा हुआ चूना विरंजक चूर्ण में बदल जाता है।
गुण-
1. विरंजक चूर्ण पीले रंग का चूर्ण है, जिसमें क्लोरीन की तीखी गंध होती है।
2. यह जल में घुलनशील है, परंतु पूरी तरह विलेय नहीं।
3. यह वायु की CO2 के साथ क्रिया करके क्लोरीन खो देता है।
CaOCl2 + CO2 → CaCO3 + Cl2 ↑
4. यह अम्लों से क्रिया करता है।
CaOCl2 + 2HCl → CaCl2 + H2O + Cl2
CaOCl2 + H2SO4 → CaSO4 + H2O + Cl2
उपयोग
1. कागज तथा कपड़ा उद्योग में विरंजक के रूप में।
2. पेय जल को रोगाणुरहित करने में।
3. बिना सिकुड़ने वाली ऊन बनाने में।
4. यह क्लोरोफार्म बनाने में प्रयुक्त होता है।
5. प्रयोगशाला में यह ऑक्सीकारक का कार्य करता है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here