NCERT Solutions Class 9Th Science Chemistry – परमाणु एवं अणु
NCERT Solutions Class 9Th Science Chemistry – परमाणु एवं अणु
अतिलघु उत्तरीय प्रश्नोत्तर
परमाणु एवं अणु
1. सोडियम ऑक्साइड का सूत्र लिखें ।
उत्तर – Na2O
2. ऐलुमिनियम क्लोराइड का सूत्र लिखें।
उत्तर – AlCl3
3. सोडियम सल्फाइड का सूत्र लिखें।
उत्तर – Na2SO3
4. मैग्नीशियम हाइड्रॉक्साइड का सूत्र लिखें।
उत्तर – Mg (OH)2
5. मैग्नीशियम क्लोराइड का रासायनिक सूत्र लिखें ।
उत्तर – MgCl2
6. कैल्सियम क्लोराइड का रासायनिक सूत्र लिखें।
उत्तर – CaCl2
7. कॉपर नाइट्रेट का रासायनिक सूत्र लिखें।
उत्तर – CuNO3
8. कैल्सियम कार्बोनेट का रासायनिक सूत्र लिखें।
उत्तर – CaCO3
9. सूत्र Al2 (SO4)3 के यौगिकों के नाम लिखें।
उत्तर – ऐलुमिनियम सल्फेट ।
10. सूत्र CaCl2 के यौगिकों के नाम लिखें।
उत्तर – कैल्सियम क्लोराइड ।
11. सूत्र K2SO4 के यौगिकों के नाम लिखें।
उत्तर – पोटैशियम सल्फेट l
12. सूत्र KNO3 के यौगिकों के नाम लिखें।
उत्तर – पोटैशियम नाइट्रेट
13. सूत्र CaCO3 के यौगिकों के नाम लिखें।
उत्तर – कैल्सियम कार्बोनेट ।
14. बुझा हुआ चूना में विद्यमान तत्व का नाम एवं रासायनिक सूत्र लिखें ।
उत्तर – तत्व- कैल्सियम, ऑक्सीजन व हाइड्रोजन |
रासायनिक सूत्र – Ca (0H)2
15. हाइड्रोजन ब्रोमाइड में विद्यमान तत्व का नाम एवं रासायनिक सूत्र लिखें।
उत्तर – तत्व- हाइड्रोजन, और ब्रोमीन ।
रासायनिक सूत्र – HBr
16. बेकिंग पाउडर ( खाने वाला सोडा) में विद्यमान तत्व का नाम एवं रासायनिक सूत्र लिखें।
उत्तर – तत्व – सोडियम, हाइड्रोजन, कार्बन, और ऑक्सीजन |
रासायनिक सूत्र – NaHCO3
17. पोटैशियम सल्फेट में उपस्थित तत्व का नाम एवं रासायनिक सूत्र लिखें ।
उत्तर – तत्व- पोटैशियम, सल्फर, और ऑक्सीजन l
रासायनिक सूत्र – K2SO4
18. रासायनिक सूत्र का क्या तात्पर्य है ?
उत्तर – किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है।
19. H2S अणु में कितने परमाणु विद्यमान हैं ?
उत्तर – H2S में तीन परमाणु विद्यमान हैं।
20. डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है ?
उत्तर – परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो सृजित होते हैं न ही उनका विनाश होता है ।
21. डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है ?
उत्तर – भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं ।
लघु उत्तरीय प्रश्नोत्तर
1. द्रव्यमान के संरक्षण का नियम लिखें ।
उत्तर – किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है न ही विनाश अर्थात् किसी भी अभिक्रिया में अभिकारकों और उत्पादों के द्रव्यमानों का योग अपरिवर्तनीय होता है । यह द्रव्यमान संरक्षण का नियम कहलाता है।
2. निश्चित अनुपात का नियम लिखें ।
उत्तर – इस नियम के अनुसार, दो या अधिक तत्त्वों के संयोग से बने यौगिक में अवयवी तत्त्वों का, भार के विचार से सर्वदा एक स्थिर अनुपात होता है, चाहे वह यौगिक किसी भी विधि द्वारा बनाया जाएँ ।
3. परमाणु क्या है ?
उत्तर – तत्त्व का वह सूक्ष्मतम कण जो स्वतंत्र रूप में नहीं पाया जाता लेकिन जिसमें तत्त्व के सभी गुण मौजूद रहते हैं तथा जो रासायनिक अभिक्रिया में भाग लेता है, परमाणु कहलाता है ।
4. प्रतीक का क्या तात्पर्य है ?
उत्तर – किसी तत्त्व के पूरे नाम के संक्षिप्त रूप को उस तत्त्व का प्रतीक कहते हैं।
5. परमाणु द्रव्यमान मात्रक (amu) को परिभाषित करें।
उत्तर – कार्बन तत्त्व के विशिष्ट समस्थानिक (C-12) के एक परमाणु के द्रव्यमान के 1/12 वें भाग को परमाणु द्रव्यमान मात्रक कहते हैं ।
6. अणु क्या है ?
उत्तर – किसी पदार्थ का वह सूक्ष्मतम कण जो स्वतंत्र रूप में पाया जाता है तथा जिसमें पदार्थ के सभी गुण वर्तमान रहता है, अणु कहलाता है। ये परमाणुओं से बने होते है।
7. आयन क्या है ?
उत्तर – आयन विद्युत आवेशी परमाणु या परमाणुओं का समूह है।
8. अणु द्रव्यमान को परिभाषित करें।
उत्तर – किसी पदार्थ के एक अणु में विद्यमान सभी परमाणुओं के परमाणु द्रव्यमानों के योगफल को उस पदार्थ का अणु द्रव्यमान कहते हैं। दूसरे शब्दों में अणु द्रव्यमान एक संख्या है जो बताती है कि कोई अणु 12C6 के 1/12 वाँ भाग से कितना गुना भारी है।
9. मोल से आप क्या समझते हैं ?
उत्तर – मोल पदार्थ की वह मात्रा है जिसमें कणों की संख्या परमाणु आयन, आयन, अणु या सूत्र इकाई कार्बन-12 के ठीक 12g में विद्यमान परमाणुओं के बराबर होता है।
10. मोलर द्रव्यमान क्या हैं ?
उत्तर – पदार्थ के एक मोल अणुओं का द्रव्यमान उसका मोलर द्रव्यमान कहलाता है।
11. आवोगाद्रो संख्या क्या है ?
उत्तर – किसी पदार्थ के एक मोल में विद्यमान कणों जैसे परमाणुओं, अणुओं या आयनों की संख्या को आवोगाद्रो संख्या अथवा आवोगाद्रो का नियतांक कहते है । इसका मान 6.022 × 1023 प्रति मोल ( 6.022 × 1023 mol-1) है।
12. परमाणुकता की परिभाषा लिखें।
उत्तर – किसी तत्त्व के एक अणु में उपस्थित परमाणुओं की संख्या उसकी परमाणुकता कहलाती है।
13. एक परमाणु को आँखों द्वारा देखना क्यों संभव नहीं होता है ?
उत्तर – परमाणु किसी द्रव्यमान की रचनात्मक इकाई होते हैं। परमाणु आकार हमारी कल्पना से भी छोटा होता है अतः किसी भी तरह परमाणु को आँखों द्वारा नहीं देखा जा सकता है।
14. सूत्र द्रव्यमान को परिभाषित करें। उदाहरण देकर इसका स्पष्टीकरण ।
उत्तर – किसी पदार्थ का सूत्र इकाई द्रव्यमान उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है।
जैसे- सोडियम क्लोराइड के लिए सूत्र द्रव्यमान
= Na का परमाणु द्रव्यमान + Cl का परमाणु द्रव्यमान l
= (23 + 35.5) u = 58.5u
15. डाल्टन के परमाणु सिद्धांत का कौन-सा भाग अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है ?
उत्तर – भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं ।
आंकिक प्रश्नोत्तर
1. निम्न यौगिकों के आण्विक द्रव्यमान का परिकलन करें –
H2, Cl2, CO2, CH4, C2H6, C2H4 NH3 एवं CH3OH
उत्तर –
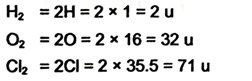
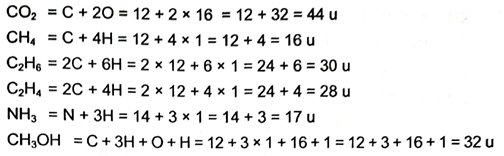
2. ZnO, Na2O एवं K2CO3 यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन करें-
दिया गया है, – Zn का परमाणु द्रव्यमान = 65 u
Na का परमाणु द्रव्यमान = 23 u
K का परमाणु द्रव्यमान = 39.1u
C का परमाणु द्रव्यमान = 12 u एवं
O का परमाणु द्रव्यमान = 16 u है ।
उत्तर –
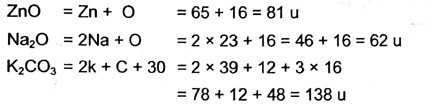
3. यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12g है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा ?
उत्तर –

4. किस में अधिक परमाणु होंगे 100g सोडियम अथवा 100g लोहा (Fe) ? (Na का परमाणु द्रव्यमान = 23u, Fe का परमाणु द्रव्यमान = 56u)
उत्तर –

5. एथाइन, C2H2 के मोलर द्रव्यमान का परिकलन करें।
उत्तर – किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं।
कार्बन का परमाणु द्रव्यमान = 12 u
हाइड्रोजन का परमाणु द्रव्यमान = 1 u
C2H2 का अणु द्रव्यमान = 2 × C का परमाणु द्रव्यमान × H का परमाणु द्रव्यमान
= 2 × 12 + 2 × 1 = 24 + 2 = 26 u
∴ C2H2 का मोलर द्रव्यमान = 26g Ans.
6. सल्फर अणु, S8 के मोलर द्रव्यमान का परिकलन करें।
उत्तर – किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं।
सल्फर का परमाणु द्रव्यमान = 32 u
S8 का अणु द्रव्यमान = 8 × 32 = 256g
∴ S8 का मोलर द्रव्यमान = 256g Ans.
7. फॉस्फोरस अणु P4 (फॉस्फोरस का परमाणु द्रव्यमान = 31) के मोलर द्रव्यमान का परिकलन करें ।
उत्तर – किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं ।
फॉस्फोरस का परमाणु द्रव्यमान = 31u
P4 का अणु द्रव्यमान = 4 × 31= 124 u
P4 का मोलर द्रव्यमान = 124g Ans.
8. हाइड्रोक्लोरिक अम्ल, HCl के मोलर द्रव्यमान का परिकलन करें।
उत्तर – किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं।
हाइड्रोजन का परमाणु द्रव्यमान = 1 u
क्लोरीन का परमाणु द्रव्यमान = 35.5 u
HCl का अणु द्रव्यमान = H का परमाणु द्रव्यमान + Cl का परमाणु द्रव्यमान
= 1 + 35.5 = 36.5 u
∴ HCl का मोलर द्रव्यमान =.36.5g Ans.
9. नाइट्रिक अम्ल, HNO3 के मोलर द्रव्यमान का परिकलन करें।
उत्तर – किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं ।
हाइड्रोजन का परमाणु द्रव्यमान = 1 u
नाइट्रोजन का परमाणु द्रव्यमान = 14 u
ऑक्सीजन का परमाणु द्रव्यमान = 16 u
HNO3 का अणु द्रव्यमान = H का परमाणु द्रव्यमान + 3 × 0 का परमाणु द्रव्यमान
= 1 + 14 + 3 × 16 = 1 + 14 + 48 = 63 u
∴ HNO3 का मोलर द्रव्यमान = 63g Ans.
10. 1 मोल नाइट्रोजन परमाणु का द्रव्यमान क्या होगा ?
उत्तर – मोल संख्या (n) = 1
N परमाणुओं का मोलर द्रव्यमान (M) = 14g
N का द्रव्यमान = मोलर द्रव्यमान × मोल संख्या
या, m = M × n
या, m = 14 × 1 = 14g Ans.
11. 4 मोल ऐलुमिनियम परमाणु (ऐलुमिनियम का परमाणु द्रव्यमान = 27) का परमाणु – द्रव्यमान क्या होगा ?
उत्तर – मोल संख्या (n) = 4
ऐलुमिनियम आयनों का मोलर द्रव्यमान (M) = 27 ग्रा० (समान तत्व के एक आयन का द्रव्यमान उसके परमाणु के द्रव्यमान के बराबर होता है।)
द्रव्यमान = मोलर द्रव्यमान × मोल संख्या
या, m = M × n
या, m = 27 × 4 = 108g Ans.
12. 10 मोल सोडियम सल्फाइट (Na2SO3) का द्रव्यमान क्या होगा ?
उत्तर – मोल संख्या (n) = 10
Na2SO3 का मोलर द्रव्यमान (M) = ( 2 × 23) + 32 + (3 × 16)
= 46 + 32 + 48 = 126
द्रव्यमान = मोलर द्रव्यमान × मोल संख्या
या, m = M × n
या, m = 126 × 10 = 1260g Ans.
13. 12g ऑक्सीजन गैस को मोल में परिवर्तित करें ।
उत्तर –

14. 20g जल को मोल में परिवर्तित करें ।
उत्तर –

दीर्घ उत्तरीय प्रश्नोत्तर
1. परमाणु एवं अणु में अंतर स्पष्ट करें।
उत्तर – परमाणु एवं अणु में अंतर –
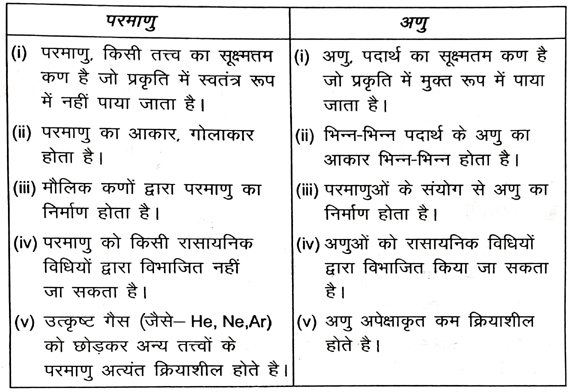
2. डाल्टन के परमाणु सिद्धांत की मुख्य मान्यताएँ क्या हैं ?
उत्तर – 1803 ई० में जॉन डाल्टन ने परमाणुवाद के सिद्धांत को प्रस्तुत किया। इस सिद्धांत के अनुसार –
(i) सभी तत्त्व अत्यंत सूक्ष्मकणों से बने हैं जिन्हें परमाणु कहते हैं ।
(ii) ये परमाणु अविभाज्य है, अर्थात न तो ये बनाए जा सकते है और न ही नष्ट किए जा सकते हैं ।
(iii) एक तत्त्व के सभी परमाणु समान गुण एवं समान द्रव्यमान वाले होते हैं ।
(iv) विभिन्न तत्त्वों के परमाणु विभिन्न गुण एवं द्रव्यमान वाले होते है ।
(v) दो या दो से अधिक तत्त्वों के परमाणु एक सरल अनुपात में संयोग कर यौगिक का निर्माण करते हैं ।
(vi) किसी यौगिक का सूक्ष्मतम कण, यौगिक परमाणु कहलाता है।
3. डाल्टन के परमाणु सिद्धांत के प्रमुख दोषों को लिखें।
उत्तर – डाल्टन के परमाणु सिद्धांतों से अनेक बातों का स्पष्टीकरण नहीं हो सका, जैसे –
(i) चारकोल, ग्रेफाइट, हीरा सभी कार्बन परमाणु से बने है फिर भी इनके गुण एक-दूसरे से काफी भिन्न है।
(ii) डाल्टन ने किसी तत्त्व एवं किसी यौगिक दोनों के अंतिम कण को क्रमशः परमाणु और यौगिक परमाणु कहा जबकि तत्त्व का अंतिम कण परमाणु एवं यौगिक का अंतिम कण अणु कहलाता है। अर्थात् ये अणु परमाणु में विभेद नहीं कर सके ।
(iii) डाल्टन ने परमाणु को अविभाज्य माना, लेकिन परमाणु का विभाजन संभव है, यह सिद्ध हो चुका है।
(iv) डाल्टन के अनुसार एक तत्त्व के सभी परमाणु समान भार वाले होते है। लेकिन एक तत्व के समस्थानिकों के परमाणुओं के भिन्न-भिन्न भार होते हैं, तथा समभारिक तत्त्वों के परमाणुओं के एक ही भार होते हैं।
उपर्युक्त त्रुटियों के बावजूद भी यह सिद्धांत काफी उपयोगी है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here