NCERT Solutions Class 10Th Science Chemistry – धातु एवं अधातु
NCERT Solutions Class 10Th Science Chemistry – धातु एवं अधातु
अतिलघु उत्तरीय प्रश्नोत्तर
धातु एवं अधातु
1. धातुएँ कठोर सतह से टकराने पर आवाज उत्पन्न करती है, उन्हें क्या कहते हैं ?
उत्तर – ध्वानिक (सोनोरस) ।
2. एक ऐसी धातु का उदाहरण दें जिसे चाकू द्वारा आसानी से काट सकते है।
उत्तर – Na (सोडियम) ।
3. एक ऐसी धातु का नाम लिखें जो उष्मा की सर्वोत्तम चालक होती है।
उत्तर – Ag (सिल्वर) ।
4. एक ऐसी धातु का नाम लिखें जो उष्मा की अल्पतम चालक होती है।
उत्तर – Pb (लेड) ।
5. एक ऐसी धातु का नाम लिखें जो हथेली पर रखने से पिघलने लगती है ।
उत्तर – गैलियम ।
6. एक ऐसी अधातु का नाम लिखें जो चमकीला होता है।
उत्तर – आयोडिन ।
7. एक ऐसी अधातु का नाम लिखें जो विद्युत का सुचालक होती है।
उत्तर – ग्रेफाइट।
8. एक ऐसी धातु का नाम लिखें जो ऊष्मा की कुचालक होती है।
उत्तर – पारा (Hg), सीसा (Pb) |
9. दो धातुओं के नाम बताएँ जो प्रकृति में मुक्त अवस्था में पाई जाती हैं।
उत्तर – सोना (Au), प्लैटिनम (Pt) |
10. एक ऐसी धातु का नाम बताएँ जो कमरे के ताप पर द्रव होती है।
उत्तर – पारा (Hg)
11. एक ऐसी अधातु का नाम बताएँ जो सामान्य ताप पर द्रव अवस्था में पाई जाती है ।
उत्तर – ब्रोमीन (Br)
12. उस धातु का नाम बताएँ जो विद्युत के प्रवाह का तीव्र प्रतिरोध करता है।
उत्तर – पारा (Hg) ।
13. दो ऐसी धातुओं के नाम बताएँ जो सर्वाधिक अघातवर्ध्य तथा तन्य हों ।
उत्तर – सोना (Au) तथा चाँदी (Ag) |
14. विद्युतीय परिपथ बनाने में किस धातु का उपयोग किया जाता है ?
उत्तर – ताम्र (Cu).
15. किन्हीं दो उपधातु (मेटालॉयड्स) तत्वों के नाम एवं रासायनिक संकेत लिखें ।
उत्तर – (i) सिलिकान (Si), (ii) जर्मेनियम (Ge)।
16. एक ऐसी अधातु का नाम लिखें जो गैसीय अवस्था में पाई जाती है ।
उत्तर – हाइड्रोजन ।
17. दो उभयधर्मी ऑक्साइडों के नाम लिखें।
उत्तर – (i) ऐलुमिनियम ऑक्साइड (Al2O3), (ii) जिंक ऑक्साइड (ZnO).
18. पारद के एक अयस्क का नाम एवं रासायनिक सूत्र लिखें ।
उत्तर – अयस्क- सिनेबार सूत्र – Hgs.
19. सिनेबार किस धातु का अयस्क है ?
उत्तर – पारद ।
20. सबसे कम ऊष्मा चालकों के नाम बताएँ ।
उत्तर – सीसा तथा पारा ।
21. भू-पपर्टी में सर्वाधिक प्रचुर तत्व का नाम बताएँ ।
उत्तर – ऑक्सीजन
22. भू-पर्पटी में दूसरे सर्वाधिक प्रचुर तत्व का नाम बताएँ ।
उत्तर – सिलिकॉन |
23. क्या होता है जब धातु ऑक्सीजन से अभिक्रिया करती है ?
उत्तर – धातु ऑक्सीजन के साथ अभिक्रिया करके धातु ऑक्साइड बनाती है।
24. उन धातुओं के नाम बताएँ जो हाइड्रोजन के साथ अभिक्रिया करती है।
उत्तर – सोडियम (Na), पोटैशियम (K), कैल्सियम (Ca).
25. दो धातुओं का नाम बताएँ जो तनु अम्ल से हाइड्रोजन को विस्थापित करती है l
उत्तर – मैग्नीशियम (Mg), जिंक (Zn).
26. दो धातुओं का नाम बताएँ जो तनु अम्ल से हाइड्रोजन को विस्थापित नहीं कर सकती है ?
उत्तर – Cu, Au.
27. धातु एवं हाइड्रोजन के बीच अभिक्रिया को प्रदर्शित करने के लिए समीकरण लिखें।
उत्तर – Ca (s) + H2 (g) → CaH2 (s)
28. क्या होता है जब कोई धातु किसी तनु अम्ल के साथ अभिक्रिया करती है ?
उत्तर – इस अभिक्रिया में धातु के लवण तथा हाइड्रोजन गैस का निर्माण होता है।
उदाहरण- Zn (s) + 2HCl (ag) → ZnCl2 (ag) + H2 (g)
29. कौन-सी धातुएँ भाप के साथ भी अभिक्रिया नहीं करती हैं ?
उत्तर – सीसा, कॉपर, चाँदी तथा सोना ।
30. कौन-सी धातुएँ तनु हाइड्रोक्लोरिक अम्ल के साथ तेजी से अभिक्रिया करती हैं ?
उत्तर – मैग्नीशियम (Mg) |
31. दो ऐसी धातुओं के नाम लिखें जिनका गलनांक बहुत कम होता है।
उत्तर – (i) गैलियम, (ii) सीजियम ।
32. किस धातु को छोड़कर सभी धातुएँ कमरे के ताप पर ठोस होती है ?
उत्तर – पारा (मर्करी) ।
33. दो ऐसी धातुएँ हैं जो अति तनु HNO3 के साथ अभिक्रिया करके हाइड्रोजन गैस उत्सर्जित करती है। उन धातुओं के संकेत लिखें।
उत्तर – (i) Mg, (ii) Mn
34. दो अधातवर्ध्य धातुओं का नाम लिखें।
उत्तर – (i) सोना, (ii) चाँदी ।
35. एक अधातु का नाम लिखें जो कठोरतम होता है।
उत्तर – कार्बन के अपररूप हीरा ।
36. किन्हीं दो धातुओं के नाम लिखें जो जल में आग उत्पन्न करती है।
उत्तर – (i) पोटैशियम, (ii) सोडियम ।
37. आयरन की भाप के साथ अभिक्रिया का रासायनिक समीकरण लिखें ।
उत्तर – 3Fe + 4H2O → Fe3O4 + 4H2
38. सबसे अधिक अभिक्रियाशील धातु कौन-सी है ?
उत्तर – Li, K, Na.
39. सबसे कम अभिक्रियाशील धातु कौन-सी हैं ?
उत्तर – Ag, Au
40. धातु को उसके ऑक्साइड से प्राप्त करने के लिए किस रासायनिक प्रक्रिया का उपयोग किया जाता है ?
उत्तर – अपचयन की प्रक्रिया ।
41. कौन-सी धातु आसानी से संक्षारित नहीं होती है ?
उत्तर – सोना, चाँदी ।
42. कोई धातु ऑक्सीजन के साथ अभिक्रिया कर उच्च गलनांक वाला यौगिक निर्मित करती है। यह यौगिक जल में विलेय है । यह तत्व क्या है ?
उत्तर – कैल्सियम (Ca)।
43. खाद्य पदार्थ के डिब्बों पर जिंक की बजाय टिन की परत क्यों होती है ?
उत्तर – टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है।
44. ऑक्सीजन के साथ संयुक्त होकर अधातुएँ कैसा ऑक्साइड बनाती है ?
उत्तर – अम्लीय या उदासीन ऑक्साइड l
45. सबसे अधिक तन्य धातु का नाम बताएँ ।
उत्तर – सोना ।
46. कॉपर की एक मिश्रधातु का नाम बताएँ ।
उत्तर – पीतल ।
47. ताम्र एवं टिन के मिश्रधातु को क्या कहते है ?
उत्तर – काँसा ।
48. ताम्र एवं जिंक के मिश्रधातु को क्या कहते है ?
उत्तर – पीतल ।
49. सीसा (लेड) एवं टिन की एक मिश्रधातु का नाम बताएँ ।
उत्तर – सोल्डर ।
50. सोल्डर नामक मिश्रधातु के कौन-कौन से अवयव हैं ?
उत्तर – सीसा एवं टीन ।
51. इस्पात में कौन-सी अधातु उपस्थित रहती है ?
उत्तर – कार्बन ।
52. धातुओं से अपद्रव्य को हटाने के लिए सबसे अधिक प्रचलित विधि क्या है ?
उत्तर – विद्युत अपघटनी परिष्करण ।
53. अमलगम क्या है ?
उत्तर – मिश्रधातु में एक धातु पारा हो, तो उसे अमलगम कहते हैं ।
54. जिंक के साथ अन्य किस धातु को मिलाकर जिंक अमलगम बनाया जाता है ?
उत्तर – पारा (Hg)
55. शुद्ध सोना कितने कैरट का होता है ?
उत्तर – 24 कैरट का ।
56. एक ग्राम सोने से कितनी लंबी तार खींची जा सकती है ?
उत्तर – 2 किलोमीटर ।
लघु उत्तरीय प्रश्नोत्तर
1. अधातवर्ध्यता एवं तन्यता का अर्थ बताएँ ।
उत्तर – अधातवर्ध्यता- धातुओं को हथौड़े से पीटकर चादरें बनायी जा सकती हैं। धातुओं के इस गुण को आधातवर्धता कहते हैं। जैसे- सोना, चाँदी ।
तन्यता- धातुओं को खींचकर तार बनाए जा सकते हैं। धातुओं के इस गुण को तन्यता कहते हैं। जैसे— सोना, चाँदी ।
2. धातुओं के भौतिक गुणधर्मों का उल्लेख करें ।
उत्तर – धातुओं के भौतिक गुणधर्म –
(i) धातुओं की अपनी विशेष चमक होती है
(ii) ये अघातवर्ध्य तथा तन्य होती है ।
(iii) सोडियम तथा पोटैशियम को छोड़कर अन्य सभी धातुएँ सामान्यतः कठोर होती है।
(iv) धातुओं के द्रवणांक एवं क्वथनांक उच्च होते हैं।
3. उभयधर्मी ऑक्साइड क्या होते हैं ? किन्हीं दो उभयधर्मी ऑक्साइडों के उदाहरण दें।
उत्तर – ऐसे धात्विक ऑक्साइड जिनकी प्रकृति अम्लीय तथा क्षारकीय दोनों प्रकार की होती है। उन्हें उभयधर्मी ऑक्साइड कहते हैं ।
Al2O3 तथा ZnO उभयधर्मी ऑक्साइडों के उदाहरण हैं।
4. जिंक ऑक्साइड को उभयधर्मी ऑक्साइड क्यों कहा जाता है ?
उत्तर – जिंक ऑक्साइड को उभयधर्मी ऑक्साइड इसलिए कहा जाता है क्योंकि यह अम्लीय तथा क्षारीय दोनों ही गुणों को प्रदर्शित करता है।
5. सोडियम धातु को मिट्टी के तेल में डुबोकर क्यों रखा जाता है ?
उत्तर – सोडियम अभिक्रियाशील धातु है । यह हवा में स्वतः जलने लगती है और सोडियम ऑक्साइड का निर्माण करती है। इसलिए इन्हें सुरक्षित रखने तथा आकस्मिक आग को रोकने के लिए मिट्टी तेल में डुबोकर रखा जाता है।
4Na + O2 → 2Na2O
6. जब कोई धातु तनु हाइड्रोक्लोरिक अम्ल से अभिक्रिया करती है तो कौन-सी गैस सदैव उत्पन्न होती है ? इस अभिक्रिया की रासायनिक समीकरण लिखें।
उत्तर – गैस- हाइड्रोजन,
रासायनिक समीकरण- Zn + 2HCl → ZnCl2 + H2 ↑
7. जब जिंक को आयरन (II) सल्फेट के घोल में डालते हैं तो आप क्या प्रेक्षित करेंगे ? इसमे होनेवाली रसायनिक अभिक्रिया को लिखें ।
उत्तर – जिंक को आयरन (II) सल्फेट के घोल में डालने से आयरन विस्थापित हो जाता है और जिंक सल्फेट का घोल बन जाता है।
Zn + FeSO4 → ZnSO4 + Fe
8. अभिक्रियाशील धातु को तनु हाइड्रोक्लोरिक अम्ल में डाला जाता है तो कौन-सी गैस निकलती है ? आयरन के साथ तनु H2SO4 की रासायनिक अभिक्रिया लिखें।
उत्तर – हाइड्रोजन गैस ।
रासायनिक अभिक्रिया – Fe + H2SO4 → FeSO4 + H2
9. जल के साथ कैल्सियम तथा पोटैशियम की अभिक्रिया का समीकरण लिखें ।
उत्तर – (i) Ca + 2 H2O → Ca (OH)2 + H2
(ii) 2 K + 2 H2O → 2 KOH + H2 + ऊष्मा
10. आयनिक यौगिक या वैद्युत संयोजक यौगिक किसे कहते हैं ?
उत्तर – जिन यौगिकों के अणु में वैद्युत संयोजक बंधन या आयनिक बंधन रहता है उन्हें वैद्युत संयोजक या आयनिक यौगिक कहते हैं
11. आयनिक यौगिकों का गलनांक उच्च क्यों होता है ?
उत्तर – आयनिक यौगिकों का गलनांक एवं क्वथनांक उच्च होता है क्योंकि मजबूत अंतर-आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की पर्याप्त मात्रा की आवश्यकता होती है।
12. (i) सोडियम ऑक्साइड (Na2O) एवं (ii) मैग्नीशियम ऑक्साइड (MgO) में कौन से आयन उपस्थित हैं ?
उत्तर – (i) Na2O में उपस्थित आयन → Na+ एवं O2-
(ii) MgO में उपस्थित आयन → Mg2+ एवं O2-
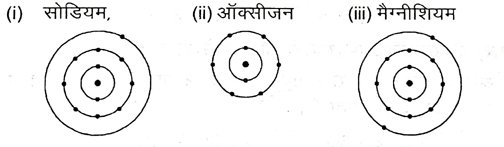
13. (i) सोडियम, (ii) ऑक्सीजन एवं (iii) मैग्नीशियम का इलेक्ट्रॉन बिंदु संरचना दर्शाएँ ।
उत्तर –
14. अम्लराज (ऐक्वारेजिया) क्या है ?
उत्तर – सांद्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल का (3 : 1) के मिश्रण को अम्लराज कहते हैं । यह सोना को गला देता है ।
15. खनिज एवं अयस्क में अंतर स्पष्ट करें।
उत्तर – खनिज एवं अयस्क में अंतर –

16. धातुकर्म किसे कहते हैं ?
उत्तर – अयस्क से धातु का निष्कर्षण तथा उसका परिष्करण कर उपयोगी बनाने के प्रक्रम को धातुकर्म कहते हैं ।
17. निम्नांकित पदों को परिभाषित करें
(i) खनिज,
(ii) अयस्क,
(iii) गैंग ।
उत्तर – (i) खनिज– प्रकृति में पाए जानेवाले ऐसे पदार्थ जिनमें धातु या धातुओं के यौगिक उपस्थित रहते हैं उसे खनिज कहते है।
जैसे- एलुमिना — Al2O3.2H2O.
(ii) अयस्क – ऐसे खनिज जिनसे धातुएँ आसानी से तथा सुगमतापुर्वक लाभप्रद ढंग से प्राप्त की जा सकती हैं उसे अयस्क कहते हैं ।
जैसे— कॉपर पायराइट ( CuFeS2), एलुमिना (Al2O3.2H2O).
(ii) गैंग– अयस्क में मिली हुई अशुद्धियों को गैंग कहते हैं ।
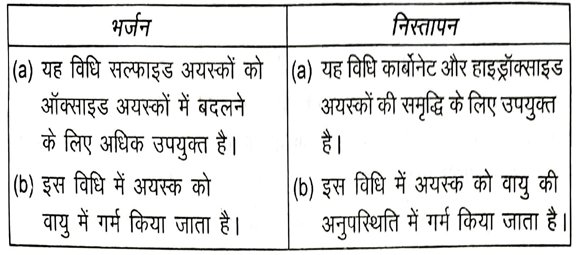
18. भर्जन एवं निस्तापन में अंतर स्पष्ट करें ।
उत्तर – भर्जन एवं निस्तापन में अंतर –
19. धातुएँ तनु अम्लों से हाइड्रोजन विस्थापित करती हैं जबकि अधातुएँ ऐसा नहीं करती है। कारण सहित समझाएँ ।
उत्तर – अम्लों में हाइड्रोजन आयन (H+) होते हैं। धातुएँ विद्युत धनात्मक होती हैं अर्थात् धातुएँ इलेक्ट्रॉन का त्याग करती हैं जिससे अभिक्रिया द्वारा उत्पन्न हाइड्रोजन आयन (H+) को इलेक्ट्रॉन की पूर्ति हो जाती है। इसके विपरीत अधातुएँ विद्युत ऋणात्मक होती हैं अर्थात् अधातुएँ इलेक्ट्रॉन ग्राही हैं जिसके कारण हाइड्रोजन आयन (H+) को इलेक्ट्रॉन की पूर्ति नहीं हो सकती है। अतः अधातुएँ, तनु अम्लों हाइड्रोजन को विस्थापित नहीं कर सकती हैं।
20. संक्षारण को परिभाषित करें। संक्षारण से बचने के दो उपाय लिखें ।
उत्तर – वायु तथा नमी की उपस्थिति में किसी धातु का परत बन-बन कर नष्ट होना संक्षारण कहलाता है l
संक्षारण से बचने के उपाय –
(i) यशदलेपन – जिंक की परत चढ़ाकर, (ii) पेंट कर – धातु के ऊपर पेंट करके ।
21. संक्षारण के लिए आवश्यक शर्तें क्या हैं ?
उत्तर – (i) वायु (ऑक्सीजन) की उपस्थिति,
(ii) नमी (जल) की उपस्थिति,
(iii) अभिक्रियाशील धातु की उपस्थिति ।
22. कुछ धातुओं को वायु में खुला छोड़ देने पर उनकी सतहें भद्दी हो जाती हैं। इसे कारण सहित समझाएँ ।
उत्तर – वायु में खुला छोड़ने पर धातु की सतह पर वायु से अभिक्रिया होने के कारण ऑक्साइड, कार्बोनेट या सल्फाइड यौगिक की सतह बन जाती है । इसीलिए धातु की चमक नष्ट हो जाती है।
23. लोहे को जंग से बचाने के लिए दो तरीके बताएँ ।
उत्तर – (i) यशदलेपन- इस विधि में लोहे की वस्तुओं के ऊपर जिंक की एक परत चढ़ाई जाती है।
(ii) पेंटिंग- इस प्रक्रिया में लोहे की वस्तुओं पर पेंट किया जाता है।
24. मिश्रधातु किसे कहते हैं ? इसके दो नाम तथा उपयोग लिखें ।
उत्तर – किसी धातु के किसी अन्य धातु अथवा अधातु के साथ गलित अवस्था में मिलाने से जो समांगी मिश्रण प्राप्त होता है उसे मिश्रधातु कहते हैं ।
मिश्रधातु- (i) इस्पात – जहाज, पूलों एवं वाहनों के निर्माण में ।
(ii) पीतल – बर्तन निर्माण में ।
25. प्लैटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है क्यों ?
उत्तर – प्लैटिनम, सोना एवं चाँदी बहुत कम अभिक्रियाशील है तथा ये संक्षारित नहीं होते हैं। उनकी चमक भी तेज होती है। अतः इनका उपयोग आभूषण बनाने के लिए किया जाता है।
26. सोडियम, पोटैशियम एवं लिथियम को तेल के अंदर संग्रहित किया जाता है क्यों ?
उत्तर – सोडियम, पोटैशियम एवं लिथियम इतनी अभिक्रियाशील हैं कि खुले में रखने पर तुरंत (तत्काल) आग पकड़ लेती है। उन्हें बचाने तथा आग लगने से रोकने के लिए उन्हें किरोसिन तेल के अंदर संग्रहित किया जाता है।
27. ऐलुमिनियम अत्यधिक अभिक्रियाशील धातु है, फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने के लिए किया जाता है क्यों ?
उत्तर – ऐलुमिनियम संक्षारित नहीं होता, साथ ही यह उष्मा का सुचालक है ।
28. धातु निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है क्यों ?
उत्तर – किसी धातु को उसके सल्फाइड और कार्बोनेट की अपेक्षा उसके ऑक्साइड से प्राप्त करना अधिक आसान है। इसलिए अपचयन से पहले धातु सल्फाइड एवं कार्बोनेट को धातु ऑक्साइड में बदल लेना चाहिए।
29. आपने ताँबे के मलीन बर्तन को नींबू या इमली के रस से साफ करते अवश्य देखा होगा। ये खट्टे पदार्थ बर्तन को साफ करने में क्यों प्रभावी हैं ?
उत्तर – ताँबा पर क्षारीय कॉपर कार्बोनेट की हरी परत बन जाने के कारण उसका रंग मलीन हो जाता है। जब ताँबे के मलीन बर्तन को नींबू या इमली के रस से साफ किया जाता है, तो नींबू या इमली में उपस्थित अम्लीय पदार्थ क्षरीय कॉपर कार्बोनेट से अभिक्रिया कर उसे ताँबे के बर्तन से अलग कर देता है जिससे बर्तन साफ होकर चमकने लगता है। खट्टे पदार्थ क्षारीय कॉपर कार्बोनेट को हटाने में सक्षम होता है, इसलिए खट्टे पदार्थ बर्तन को साफ करने में प्रभावी होता है।
30. गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है परंतु इस्पात (लोहा) का नहीं क्यों ?
उत्तर – ताँबा जल के साथ किसी भी स्थिति में अभिक्रिया नहीं करता है। लेकिन लोहा भाप के साथ अभिक्रिया कर ऑक्साइड एवं हाइड्रोजन गैस बनाती है। इसलिए गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है लेकिन लोहा अर्थात् इस्पात का उपयोग नहीं किया जाता है।
31. लोहे के फ्राइंग फैन को जंग से बचाने के लिए कौन-कौन सी विधि उपयुक्त है ?
उत्तर – (i) ग्रीज लगाकर, (ii) पेंट लगाकर, (iii) जिंक की परत चढ़ाकर ।
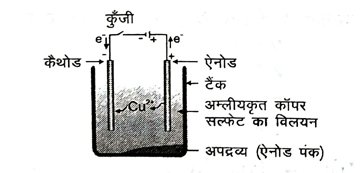
32. ताँबे के विद्युत अपघटनी परिष्करण में आप एनोड, कैथोड एवं विद्युत अपघट किसे कहते है ?
उत्तर – एनोड– अशुद्ध ताँबे की छड़ को एनोड कहते हैं।
कैथोड– शुद्ध ताँबे की छड़ को कैथोड कहते हैं।
विद्युत अपघटय- धातु के लवण विलयन (कॉपर सल्फेट) को विद्युत अपघटय कहते हैं ।
दीर्घ उत्तरीय प्रश्नोत्तर
1. आयनिक अथवा विद्युत संयोजी यौगिकों के गुणधर्म लिखें ।
उत्तर – आयनिक अथवा विद्युत संयोजी यौगिकों के गुणधर्म –
(i) सभी आयनिक यौगिक ठोस अवस्था में होते हैं।
(ii) आयनिक यौगिकों का गलनांक तथा क्वथनांक उच्च होता है ।
(iii) अधिकांश आयनिक यौगिक जल में विलेय होते हैं ।
(iv) बेंजीन तथा मिट्टी के तेल जैसे कार्बनिक विलायकों में ये यौगिक विलेय नहीं होते ।
(v) इन यौगिकों का जलीय विलयन अथवा इन यौगिकों की गलित अवस्था विद्युतधारा की वाहक होती है l
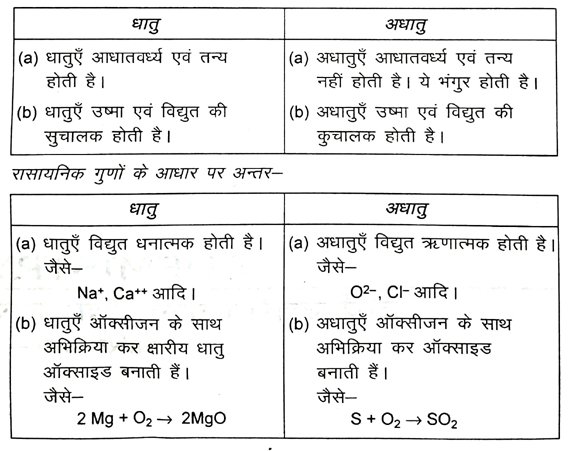
2. धातुओं एवं अधातुओं में कोई दो भौतिक और कोई दो रासायनिक अंतर लिखें।
उत्तर – भौतिक गुणों के आधार पर अन्तर –
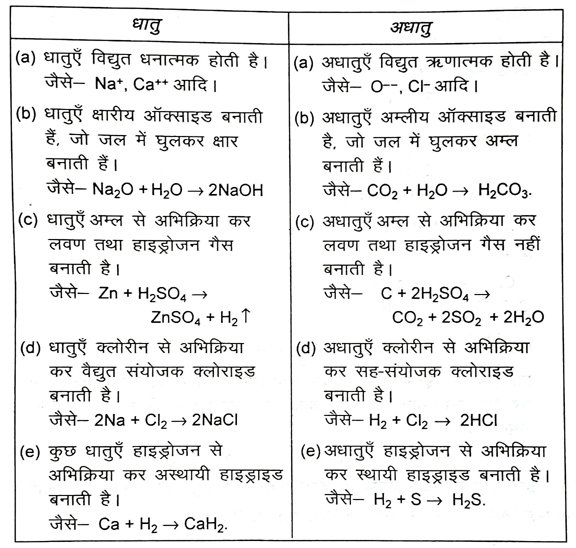
3. रासायनिक गुणधर्मों के आधार पर धातुओं एवं अधातुओं में विभेद करें।
उत्तर – धातुओं तथा अधातुओं में अन्तर –
4. किसी धातु M के विद्युत अपघटनी परिष्करण में आप ऐनोड, कैथोड एवं विद्युत अपघट्य किसे बनाएँगे ?
उत्तर – अशुद्ध M धातु के एक मोटे टुकड़े को एनोड बनाया जाता है तथा शुद्ध M धातु की पतली पट्टी को कैथोड बनाया जाता है। जल में घुलनशील M धातु के लवण का उपयोग विद्युत अपघट्य के रूप में किया जाता है।
5. सोडियम तथा क्लोरीन परमाणुओं के लिए इलेक्ट्रॉन डॉट संरचना लिखें। ये रासायनिक आबंध कैसे बनाते हैं ? इस प्रकार बने आबंध के प्रकार का नाम बताएँ ।
उत्तर – इलेक्ट्रॉन डॉट संरचना-

सोडियम एक इलेक्ट्रान त्यागकर Na+ आयन एवं क्लोरीन एक इलेक्ट्रॉन ग्रहण कर Cl आयन बनाता है। इसके बाद दोनों मिलकर आयनिक विधि द्वारा NaCl का निर्माण करते हैं।
इस प्रकार बने आबंध को आयनिक आबंध कहते हैं।
6. इलेक्ट्रॉन के स्थानांतरण के द्वारा Na2O एवं MgO की रचना को दर्शाएँ।
उत्तर – इलेक्ट्रॉन के स्थानांतरण के द्वारा Na2O की रचना-

7. आयनिक यौगिक ठोस अवस्था में विद्युत का चालन नहीं करते है परन्तु गलित अवस्था में या जलीय विलयन के रूप में विद्युत का चालन करते हैं। इसके पीछे क्या वैज्ञानिक कारण है ?
उत्तर – ठोस अवस्था में आयनिक यौगिक विद्युत का चालन नहीं करते हैं क्योंकि ठोस अवस्था में दृढ़ संरचना के कारण आयनों की गति संभव नहीं होती है। लेकिन आयनिक यौगिक गलित अवस्था में विद्युत का चालन करते हैं क्योंकि गलित अवस्था में विपरीत आवेश वाले आयनों के मध्य स्थिरवैद्युत आकर्षण बल ऊष्मा के कारण कमज़ोर पड़ जाता है। इसलिए आयन स्वतंत्र रूप से गमन करते हैं एवं विद्युत का चालन करते हैं ।
चित्रात्मक प्रश्नोत्तर
1. धातुओं में चालकता का गुण प्रकट करने के लिए किए गए प्रयोग के चित्र में संख्याकित भागों के नाम लिखें –
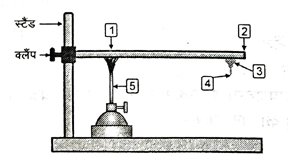
उत्तर – (1) धातु का छड़,
(2) छड़ का खुला सिरा,
(3) मोम,
(4) काँटी या पिन,
(5) बर्नर ।
2. आपको एक हथौड़ा, बैटरी, बल्ब, तार एवं स्विच दिया गया है- (i) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों को कैसे अलग कर सकते हैं ? (ii) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिताओं आकलन करें।
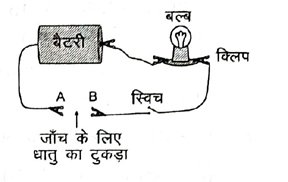
उत्तर – (i) दिए गए चित्र के अनुरूप हम एक परिपथ बनाएँगे। यदि नमूने को विद्युत परिपथ में लगाने पर स्विच ऑन करने पर बल्ब जलता है, तो दिया गया नमूना एक धातु है।
(ii) यह विधि धातु एवं अधातु की जाँच के लिए बहुत उपयोगी है, किंतु ग्रेफाइट एक अपवाद है क्योंकि यह अधातु होते हुए भी विद्युत का चालक है।
3. प्रत्यूष ने सल्फर चूर्ण को स्पैचुला में लेकर उसे गर्म किया। चित्र के अनुसार एक परखनली को उलटा करके उसने उत्सर्जित गैस को एकत्र किया –
(i) गैस की क्रिया क्या होगी –
(a) सूखे लिटमस पत्र पर ? (b) आर्द्र लिटमस पत्र पर
(ii) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखें।
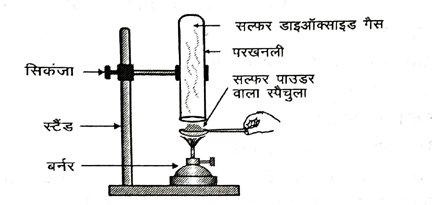
उत्तर – (i) (a) सूखे लिटमस पत्र पर कोई क्रिया नहीं होती है।
(b) यह गैस भींगे लिटमस पत्र को लाल कर देती है।
(ii) S + O2 → SO2
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here