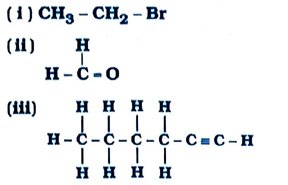
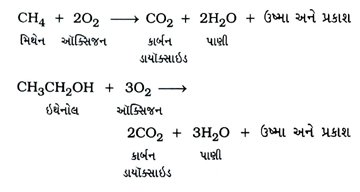
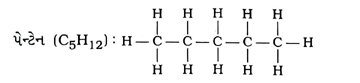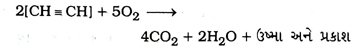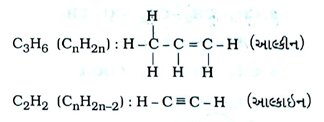Gujarat Board | Class 10Th | Chemistry | Model Question Paper & Solution | Chapter – 4 Carbon and its Compounds (કાર્બન અને તેમાં સંયોજનો)
પ્રકરણસાર
- તમામ સજીવ સંરચનાઓ (પ્રાણીઓ અને વનસ્પતિઓ) કાર્બન પર આધારિત છે.
- પૃથ્વીના પોપડામાં ખનિજ સ્વરૂપે કાર્બન 0.02 % છે.
- તત્ત્વોની સક્રિયતા સંપૂર્ણ ભરાયેલ બાહ્ય કોશ એટલે કે નિષ્ક્રિય વાયુ જેવી રચના પ્રાપ્ત કરવાની વૃત્તિને આધારે સમજાવી શકાય છે.
- સહસંયોજક બંધ (Covalent Bond) : બે કે તેથી વધુ પરમાણુઓ વચ્ચે ઇલેક્ટ્રૉનની ભાગીદારી દ્વારા રચાતા બંધને સહસંયોજક બંધ કહે છે.
- કાર્બનનાં ત્રણ અપરરૂપો છે : (1) હીરો,(2) ગ્રેફાઇટ અને (3) ફુલેરિન.
- કેટેનેશન (Catenation) : કાર્બન પરમાણુ અન્ય કાર્બન પરમાણુઓ સાથે બંધ બનાવવાની અદ્વિતીય ક્ષમતા ધરાવે છે, જેથી વધુ સંખ્યામાં અણુઓ (સંયોજનો) બને છે. કાર્બનના આ ગુણધર્મને કેટેનેશન કહે છે.
- જે કાર્બનિક સંયોજનોમાં કાર્બન પરમાણુઓ માત્ર એકલબંધથી જોડાયેલા હોય તેવાં સંયોજનોને સંતૃપ્ત કાર્બન સંયોજનો (Saturated carbon compound) કહે છે. જ્યારે જે કાર્બનિક સંયોજનોમાં બે કે તેથી વધુ કાર્બન પરમાણુઓ દ્વિબંધ કે ત્રિબંધથી જોડાયેલા હોય તેવાં સંયોજનોને અસંતૃપ્ત કાર્બન સંયોજનો (Unsaturated carbon compound) કહે છે.
- અસંતૃપ્ત કાર્બન સંયોજનો સંતૃપ્ત કાર્બન સંયોજનો કરતાં વધુ ક્રિયાશીલ છે.
- બંધારણીય સમઘટકો (Structural isomers) : સમાન આણ્વીય સૂત્ર પરંતુ ભિન્ન બંધારણો ધરાવતાં સંયોજનોને બંધારણીય સમઘટકો કહે છે.
- હાઇડ્રોકાર્બન : સંતૃપ્ત હાઇડ્રોકાર્બનને આલ્કેન કહે છે. અસંતૃપ્ત હાઇડ્રોકાર્બન કે જે એક અથવા વધુ દ્વિબંધ ધરાવે છે, તેને આલ્કીન તથા એક અથવા વધુ ત્રિબંધ ધરાવે છે, તેને આલ્કાઇન કહે છે.
- ક્રિયાશીલ સમૂહો (Functional groups) : વિષમ ૫૨માણુઓ અને તેમને સમાવતા સમૂહો કે જે સંયોજનોને વિશિષ્ટ ગુણધર્મો આપે છે, જે કાર્બન-શૃંખલાની લંબાઈ અને સ્વભાવ પર આધારિત નથી, તેમને ક્રિયાશીલ સમૂહો કહે છે.
- સમાનધર્મી શ્રેણી (Homologous series) : કાર્બનિક સંયોજનોની એવી શ્રેણી કે જેમાં કાર્બન શૃંખલામાં રહેલ હાઇડ્રોજનને સમાન પ્રકારના ક્રિયાશીલ સમૂહ દ્વારા વિસ્થાપિત કરવામાં આવેલ હોય, તેને સમાનધર્મી શ્રેણી કહે છે.
- ઑક્સિડેશનકર્તા (Oxidising agent) : કેટલાક પદાર્થો અન્ય પદાર્થોમાં ઑક્સિજન ઉમેરવા માટે સક્ષમ હોય છે, જેને ઑક્સિડેશનકર્તા કહે છે.
દા. ત., આલ્કલાઇન પોટૅશિયમ પરમેંગેનેટ, ઍસિડિક પોટૅશિયમ ડાયક્રોમેટ.
- યોગશીલ પ્રક્રિયા (Addition reaction): જે રાસાયણિક પ્રક્રિયા દરમિયાન કાર્બનિક સંયોજનોમાં બીજો અણુ ઉમેરાવાથી નવું કાર્બનિક સંયોજન બને, તો તે પ્રક્રિયાને યોગશીલ પ્રક્રિયા કહે છે.
- વિસ્થાપન પ્રક્રિયા (Substitution reaction) : જે પ્રક્રિયામાં કાર્બનિક સંયોજનોના અણુમાં રહેલા પરમાણુ કે પરમાણુઓના સમૂહનું અન્ય પરમાણુ કે પરમાણુઓના સમૂહ વડે વિસ્થાપન થાય, તો તે પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છે.
- એસ્ટરીકરણ (Esterification) : ખનીજ ઍસિડ ઉદ્દીપકની હાજરીમાં કાર્બોક્સિલિક ઍસિડ અને પરિશુદ્ધ આલ્કોહોલ વચ્ચેની પ્રક્રિયાથી એસ્ટર અને પાણી નીપજે છે. આ પ્રક્રિયાને એસ્ટરીકરણ કહે છે.
- સાબુનીકરણ (Saponification) : એસ્ટરમાંથી આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડના સોડિયમ ક્ષારમાં રૂપાંતર થવાની ક્રિયાને સાબુનીકરણ કહે છે.
- સાબુ અને પ્રક્ષાલકની પ્રક્રિયા અણુમાં રહેલા જલાનુરાગી અને જલવિતરાગી સમૂહોની હાજરી પર આધારિત છે. તેની મદદથી તૈલી મેલનું પાયસ રચાય છે અને તે દૂર થાય છે.
પ્રશ્નોત્તર
પ્રશ્ન 1. પૃથ્વીના પોપડામાં અને વાતાવરણમાં કાર્બનનું પ્રમાણ જણાવો.
ઉત્તર : તમામ સજીવ સંરચનાઓ કાર્બન પર આધારિત છે.
→ પૃથ્વીના પોપડામાં અને વાતાવરણમાં કાર્બનની માત્રા (હાજરી – પ્રમાણ) ખૂબ જ અલ્પ છે.
→ પૃથ્વીના પોપડામાં કાર્બનનું પ્રમાણ 0.02 % છે. તે કાર્બોનેટ, હાઇડ્રોજન કાર્બોનેટ, કોલસો અને પેટ્રોલિયમ સ્વરૂપે રહેલો છે.
→ વાતાવરણમાં કાર્બનનું પ્રમાણ 0.03% છે. તે કાર્બન ડાયૉક્સાઇડ સ્વરૂપે હોય છે.
4.1 કાર્બનમાં બંધન – સહસંયોજક બંધ
પ્રશ્ન 2. આયનીય સંયોજનોના ગુણધર્મો જણાવો.
ઉત્તર : આયનીય સંયોજનોના ગુણધર્મો નીચે મુજબ છે :
(1) તેનાં ગલનબિંદુ અને ઉત્કલનબિંદુ પ્રમાણમાં ઊંચા હોય છે.
(2) તેમની વચ્ચે આંતરઆયનીય આકર્ષણ બળો પ્રબળ હોય છે.
(3) તેઓ તેમના જલીય દ્રાવણમાં કે પીગળેલી અવસ્થામાં વિદ્યુતનું વહન કરે છે.
(4) તેઓ મોટા ભાગે ઘન અવસ્થા ધરાવે છે.
(5) તેઓ સામાન્ય રીતે પાણીમાં સુદ્રાવ્ય હોય છે.
પ્રશ્ન 3. કાર્બન સંયોજનોના ગુણધર્મો જણાવો. અથવા સહસંયોજક સંયોજનોના ગુણધર્મો જણાવો.
ઉત્તર : કાર્બન (સહસંયોજક) સંયોજનોના ગુણધર્મો નીચે મુજબ છે :
(1) તેનાં ગલનબિંદુ અને ઉત્કલનબિંદુ પ્રમાણમાં નીચાં હોય છે.
(2) તેમની વચ્ચે આંતરઆણ્વીય આકર્ષણ બળો નિર્બળ હોય છે.
(3) તેઓ વિદ્યુતના અવાહકો છે.
(4) તેઓ ઘન, પ્રવાહી અથવા વાયુ અવસ્થા ધરાવે છે.
(5) તેઓ સામાન્ય રીતે પાણીમાં અદ્રાવ્ય, પરંતુ કાર્બનિક દ્રાવકોમાં દ્રાવ્ય હોય છે.
પ્રશ્ન 4. કાર્બનની ચતુઃસંયોજકતા સમજાવો.
ઉત્તર : કાર્બનનો પરમાણ્વીય ક્રમાંક 6 છે.
→ આથી કાર્બન પરમાણુની ઇલેક્ટ્રૉન-રચના નીચે મુજબ થશે :
KL
6C:2 4
આમ, કાર્બન પરમાણુ તેના બાહ્ય કક્ષામાં ચાર ઇલેક્ટ્રૉન ધરાવે છે.
→ કોઈ પણ તત્ત્વની પ્રતિક્રિયાત્મકતા (સક્રિયતા) સંપૂર્ણ ભરાયેલ બાહ્યતમ કક્ષા એટલે કે નિષ્ક્રિય વાયુ જેવી રચના પ્રાપ્ત કરવાની વૃત્તિને આધારે સમજાવી શકાય છે.
→ આયનીય સંયોજનોની રચના કરતાં તત્ત્વો નિષ્ક્રિય વાયુ જેવી રચના બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉન મેળવીને અથવા ગુમાવીને પ્રાપ્ત કરે છે.
→ કાર્બન પરમાણુને નિષ્ક્રિય વાયુ જેવી ઇલેક્ટ્રૉન-રચના (અષ્ટક રચના) પ્રાપ્ત કરવા માટે તેણે ચાર ઇલેક્ટ્રૉન મેળવવા અથવા ગુમાવવા જરૂરી છે.
→ જો કાર્બન પરમાણુને ઇલેક્ટ્રૉન મેળવવા કે ગુમાવવા હોય, તો
( 1 ) તે ચાર ઇલેક્ટ્રૉન મેળવીને C4– એનાયન (ઋણાયન) બનાવી શકે છે, પરંતુ છ પ્રોટોન ધરાવતા પરમાણુ કેન્દ્ર માટે દસ ઇલેક્ટ્રૉન એટલે કે ચાર વધારાના ઇલેક્ટ્રૉન સમાવવા મુશ્કેલ થઈ શકે છે, જે અસ્થાયી છે.
( 2 ) તે ચાર ઇલેક્ટ્રૉન ગુમાવીને C4+ કેટાયન (ધનાયન) બનાવી શકે છે, પરંતુ છ પ્રોટોન ધરાવતા પરમાણુ કેન્દ્ર માટે ચાર ઇલેક્ટ્રૉન દૂર કરીને કેન્દ્રમાં માત્ર બે ઇલેક્ટ્રૉન સમાવતો કાર્બન કેટાયન બનાવવા માટે મોટા પ્રમાણમાં ઊર્જાની જરૂર પડે છે, જે અસ્થાયી છે.
→ ટૂંકમાં, કાર્બન પરમાણુ વિદ્યુત સંયોજકતાથી એટલે કે આયોનિક બંધથી જોડાઈ શકતો નથી.
→ આથી કાર્બન પરમાણુ અન્ય કાર્બન પરમાણુઓ અથવા અન્ય તત્ત્વોના પરમાણુઓ સાથે સંયોજકતા ઇલેક્ટ્રૉનની ભાગીદારી કરીને અણુનું નિર્માણ કરે છે.
→ બે પરમાણુઓના બાહ્યતમ કોશના ઇલેક્ટ્રૉનની ભાગીદારી દ્વારા રચાતા બંધને સહસંયોજક બંધ કહે છે.
→ સહસંયોજક બંધની રચનામાં ભાગીદારી પામતા ઇલેક્ટ્રૉન બંને પરમાણુઓની બાહ્યતમ કક્ષાના હોય છે અને બંને પરમાણુઓ નિષ્ક્રિય વાયુ જેવી અષ્ટક રચના પ્રાપ્ત કરે છે.
પ્રશ્ન 5. હાઇડ્રોજન અણુ(H2)માં સહસંયોજક બંધની રચના સમજાવો.
ઉત્તર : હાઇડ્રોજનનો પરમાણ્વીય ક્રમાંક 1 છે. તેથી તેની ઇલેક્ટ્રૉન- રચના K 1 છે.
→ આમ, હાઇડ્રોજન તેના K કક્ષા(કોશ)માં 1 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ K કક્ષાને સંપૂર્ણ ભરવા માટે વધુ એક ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી હાઇડ્રોજનના બે પરમાણુઓ તેમના K કક્ષાના એક-એક ઇલેક્ટ્રૉનની ભાગીદારી કરી, હાઇડ્રોજન અણુ(H2)નું નિર્માણ કરે છે.
→ પરિણામે, હાઇડ્રોજનનો પ્રત્યેક ૫૨માણુ તેની નજીકના નિષ્ક્રિય વાયુ હિલિયમ (He) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના K કોશમાં બે ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ બે સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ચોકડી દ્વારા દર્શાવેલું છે.
→ H2 અણુમાં ભાગીદારી પામેલ ઇલેક્ટ્રૉનની જોડ (ઇલેક્ટ્રૉન-યુગ્મ) બે હાઇડ્રોજન પરમાણુઓ વચ્ચે એક્લબંધ રચે છે, જે નીચે દર્શાવ્યા મુજબ બે પરમાણુઓ વચ્ચે રેખા દ્વારા પણ રજૂ કરી શકાય છે.
પ્રશ્ન 6. ક્લોરિન અણુ(Cl2)માં સહસંયોજક બંધની રચના સમજાવો.
ઉત્તર : ક્લોરિનનો પરમાણ્વીય ક્રમાંક 17 છે. તેથી તેની ઇલેક્ટ્રૉન-
→ આમ, ક્લોરિન તેની M કક્ષામાં 7 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ M કક્ષાને સંપૂર્ણ ભરવા માટે વધુ એક ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી ક્લોરિનના બે પરમાણુઓ તેમના M કક્ષાના એક-એક ઇલેક્ટ્રૉનની ભાગીદારી કરી, ક્લોરિન અણુ(Cl2)નું નિર્માણ કરે છે.
→ પરિણામે, ક્લોરિનનો પ્રત્યેક પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ આર્ગોન (Ar) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના M કક્ષામાં આઠ ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ બે સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ચોકડી દ્વારા દર્શાવેલું છે.
પ્રશ્ન 7. એમોનિયા સમજાવો. અણુ(NH3)માં સહસંયોજક બંધની રચના
ઉત્તર : એમોનિયાના અણુમાં મધ્યસ્થ પરમાણુ નાઇટ્રોજન છે. તેનો પરમાણ્વીય ક્રમાંક 7 છે. તેથી તેની ઇલેક્ટ્રૉન-રચના

છે.
→ આમ, નાઇટ્રોજન તેની L કક્ષામાં 5 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ L કક્ષાને સંપૂર્ણ ભરવા માટે વધુ ત્રણ ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી હાઇડ્રોજનના ત્રણ પરમાણુઓ તેમના K કક્ષાના એક-એક ઇલેક્ટ્રૉનની ભાગીદારી કરી, એમોનિયાના અણુ(NHg)નું નિર્માણ કરે છે.
→ પરિણામે, એમોનિયામાંનો નાઇટ્રોજન પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ નિયોન (Ne) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના L કક્ષામાં આઠ ઇલેક્ટ્રૉન ધરાવે છે. જ્યારે હાઇડ્રોજન પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ હિલિયમ (He) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના K કક્ષામાં ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ ત્રણ સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ટપકાં અને ચોકડી દ્વારા દર્શાવેલું છે.
પ્રશ્ન 8. પાણીના અણુ(H2O)માં સહસંયોજક બંધની રચના સમજાવો.
ઉત્તર : પાણીના અણુમાં મધ્યસ્થ પરમાણુ ઑક્સિજન છે. તેનો પરમાણ્વીય ક્રમાંક 8 છે. તેથી તેની ઇલેક્ટ્રૉન-રચના

છે.
→ આમ, ઑક્સિજન તેની L કક્ષામાં 6 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ L કક્ષાને સંપૂર્ણ ભરવા માટે વધુ બે ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી હાઇડ્રોજનના બે પરમાણુઓ તેમના K કક્ષાના એક-એક ઇલેક્ટ્રૉનની ભાગીદારી કરી, પાણીના અણુ(H2O)નું નિર્માણ કરે છે.
→ પરિણામે, પાણીમાંનો ઑક્સિજન પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ નિયોન (Ne) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેની L ક્ષામાં આઠ ઇલેક્ટ્રૉન ધરાવે છે. જ્યારે હાઇડ્રોજન પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ હિલિયમ (He) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેની K કક્ષામાં બે ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ બે સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ટપકાં અને ચોકડી દ્વારા દર્શાવેલું છે.
પ્રશ્ન 9. મિથેનના અણુ(CH4)માં સહસંયોજક બંધની રચના સમજાવો.
ઉત્તર : મિથેન અણુમાં મધ્યસ્થ પરમાણુ કાર્બન છે. તેનો પરમાણ્વીય ક્રમાંક 6 છે. તેથી તેની ઇલેક્ટ્રૉન-રચના

છે.
→ આમ, કાર્બન તેની L કક્ષામાં 4 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ L કક્ષાને સંપૂર્ણ ભરવા માટે વધુ ચાર ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી હાઇડ્રોજનના ચાર પરમાણુઓ તેમના K કક્ષાના એક-એક ઇલેક્ટ્રૉનની ભાગીદારી કરી, મિથેનના અણુ(CHĀ)નું નિર્માણ કરે છે.
→ પરિણામે, મિથેનમાંનો કાર્બન પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ નિયોન (Ne) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના L કક્ષામાં આઠ ઇલેક્ટ્રૉન ધરાવે છે. જ્યારે હાઇડ્રોજન પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ હિલિયમ (He) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના K કક્ષામાં બે ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ ચાર સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ટપકાં અને ચોકડી દ્વારા દર્શાવેલું છે.
પ્રશ્ન 10. ઑક્સિજનના અણુ(O2)માં સહસંયોજક બંધની રચના સમજાવો.
ઉત્તર : ઑક્સિજનનો પરમાણ્વીય ક્રમાંક 8 છે. તેથી તેની ઇલેક્ટ્રૉન-રચના

26 છે.
→ આમ, ઑક્સિજન તેની L કક્ષામાં 6 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ L કક્ષાને સંપૂર્ણ ભરવા માટે વધુ બે ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી ઑક્સિજનના બે પરમાણુઓ તેમના L કક્ષાના બે-બે ઇલેક્ટ્રૉનની ભાગીદારી કરી, ઑક્સિજન અણુ(O2)નું નિર્માણ કરે છે. જેને બે પરમાણુઓ વચ્ચે દ્વિબંધની રચના થઈ એમ કહેવાય છે.
→ પરિણામે, ઑક્સિજનનો પ્રત્યેક પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ નિયોન (Ne) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના L કક્ષામાં આઠ ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ ચાર સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ચોકડી દ્વારા દર્શાવેલું છે.
પ્રશ્ન 11. નાઇટ્રોજનના અણુ(N,)માં સહસંયોજક બંધની રચના સમજાવો.
ઉત્તર : નાઇટ્રોજનનો ૫૨માણ્વીય ક્રમાંક 7 છે. તેથી તેની ઇલેક્ટ્રૉન-રચના

છે.
→ આમ, નાઇટ્રોજન તેની L કક્ષામાં 5 ઇલેક્ટ્રૉન ધરાવે છે.
→ આ L કક્ષાને સંપૂર્ણ ભરવા માટે વધુ ત્રણ ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ તેથી નાઇટ્રોજનના બે પરમાણુઓ તેમના L કક્ષાના ત્રણ-ત્રણ ઇલેક્ટ્રૉનની ભાગીદારી કરી, નાઇટ્રોજન અણુ(N2)નું નિર્માણ કરે છે. જેને બે પરમાણુઓ વચ્ચે ત્રિબંધની રચના થઈ એમ કહેવાય છે.
→ પરિણામે, નાઇટ્રોજનનો પ્રત્યેક પરમાણુ તેની નજીકના નિષ્ક્રિય વાયુ નિયોન (Ne) જેવી ઇલેક્ટ્રૉન-રચના પ્રાપ્ત કરે છે, જે તેના L કક્ષામાં આઠ ઇલેક્ટ્રૉન ધરાવે છે.
→ અહીં, આ છ સંયોજકતા ઇલેક્ટ્રૉનનું નિરૂપણ ચોકડી દ્વારા દર્શાવેલું છે.
પ્રશ્ન 12. અપરરૂપ અથવા બહુરૂપ એટલે શું?
ઉત્તર : એક જ તત્ત્વનાં કે તેથી વધુ સ્વરૂપો કે જેમના ભૌતિક ગુણધર્મો અસમાન, પરંતુ રાસાયણિક ગુણધર્મો સમાન હોય, તેવાં સ્વરૂપોને તે તત્ત્વના અપરરૂપ અથવા બહુરૂપ કહે છે.
પ્રશ્ન 13. ટૂંક નોંધ લખો ઃ કાર્બનનાં અપરરૂપો
ઉત્તર : કુદરતમાં કાર્બન તત્ત્વ અનેક વિવિધ ભૌતિક ગુણધર્મો સાથે જુદાં જુદાં સ્વરૂપમાં પ્રાપ્ત થાય છે. પરંતુ આ બધાં સ્વરૂપોના રાસાયણિક ગુણધર્મો સમાન છે. આમ, કાર્બન અપરરૂપો ધરાવે છે.
→ કાર્બન ત્રણ અપરરૂપો ધરાવે છે : (1) હીરો, (2) ગ્રેફાઇટ અને (૩) લેરિન.
→ આ ત્રણેય અપરરૂપો શુદ્ધ કાર્બન ધરાવે છે. તેમનું દહન કરતાં CO2 વાયુ ઉદ્ભવે છે, જે રંગહીન અને ગંધહીન વાયુ છે તથા ચૂનાના નીતર્યા પાણીને દૂધિયું બનાવે છે. આમ, ત્રણેય અપરરૂપોના રાસાયણિક ગુણધર્મો સમાન છે.
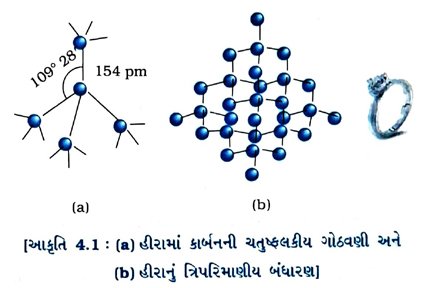
(1) હીરો :
(a) બંધારણ : હીરામાં કાર્બનનો પ્રત્યેક પરમાણુ કાર્બનના અન્ય ચાર પરમાણુઓ સાથે બંધ બનાવીને સખત ત્રિપરિમાણીય ચતુલૢકીય રચના બનાવે છે.
(b) હીરાના ભૌતિક ગુણધર્મો હીરો કાર્બનની ચતુલકીય ગોઠવણી ધરાવતો હોવાથી તે સૌથી સખત પદાર્થ છે.
→ હીરામાં કાર્બનની ગીચ ગોઠવણીના કારણે તેની ઘનતા વધુ છે. (ઘનતા = 3.51 g cm-3)
→ હીરામાં અસંખ્ય સહસંયોજક બંધ હોવાથી તેનું ગલનબિંદુ ખૂબ જ ઊંચું છે. (ગલનબિંદુ : 4203 K)
→ હીરામાં કાર્બન પરમાણુ પાસે એક પણ મુક્ત ઇલેક્ટ્રૉન ના હોવાથી તે વિદ્યુત અવાહક છે.
→ હીરાનો વક્રીભવનાંક (રિફ્રેક્ટિવ ઇન્ડેક્ષ) વધુ (2.5) હોવાથી તે પારદર્શિતા ધરાવે છે.
→ શુદ્ધ કાર્બનને અત્યંત ઊંચા દબાણે અને તાપમાને લઈ જવાથી હીરાનું સંશ્લેષણ કરી શકાય છે. આ સાંશ્લેષિત હીરા એ કુદરતી હીરા કરતાં પ્રમાણમાં નાના હોય છે, પરંતુ સરળતાથી અલગ કરી શકાતા નથી.
(2) ગ્રેફાઇટ :
(a) બંધારણ : ગ્રેફાઇટમાં કાર્બનનો પ્રત્યેક પરમાણુ કાર્બનના અન્ય ત્રણ પરમાણુ સાથે સમાન સ્તરમાં બંધ બનાવીને ષટ્કોણીય માળખું આપે છે. આ બંધો પૈકી એક દ્વિબંધ હોય છે. તેથી કાર્બનની સંયોજકતા સંતોષાય છે.
→ એક સ્તર પર બીજું સ્તર એમ અનેક સ્તરોથી બનતા ષટ્કોણીય માળખા દ્વારા ગ્રેફાઇટનું બંધારણ રચાય છે.
(b) ગ્રેફાઇટના ભૌતિક ગુણધર્મો : ગ્રેફાઇટ લીસો અને ચીકણો હોય છે.
→ ગ્રેફાઇટની ઘનતા હીરા કરતાં ઓછી હોય છે.
(ઘનતા = 2.22 g cm-3)
→ ગ્રેફાઇટમાં કાર્બનના ચાર સંયોજકતા ઇલેક્ટ્રૉન પૈકી એક ઇલેક્ટ્રૉન મુક્ત હોવાથી તે વિદ્યુત અને ઉષ્માનો સુવાહક છે.
(3) ફુલેરિન : લેરિન્સ કાર્બનનાં અપરરૂપોનો અન્ય વર્ગ રચે છે.
→ સૌપ્રથમ ઓળખાયેલ C-60 ફૂટબૉલના આકારની કાર્બન પરમાણુઓની ગોઠવણી ધરાવે છે.
→ તે અમેરિકન આર્કિટેક્ચર બકમિન્સ્ટર ફુલર દ્વારા ડિઝાઇન કરેલ જિયોડેસિક ગુંબજ જેવો દેખાય છે. તેથી આ અણુનું નામ લેરિન રાખવામાં આવ્યું.
Intext પ્રશ્નોત્તર
પ્રશ્ન 14. CO2 સૂત્ર ધરાવતા કાર્બન ડાયૉક્સાઇડનું ઇલેક્ટ્રૉન- બિંદુ નિરૂપણ શું થશે?
ઉત્તર : કાર્બન અને ઑક્સિજનની ઇલેક્ટ્રૉન-રચના નીચે મુજબ છે :
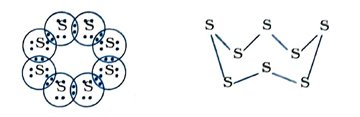
પ્રશ્ન 15. સલ્ફરના આઠ પરમાણુઓથી બનેલ સલ્ફર અણુનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ શું થશે? (સૂચન: સલ્ફરના આઠ પરમાણુઓ એકબીજા સાથે જોડાઈને ચક્ર બનાવે છે.)
ઉત્તર : 16S ની ઇલેક્ટ્રૉન-રચના નીચે મુજબ છે :
→ S8 અણુનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ નીચે મુજબ છે :
4.2 કાર્બનનો સર્વતોમુખી (દક્ષ) સ્વભાવ
પ્રશ્ન 16. કાર્બનના કયા બે ગુણધર્મો વધુ સંખ્યામાં કાર્બન સંયોજનો બનાવવાની ક્ષમતા ધરાવે છે? સમજાવો.
ઉત્તર : કાર્બન પરમાણુ અન્ય ૫૨માણુઓ સાથે ઇલેક્ટ્રૉનની ભાગીદારી દ્વારા સહસંયોજક બંધનું નિર્માણ કરી, અનેક સંયોજનો બનાવે છે; જે સંખ્યા આશરે ત્રણ મિલિયન જેટલી અંદાજવામાં આવી છે.
→ કાર્બન વધુ સંખ્યામાં સંયોજનો બનાવવાની ક્ષમતા ધરાવે છે, જે નીચેનાં પરિબળો પર આધાર રાખે છે :
(1) કાર્બનનો કેટેનેશન ગુણ : કાર્બન પરમાણુ અન્ય કાર્બન પરમાણુઓ સાથે બંધ બનાવવાની અદ્વિતીય ક્ષમતા ધરાવતો હોવાથી ખૂબ જ વધુ સંખ્યામાં અણુઓ (સંયોજનો) બને છે. કાર્બનના આ ગુણધર્મને કેટેનેશન કહે છે.
→ આ સંયોજનો કાર્બનની લાંબી શૃંખલા, કાર્બનની શાખિત શૃંખલા અથવા વલયોમાં ગોઠવાયેલા કાર્બન પરમાણુઓ ધરાવે છે.
→ કાર્બન પરમાણુ એકલબંધ અથવા દ્વિબંધ અથવા ત્રિબંધ દ્વારા પણ અન્ય પરમાણુઓ સાથે જોડાઈ શકે છે.
→ જે કાર્બનિક સંયોજનોમાં કાર્બન પરમાણુઓ માત્ર એકલબંધથી જોડાયેલા હોય તેવાં કાર્બનનાં સંયોજનોને સંતૃપ્ત સંયોજનો (Saturated Compounds) કહે છે.
→ જે કાર્બનિક સંયોજનોમાં બે કે તેથી વધુ કાર્બન પરમાણુઓ દ્વિબંધ કે ત્રિબંધથી જોડાયેલા હોય તેવાં કાર્બનનાં સંયોજનોને અસંતૃપ્ત સંયોજનો (Unsaturated Compounds) કહે છે.
→ કાર્બન સંયોજનોમાં જે હદે કેટેનેશનનો ગુણધર્મ જોવા મળે છે, તે કોઈ બીજા તત્ત્વમાં જોવા મળતો નથી. સિલિકોન હાઇડ્રોજન સાથે જે સંયોજનો બનાવે છે, તેમાં સાત અથવા આઠ પરમાણુઓ સુધીની જ શૃંખલા હોય છે. પરંતુ આ સંયોજનો અતિ ક્રિયાશીલ હોય છે.
→ કાર્બન-કાર્બન બંધ ખૂબ જ પ્રબળ હોવાથી કાર્બન પરમાણુઓના એકબીજા સાથે જોડાણથી મોટી સંખ્યામાં સ્થાયી સંયોજનો બને છે.
(2) કાર્બનની સંયોજકતા ઃ કાર્બનની સંયોજકતા ચાર છે. તેથી તે કાર્બનના અન્ય ચાર પરમાણુઓ અથવા કેટલાક અન્ય એક-સંયોજક તત્ત્વોના પરમાણુઓ સાથે બંધ બનાવવાની ક્ષમતા ધરાવે છે.
→ કાર્બન એ ઑક્સિજન, હાઇડ્રોજન, નાઇટ્રોજન, સલ્ફર, ક્લોરિન તથા અનેક અન્ય તત્ત્વો સાથે વિશિષ્ટ ગુણધર્મોવાળાં સંયોજનો બનાવે છે. આ વિશિષ્ટ ગુણધર્મો સંયોજનમાં હાજર રહેલા કાર્બન સિવાયના તત્ત્વ પર પણ આધાર રાખે છે.
→ કાર્બન પરમાણુ મોટા ભાગનાં અન્ય તત્ત્વો સાથે ખૂબ જ પ્રબળ બંધ બનાવે છે, જે સંયોજનોને અપવાદ રૂપે સ્થાયી બનાવે છે.
→ કાર્બનનું કદ નાનું હોવાથી પરમાણુ કેન્દ્ર દ્વારા ભાગીદારી પામેલા ઇલેક્ટ્રૉન-યુગ્મોને મજબૂતાઈથી જકડી રાખે છે. આથી કાર્બન દ્વારા પ્રબળ બંધોનું નિર્માણ થાય છે. મોટા પરમાણુઓ ધરાવતાં તત્ત્વો દ્વારા બનતા બંધ અત્યંત નિર્બળ હોય છે.
પ્રશ્ન 17. વોહલરે કઈ માન્યતાનું ખંડન કર્યું? ઉદાહરણ આપો.
ઉત્તર : કાર્બન પરમાણુ બે વિશિષ્ટ લક્ષણો – ચતુઃસંયોજકતા અને કેટેનેશનના કારણે મોટી સંખ્યામાં સંયોજનોનું નિર્માણ કરે છે.
→ આ પૈકીનાં કેટલાંક સંયોજનો વિભિન્ન કાર્બનની શૃંખલાઓ સાથે જોડાયેલ અકાર્બનિક પ૨માણુ અથવા પરમાણુઓના સમૂહ ધરાવે છે.
→ આ સંયોજનોનું નિષ્કર્ષણ શરૂઆતમાં કુદરતી પદાર્થોમાંથી કરવામાં આવ્યું હતું.
→ પ્રાચીન સમયમાં એમ માનવામાં આવતું હતું કે, સજીવમાં રહેલું કંઈક મહત્ત્વપૂર્ણ બળ કાર્બનિક પદાર્થોની બનાવટ માટે જરૂરી હોય છે.
→ આ માન્યતાનું ઈ. સ. 1828માં જર્મન વૈજ્ઞાનિક ફ્રેડરીચ વોહલ ખંડન કર્યું હતું.
ઉદાહરણ : તેમણે અકાર્બનિક પદાર્થ એમોનિયમ સાયનેટમાંથી કાર્બનિક પદાર્થ યૂરિયા બનાવ્યો હતો.
4.2.1 સંતૃપ્ત અને અસંતૃપ્ત કાર્બન સંયોજનો
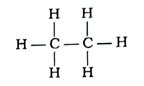
પ્રશ્ન 18. કોઈ પણ હાઇડ્રોકાર્બન સંયોજનનું બંધારણીય સૂત્ર કેવી રીતે નક્કી કરવામાં આવે છે? ઉદાહરણ આપી સમજાવો.
ઉત્તર : સરળ કાર્બન સંયોજનોનું બંધારણ બે તબક્કામાં નક્કી કરવામાં આવે છે :
તબક્કો 1 : પ્રથમ તબક્કામાં કાર્બન પરમાણુઓને એકબીજા સાથે એકલબંધથી જોડવામાં આવે છે.
દા. ત., C — C
આમ, આ તબક્કામાં કાર્બનની એક સંયોજકતા કાર્બન પરમાણુ વડે જ સંતોષાય છે.
તબક્કો 2 : બીજા તબક્કામાં કાર્બનની બાકી રહેલી સંયોજકતાઓ હાઇડ્રોજન પરમાણુ દ્વારા સંતોષવામાં આવે છે.
→ દરેક કાર્બન પરમાણુની ત્રણ સંયોજકતા સંતોષાયા વગરની બાકી રહે છે. તેથી તે દરેક ત્રણ હાઇડ્રોજન પરમાણુ સાથે બંધ બનાવીને નીચે પ્રમાણે સંરચના આપે છે :
→ દરેક કાર્બન પરમાણુ ત્રણ હાઇડ્રોજન પરમાણુઓ સાથે જોડાયેલો છે.
પ્રશ્ન 19. ઇથેનનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ જણાવો.
ઉત્તર : કાર્બનની ઇલેક્ટ્રૉન-રચના નીચે મુજબ છે :
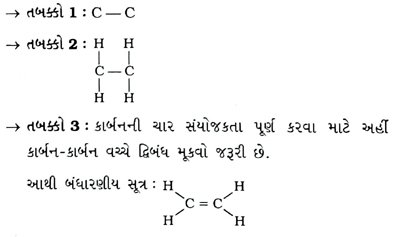
પ્રશ્ન 20. ઇથીનનું બંધારણીય સૂત્ર દોરો.
ઉત્તર : ઇથીનનું આણ્વીય સૂત્ર C2H4 છે.
પ્રશ્ન 21. ઇથીનની ઇલેક્ટ્રૉન-બિંદુ રચના દોરો.
ઉત્તર : ઇથીનનું આણ્વીય સૂત્ર C2H4 છે.
→ ઇથીનનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ નીચે મુજબ છે :
પ્રશ્ન 22. ઇથાઇનની ઇલેક્ટ્રૉન-બિંદુ રચના દોરો.
ઉત્તર : ઇથાઇન(એસિટિલીન)નું આણ્વીય સૂત્ર C2H2 છે.
→ ઇથાઇનનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ નીચે મુજબ છે :
પ્રશ્ન 23. સંતૃપ્ત અને અસંતૃપ્ત કાર્બન સંયોજનો એટલે શું?
ઉત્તર : સંતૃપ્ત કાર્બન સંયોજનો : જે કાર્બનિક સંયોજનોમાં કાર્બન પરમાણુઓ માત્ર એકલબંધથી જોડાયેલા હોય તેવાં સંયોજનોને સંતૃપ્ત કાર્બન સંયોજનો કહે છે.
અસંતૃપ્ત કાર્બન સંયોજનો : જે કાર્બનિક સંયોજનોમાં બે કે તેથી વધુ કાર્બન પરમાણુઓ દ્વિબંધ કે ત્રિબંધથી જોડાયેલા હોય તેવાં સંયોજનોને અસંતૃપ્ત કાર્બન સંયોજનો કહે છે.
→ અસંતૃપ્ત સંયોજનો સંતૃપ્ત સંયોજનો કરતાં વધુ ક્રિયાશીલ હોય છે.
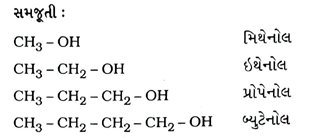
પ્રશ્ન 24. કાર્બનના પ્રથમ છ સંતૃપ્ત સંયોજનોનાં નામ, સૂત્રો અને બંધારણ જણાવો.
ઉત્તર : કાર્બનના પ્રથમ છ સંતૃપ્ત સંયોજનોનાં નામ, સૂત્રો અને બંધારણ નીચે મુજબ છેઃ :
4.2.2 શૃંખલાઓ, શાખાઓ અને વલયો
પ્રશ્ન 25. હાઇડ્રોકાર્બન સંયોજનો એટલે શું? તેનું વર્ગીકરણ સમજાવો.
ઉત્તર : જે કાર્બન સંયોજનો માત્ર કાર્બન અને હાઇડ્રોજન ધરાવે છે, તેમને હાઇડ્રોકાર્બન સંયોજનો કહે છે.
હાઇડ્રોકાર્બન સંયોજનોનું વર્ગીકરણ નીચે મુજબ છે :
આલ્બેન સંયોજનો : જે હાઇડ્રોકાર્બન સંયોજનોમાં કાર્બન-કાર્બન પરમાણુ વચ્ચે માત્ર એક્લબંધ હોય તેવાં સંયોજનોને આલ્બેન સંયોજનો કહે છે. દા. ત., બ્યુટેન, પેન્ટેન, હેક્ઝેન વગેરે.
આલ્કીન સંયોજનો : જે હાઇડ્રોકાર્બન સંયોજનોમાં કાર્બન-કાર્બન પરમાણુ વચ્ચે એક અથવા વધુ દ્વિબંધ હોય તેવાં સંયોજનોને આલ્કીન સંયોજનો કહે છે. દા. ત., બ્યુટીન, પેન્ટીન, હેક્ઝીન વગેરે.
આલ્કાઇન સંયોજનો : જે હાઇડ્રોકાર્બન સંયોજનોમાં કાર્બન-કાર્બન પરમાણુ વચ્ચે એક અથવા વધુ ત્રિબંધ હોય તેવાં સંયોજનોને આલ્ફાઇન સંયોજનો કહે છે. દા. ત., બ્યુટાઇન, પેન્ટાઇન, હેક્ઝાઇન વગેરે.
પ્રશ્ન 26. હાઇડ્રોકાર્બન સંયોજનોનું બંધારણના આધારે વર્ગીકરણ સમજાવો.
ઉત્તર : હાઇડ્રોકાર્બન સંયોજનોનું કાર્બન પરમાણુની ગોઠવણીના આધારે (બંધારણના આધારે) ત્રણ પ્રકારમાં નીચે મુજબ વર્ગીકરણ કરી શકાય છે :
(a) સરળ શૃંખલાવાળાં સંયોજનો : જે હાઇડ્રોકાર્બન સંયોજનોમાં બધા જ કાર્બન પરમાણુઓ એક સીધી હરોળમાં ગોઠવાયેલા હોય, તો તેવાં સંયોજનોને સરળ શૃંખલાવાળાં સંયોજનો કહે છે.
નોંધ : આ સંયોજનોના નિરૂપણ માટે તેમનાં નામની આગળ પૂર્વગ તરીકે n લગાવવામાં આવે છે. દા. ત., n-પેન્ટેન, n-હેક્ઝેન વગેરે. (જ્યાં, n = normal)
વધુ ઉદાહરણ માટે જુઓ પ્રશ્ન 24.
(b) શાખીય શૃંખલાવાળાં સંયોજનો ઃ જે હાઇડ્રોકાર્બન સંયોજનોમાં કાર્બન પરમાણુઓ સીધી હરોળ ઉપરાંત એક કે તેથી વધુ જગ્યાએ શાખા ધરાવતા હોય, તો તેવાં સંયોજનોને શાખીય શૃંખલાવાળાં સંયોજનો કહે છે.
દા. ત., ( 1 ) બ્યુટેનમાં ચાર કાર્બન પરમાણુઓથી કાર્બન માળખું બનાવીએ, તો બે શક્યતાઓ રહેલી છેઃ
→ અહીં, બાકી રહેલ સંયોજકતાઓ હાઇડ્રોજન વડે ભરપાઈ કરતા (સંતોષતા) નીચે પ્રમાણેનાં સૂત્ર મળે છેઃ
નોંધ : આ સંયોજનોના નિરૂપણ માટે તેમનાં નામની આગળ પૂર્વગ તરીકે iso લગાવવામાં આવે છે. દા. ત., iso-બ્યુટેન.
(2) હેક્ઝેનમાં છ કાર્બન પરમાણુઓથી કાર્બન માળખું બનાવીએ, તો પાંચ શક્યતાઓ રહેલી છે :
→ અહીં, બાકી રહેલ સંયોજકતાઓ હાઇડ્રોજન વડે ભરપાઈ કરતા (સંતોષતા) નીચે પ્રમાણેનાં સૂત્ર મળે છે :
(c) વલય (ચક્રીય) રચનાવાળાં સંયોજનો : જે હાઇડ્રોકાર્બન સંયોજનોમાં પ્રથમ કાર્બન પરમાણુ અંતિમ કાર્બન પરમાણુ સાથે સીધો જ જોડાયેલો હોય અર્થાત્ વલય રચના ધરાવતો હોય, તો તેવાં સંયોજનોને વલય (ચક્રીય) રચનાવાળાં સંયોજનો કહે છે.
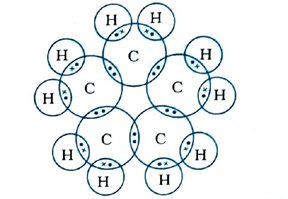
પ્રશ્ન 27. સાયક્લોહેક્ઝેન(C6H12)નું ઇલેક્ટ્રૉન-બિંદુ બંધારણ દોરો.
ઉત્તર : સાયક્લોહેક્ઝેનનું ઇલેક્ટ્રૉન-બિંદુ બંધારણ નીચે મુજબ છે :
પ્રશ્ન 28. બેન્ઝિનનું ઇલેક્ટ્રૉન-બિંદુ બંધારણ દોરો.
ઉત્તર : બેન્ઝિન(C6H6)નું ઇલેક્ટ્રૉન-બિંદુ બંધારણ નીચે મુજબ છે :
4.2.3 તમે મારા મિત્ર બનશો?
પ્રશ્ન 29. વિષમ પરમાણુ એટલે શું? ઉદાહરણ આપો.
ઉત્તર : હાઇડ્રોકાર્બન શૃંખલામાં એક અથવા વધુ હાઇડ્રોજનનું વિસ્થાપન કરતા તત્ત્વને વિષમ ૫૨માણુ કહે છે.
→ વિષમ પરમાણુ દ્વારા હાઇડ્રોજનનું વિસ્થાપન થવા છતાં શૃંખલામાં કાર્બનની સંયોજકતા સંતોષાયેલી જ રહે છે.
→ દા. ત., ( 1 ) ક્લોરિન, બ્રોમિન હેલોજન તત્ત્વો
( 2 ) ઑક્સિજન, નાઇટ્રોજન અને સલ્ફર તત્ત્વો
પ્રશ્ન 30. ક્રિયાશીલ સમૂહો એટલે શું? ઉદાહરણ આપો.
ઉત્તર : વિષય પરમાણુ અને તેમને સમાવતા સમૂહો કે જે સંયોજનોને વિશિષ્ટ ગુણધર્મો આપે છે, જે કાર્બન-શૃંખલાની લંબાઈ અને સ્વભાવ ૫૨ આધારિત નથી. તેમને ક્રિયાશીલ સમૂહો કહે છે.
અથવા
કાર્બનિક સંયોજનોની લાક્ષણિક પ્રક્રિયાઓ જે પરમાણુ કે પરમાણુઓના સમૂહ દ્વારા નક્કી થાય છે, તે પરમાણુ અથવા પરમાણુઓના સમૂહને ક્રિયાશીલ સમૂહ કહે છે.
→ એક જ ક્રિયાશીલ સમૂહ ધરાવતાં જુદાં જુદાં કાર્બનિક સંયોજનની રાસાયણિક પ્રક્રિયાઓ સમાન હોય છે.
→ જુદા જુદા ક્રિયાશીલ સમૂહ ધરાવતાં કાર્બનિક સંયોજનોની રાસાયણિક પ્રક્રિયાઓ અને ગુણધર્મો જુદા જુદા હોય છે.
→ સમૂહની મુક્ત સંયોજકતા અથવા સંયોજકતાઓ એલરેખા ( – ) દ્વારા દર્શાવાય છે.
→ક્રિયાશીલ સમૂહ આ સંયોજક્તા વડે એક અથવા વધુ હાઇડ્રોજન પરમાણુઓનું વિસ્થાપન કરીને કાર્બન-શૃંખલા સાથે જોડાયેલા રહે છે.
ઉદાહરણ :
4.2.4 સમાનધર્મી શ્રેણી
પ્રશ્ન 31. સમાનધર્મી શ્રેણી એટલે શું? તેની લાક્ષણિકતાઓ જણાવો.
ઉત્તર : કાર્બનિક સંયોજનોની એવી શ્રેણી કે જેમાં કાર્બન-શૃંખલામાં રહેલ હાઇડ્રોજનને સમાન પ્રકારના ક્રિયાશીલ સમૂહ દ્વારા વિસ્થાપિત કરવામાં આવેલ હોય, તેને સમાનધર્મી શ્રેણી કહે છે.
અથવા
સમાન ક્રિયાશીલ સમૂહ ધરાવતાં જે કાર્બનિક સંયોજનોની શ્રેણીનો દરેક સભ્ય તેની પહેલાંના કે પછીના ક્રમિક સભ્યથી કાર્બન અને હાઇડ્રોજન ૫૨માણુઓની ચોક્કસ સંખ્યા(–CH2)માં તફાવત ધરાવતો હોય, તો તે કાર્બનિક સંયોજનોની શ્રેણીને સમાનધર્મી શ્રેણી કહે છે.
સમાનધર્મી શ્રેણીની લાક્ષણિકતાઓ નીચે મુજબ છે :
(1) સમાનધર્મી શ્રેણીના દરેક સંયોજનમાં રહેલાં તત્ત્વો અને ક્રિયાશીલ સમૂહ સમાન હોય છે.
(2) શ્રેણીના દરેક સભ્યને સામાન્ય આણ્વીય સૂત્રોથી દર્શાવી શકાય છે. જેમ કે, આલ્કેન શ્રેણીના દરેક સભ્યને સૂત્ર CnH2n+2 વડે દર્શાવી શકાય છે.
(3) શ્રેણીના કોઈ પણ બે ક્રમિક સભ્યોનાં આણ્વીય સૂત્રો વચ્ચે CH2 જેટલો તફાવત હોય છે.
(4) શ્રેણીના કોઈ પણ બે ક્રમિક સભ્યોનાં આણ્વીય દળમાં 14 u જેટલો તફાવત હોય છે.
(5) શ્રેણીના દરેક સભ્યના નામકરણમાં સમાન પૂર્વગ અથવા પ્રત્યય લાગે છે.
(6) શ્રેણીના દરેક સભ્યમાં જો સમાન ક્રિયાશીલ સમૂહ હોય, તો તે શ્રેણીના દરેક સભ્યની રાસાયણિક પ્રક્રિયાઓ સમાન હોય છે.
(7) કોઈ પણ સમાનધર્મી શ્રેણીમાં જેમ આણ્વીય દળ વધે તેમ ભૌતિક ગુણધર્મોમાં ક્રમબદ્ધતા જોવા મળે છે. કારણ કે આણ્વીય દળ વધવાથી ગલનબિંદુ અને ઉત્કલનબિંદુ વધે છે. અન્ય ભૌતિક ગુણધર્મો જેમ કે ચોક્કસ દ્રાવકમાં દ્રાવ્યતા પણ સમાન ક્રમબદ્ધતા દર્શાવે છે, પરંતુ રાસાયણિક ગુણધર્મોમાં એકસમાન જળવાઈ રહે છે.
4.2.5 કાર્બન સંયોજનોનું નામકરણ
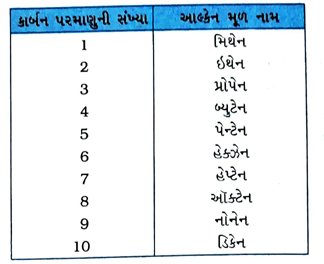
પ્રશ્ન 32. કાર્બન સંયોજનોનું નામકરણ કરવાની પદ્ધતિ ટૂંકમાં સમજાવો.
ઉત્તર : કાર્બન સંયોજનોનું નામકરણ નીચે દર્શાવેલ પદ્ધતિ દ્વારા કરી શકાય છે :
(1) આપેલા સંયોજનમાં કાર્બન પરમાણુની સંખ્યા નક્કી કરી, સંયોજનનું આલ્કેન મૂળ નામ નક્કી કરવામાં આવે છે.
(2) નીચેના કોષ્ટકમાં દર્શાવ્યા પ્રમાણે ક્રિયાશીલ સમૂહની હાજરીના કિસ્સામાં તેને પૂર્વગ અથવા પ્રત્યય સહિત સંયોજનનાં નામમાં દર્શાવાય છે.

(3) જો ક્રિયાશીલ સમૂહનું નામ પ્રત્યયના આધારે આપવામાં આવે અને ક્રિયાશીલ સમૂહનો પ્રત્યય a, e, i, o, u જેવા સ્વરથી શરૂ થતો હોય, તો કાર્બન-શૃંખલાના છેડે ‘e’ દૂર કરીને તેમાં યોગ્ય પ્રત્યય લગાવીને નામ આપવામાં આવે છે. ઉદાહરણ તરીકે, કીટોન સમૂહ ધરાવતી ત્રણ કાર્બનની શૃંખલાને નીચેની રીતે નામ આપવામાં આવે છે :
Propane – ‘e’ = Propan + ‘-one’ = Propanone (પ્રોપેનોન)
(4) જો કાર્બન-શૃંખલા અસંતૃપ્ત હોય, તો કાર્બન-શૃંખલાના નામમાં રહેલ અંતિમ ‘-એન’ (-ane’)ને કોષ્ટકમાં દર્શાવ્યા પ્રમાણે ‘-ઇન’ (‘-ene’) અથવા ‘-આઇન’ (‘-yne’) દ્વારા વિસ્થાપિત કરવામાં આવે છે. ઉદાહરણ તરીકે દ્વિબંધ ધરાવતી ત્રણ કાર્બનની શૃંખલા પ્રોપીન (Propene) કહેવાય છે અને જો તે ત્રિબંધ ધરાવે, તો તેને પ્રોપાઇન (Propyne) કહેવાય છે.
(5) ક્રિયાશીલ સમૂહનું સ્થાન દર્શાવવા માટે દીર્ઘતમ શૃંખલામાં ડાબી અથવા જમણી બાજુથી એ પ્રમાણે નંબર આપવા કે જેથી સમૂહ ધરાવતા કાર્બનને લઘુતમ ક્રમ મળે.
પ્રશ્ન 33. નીચેનાં સંયોજનોનું નામ આપો :
ઉત્તર :
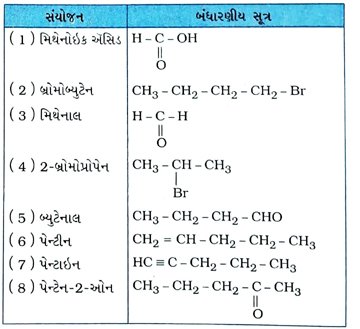
પ્રશ્ન 34. નીચે દર્શાવેલાં સંયોજનોનાં બંધારણ દોરો :
(1) મિથેનોઇક ઍસિડ
(2) બ્રોમોબ્યુટેન
(3) મિથેનાલ
(4) 2-બ્રોમોપ્રોપેન
(5) બ્યુટેનાલ
(6) પેન્ટીન
(7) પેન્ટાઇન
(8) પેન્ટેન-2-ઓન
ઉત્તર :
પ્રશ્ન 35. બંધારણીય સમઘટકો એટલે શું? ઉદાહરણ આપો.
ઉત્તર : જે સંયોજનોનાં આણ્વીય સૂત્રો સમાન હોય, પરંતુ બંધારણીય સૂત્રો ભિન્ન હોય તેવાં સંયોજનોને બંધારણીય સમઘટકો કહે છે.
ઉદાહરણ :
Intext પ્રશ્નોત્તર
પ્રશ્ન 36. પેન્ટેન માટે તમે કેટલા બંધારણીય સમઘટકો દોરી શકો?
ઉત્તર : જુઓ પ્રશ્ન 35નું ઉદાહરણ (2).
પ્રશ્ન 37. કાર્બનના બે ગુણધર્મો કયા છે, જેના કારણે આપણી ચારેય તરફ કાર્બન સંયોજનોની વિશાળ સંખ્યા આપણે જોઈએ છીએ?
ઉત્તર : જુઓ પ્રશ્ન 16નો ઉત્તર.
પ્રશ્ન 38. સાયક્લોપેન્ટેનનું સૂત્ર અને ઇલેક્ટ્રૉન-બિંદુ રચના શું થશે?
ઉત્તર : સાયક્લોઆલ્બેનનું સામાન્ય સૂત્ર CnH2n છે. આથી સાયક્લોપેન્ટેનનું આણ્વીય સૂત્ર C5H10 છે.
→ સાયક્લોપેન્ટેનનું ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ નીચે મુજબ છે :
પ્રશ્ન 39. નીચે દર્શાવેલ સંયોજનોનાં બંધારણ દોરો :
(i) ઇથેનોઇક ઍસિડ
(ii) બ્રોમોપેન્ટેન
(iii) બ્યુટેનોન
(iv) હેક્ઝેનાલ
શું બ્રોમોપેન્ટેનના બંધારણીય સમઘટક શક્ય છે?
ઉત્તર :
→ બ્રોમોપેન્ટેન(C5H11Br)ના શક્ય બંધારણીય સમઘટકો નીચે મુજબ છે :
પ્રશ્ન 40. નીચે દર્શાવેલ સંયોજનોનું નામ તમે કેવી રીતે આપશો?
ઉત્તર : ઉપ૨ોક્ત સંયોજનોનાં નામ નીચે મુજબ છે :
(i) બ્રોમોઇથેન
(ii) મિથેનાલ
(iii) હે- 1-આઇન અથવા હેક્ઝાઇન
4.3 કાર્બન સંયોજનોના રાસાયણિક ગુણધર્મો
પ્રશ્ન 41. કાર્બન સંયોજનોના મુખ્ય રાસાયણિક ગુણધર્મો- (પ્રક્રિયાઓ)નાં ફક્ત નામ જણાવો.
ઉત્તર : કાર્બન સંયોજનોનાં મુખ્ય રાસાયણિક ગુણધર્મો નીચે મુજબ છે :
(1) દહન, (2) ઑક્સિડેશન, (3) યોગશીલ પ્રક્રિયા અને (4) વિસ્થાપન પ્રક્રિયા,
4.8.1 દહન
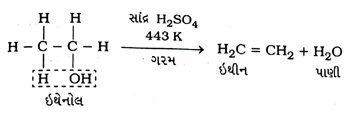
પ્રશ્ન 42. દહન એટલે શું? ઉદાહરણ આપી સમજાવો.
ઉત્તર : દહન એ એક એવી પ્રક્રિયા છે કે જેમાં પદાર્થને હવા અથવા ઑક્સિજનની હાજરીમાં ગરમ કરવામાં આવે છે.
→ આ પ્રક્રિયામાં કાર્બન તેનાં બધાં જ અપરરૂપોમાં, હવામાં દહન પામીને કાર્બન ડાયૉક્સાઇડ સાથે ઉષ્મા અને પ્રકાશ મુક્ત કરે છે.
→ મોટા ભાગનાં કાર્બન સંયોજનો પણ દહન દ્વારા વધુ માત્રામાં ઉષ્મા અને પ્રકાશ મુક્ત કરે છે.
→ આ એક પ્રકારની ઑક્સિડેશન પ્રક્રિયા પણ ગણી શકાય.
→ સામાન્ય રીતે સંતૃપ્ત હાઇડ્રોકાર્બન દહન દરમિયાન કાળા ધુમાડા રહિત જ્યોત આપે છે, જ્યારે અસંતૃપ્ત હાઇડ્રોકાર્બન ખૂબ જ કાળા ધુમાડા સાથે પીળી જ્યોત આપે છે.
પ્રશ્ન 43. કોલસા અને પેટ્રોલિયમનું નિર્માણ સમજાવો.
ઉત્તર : કોલસા અને પેટ્રોલિયમનું નિર્માણ જૈવભારથી થયું છે કે જુદી જુદી જૈવિક અને ભૂગર્ભીય પ્રક્રિયાઓને આધીન છે.
→ કોલસો એ વૃક્ષો અને ત્રિઅંગી વનસ્પતિઓ કે જે લાખો વર્ષ પહેલાં જીવિત હતી, તેના અવશેષ છે.
→ આ વૃક્ષો તેમજ ત્રિઅંગી વનસ્પતિઓ ભૂકંપ અથવા જ્વાળામુખી વિસ્ફોટને કારણે જમીનમાં દટાઈ ગઈ તથા ધીમે ધીમે ક્ષય પામી કોલસો બની ગઈ.
→ તેલ તથા વાયુ લાખો વર્ષો જુના સમુદ્રી છોડ તથા સજીવોના અવશેષ છે. તે મૃત થવાથી તેમના શરીર સમુદ્રના તળિયે જમા થયા અને દરિયાઈ કાદવથી ઢંકાઈ ગયા.
→ મૃત અવશેષો પર બૅક્ટેરિયાના આક્રમણથી, ઊંચા દબાણની અસર હેઠળ તેલ અથવા વાયુનું નિર્માણ થયું.
આ પ્રમાણે કોલસો અને પેટ્રોલિયમનું નિર્માણ થયું.
4.3.2 ઑક્સિડેશન
પ્રશ્ન 44. ઑક્સિડેશન અને ઑક્સિડેશનકર્તા એટલે શું?
ઉત્તર : ઑક્સિડેશન : પદાર્થમાં ઑક્સિજન ઉમેરાવાની ક્રિયાને ઑક્સિડેશન કહે છે.
ઑક્સિડેશનકર્તા : જે પદાર્થો અન્ય પદાર્થોમાં ઑક્સિજન ઉમેરવા માટે સક્ષમ હોય તેને ઑક્સિડેશનકર્તા કહે છે.
દા. ત., આલ્ક્લાઇન પોટૅશિયમ પરમેંગેનેટ (KMnO4), ઍસિડિક પોટેશિયમ ડાયક્રોમેટ (K2Cr2O7)
પ્રશ્ન 45. સમજાવો : આલ્કોહોલનું ઑક્સિડેશન
ઉત્તર : કાર્બન સંયોજનોનું દહન કરતાં તેમનું સરળતાથી ઑક્સિડેશન થઈ શકે છે, જે સામાન્ય રીતે પૂર્ણ ઑક્સિડેશન છે.
→ આલ્કોહોલનું ઑક્સિડેશન આહ્લાઇન પોટૅશિયમ પરમેંગેનેટ અથવા ઍસિડિક પોટેશિયમ ડાયક્રોમેટ વડે કરતાં તે કાર્બોક્સિલિક ઍસિડમાં રૂપાંતર પામે છે.
→ ઉદાહરણ :
4.3.3 યોગશીલ પ્રક્રિયા
પ્રશ્ન 46. ઉદ્દીપક એટલે શું? ઉદાહરણ આપો.
ઉત્તર : ઉદ્દીપક : એવો પદાર્થ કે જે પ્રક્રિયાને અસર પહોંચાડ્યા વગર જ પ્રક્રિયાને જુદા જુદા દરથી આગળ વધારે તેવા પદાર્થને ઉદ્દીપક કહે છે.
ઉદાહરણ : નિકલ, પેલેડિયમ અને લોખંડ.
પ્રશ્ન 47. યોગશીલ પ્રક્રિયા એટલે શું? સમજાવો.
ઉત્તર : જે રાસાયણિક પ્રક્રિયા દરમિયાન કાર્બનિક સંયોજનમાં બીજો અણુ ઉમેરાવાથી નવું કાર્બનિક સંયોજન બને, તો તે પ્રક્રિયાને યોગશીલ પ્રક્રિયા કહે છે.
→ અસંતૃપ્ત હાઇડ્રોકાર્બનમાં પેલેડિયમ અથવા નિકલ જેવા ઉદ્દીપકની હાજરીમાં હાઇડ્રોજન ઉમેરાઈને સંતૃપ્ત હાઇડ્રોકાર્બન બને છે.
→ આ પ્રક્રિયાનો ઉપયોગ સામાન્ય રીતે વનસ્પતિ તેલના હાઇડ્રોજીનેશનમાં થાય છે.
→ વનસ્પતિ તેલ લાંબી અસંતૃપ્ત કાર્બન-શૃંખલા ધરાવે છે, જ્યારે પ્રાણીજ ચરબી સંતૃપ્ત કાર્બન-શૃંખલા ધરાવે છે. તેથી વનસ્પતિ તેલ સ્વાસ્થ્યવર્ધક હોય છે.
→ સામાન્ય રીતે પ્રાણીજ ચરબીમાં સંતૃપ્ત ફૅટી ઍસિડ હોય છે, જે સ્વાસ્થ્ય માટે નુકસાનકારક છે.
→ ખોરાક રાંધવા માટે અસંતૃપ્ત ફૅટી ઍસિડ ધરાવતા તેલ પસંદ કરવા જોઈએ.
4.3.4 વિસ્થાપન પ્રક્રિયા
પ્રશ્ન 48. વિસ્થાપન પ્રક્રિયા એટલે શું? સમજાવો.
ઉત્તર : કાર્બનિક સંયોજનના અણુમાં રહેલા પરમાણુ કે પરમાણુઓના સમૂહનું અન્ય ૫૨માણુ કે પરમાણુઓના સમૂહ વડે વિસ્થાપન થાય, તો તે પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છે.
→ સંતૃપ્ત હાઇડ્રોકાર્બન અત્યંત બિનપ્રતિક્રિયાત્મક હોય છે તેમજ મોટા ભાગના પ્રક્રિયકોની હાજરીમાં નિષ્ક્રિય હોય છે.
→ સૂર્યપ્રકાશની હાજરીમાં હાઇડ્રોકાર્બન સંયોજનોના ક્લોરિનેશનમાં ક્લોરિન પરમાણુ એક પછી એક હાઇડ્રોજન પરમાણુનું વિસ્થાપન કરી શૃંખલામાં દાખલ થાય છે. આ પ્રકારની પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છે.
→ આ પ્રક્રિયામાં ઊંચી સમાનધર્મી આલ્બેન સાથે અનેક નીપજોનું નિર્માણ થાય છે.
Intext પ્રશ્નોત્તર
પ્રશ્ન 49. ઇથેનોલનું ઇથેનોઇક ઍસિડમાં રૂપાંતર એ શા માટે ઑક્સિડેશન પ્રક્રિયા છે?
ઉત્તર : ઇથેનોલનું ઇથેનોઇક ઍસિડમાં રૂપાંતર નીચેના સમીકરણ દ્વારા દર્શાવી શકાય છે :
→ આ પ્રક્રિયામાં પ્રક્રિયક ઇથેનોલ એક ઑક્સિજન પરમાણુ ધરાવે છે. જ્યારે નીપજ ઇથેનોઇક ઍસિડ બે ઑક્સિજન ૫૨માણુ ધરાવે છે. આમ, આ પ્રક્રિયા દરમિયાન ઑક્સિજન પરમાણુ ઉમેરાય છે. આથી આ રૂપાંતર ઑક્સિડેશન પ્રક્રિયા છે.
પ્રશ્ન 50. ઑક્સિજન અને ઇથાઇનનું મિશ્રણ વેલ્ડિંગ માટે સળગાવવામાં આવે છે. શું તમે કહી શકો કે શા માટે ઇથાઇન અને હવાના મિશ્રણનો ઉપયોગ થતો નથી?
ઉત્તર : ઇથાઇન એ અસંતૃપ્ત હાઇડ્રોકાર્બન છે.
→ જ્યારે તેનું હવાના મિશ્રણ સાથે દહન કરવામાં આવે ત્યારે ખૂબ જ કાળા ધુમાડાવાળી પીળી જ્યોત આપે છે.
→ આ અપૂર્ણ દહન થવાથી ખૂબ જ ઓછી ઉષ્મા મુક્ત થાય છે, જે વેલ્ડિંગ માટે જરૂરી ઊર્જા કરતાં ઓછી છે. આથી ઇથાઇન અને હવાના મિશ્રણનો ઉપયોગ વેલ્ડિંગ માટે થતો નથી.
→ જ્યારે ઇથાઇનનું ઑક્સિજન સાથે દહન કરવામાં આવે ત્યારે સંપૂર્ણ દહન થવાથી ખૂબ જ વધુ ઉષ્મા મુક્ત થાય છે, જે વેલ્ડિંગ માટે જરૂરી ઉષ્મા જેટલી હોય છે. આથી ઇથાઇન અને ઑક્સિજનનું મિશ્રણ વેલ્ડિંગ માટે ઉપયોગી છે.
4.4 કેટલાંક મહત્ત્વપૂર્ણ કાર્બન સંયોજનો : ઇથેનોલ અને ઈથેનોઈક ઍસિડ
પ્રશ્ન 51. ઇથેનોલ અને ઇથેનોઇક ઍસિડના આણ્વીય તેમજ બંધારણીય સૂત્ર જણાવો.
ઉત્તર :
4.4.1 ઇથેનોલના ગુણધર્મો
પ્રશ્ન 52. ઇથેનોલના ભૌતિક ગુણધર્મો જણાવો.
ઉત્તર : ઇથેનોલના ભૌતિક ગુણધર્મો નીચે મુજબ છે : (1) શુદ્ધ ઇથેનોલ રંગવિહીન પ્રવાહી છે. (2) ઇથેનોલનું ગલનબિંદુ 156 K છે, જ્યારે ઉત્કલનબિંદુ 351 K છે. (3) તે પાણીમાં સુદ્રાવ્ય છે. (તમામ પ્રમાણમાં) (4) તે સારો દ્રાવક છે.
પ્રશ્ન 53. ઇથેનોલના ઉપયોગો લખો.
ઉત્તર : ઇથેનોલના ઉપયોગો નીચે મુજબ છે :
(1) ઔદ્યોગિક દ્રાવક તરીકે દવાઓ જેવી કે ટિક્ચર આયોડિન, કફ સિ૨૫ તેમજ અનેક ટૉનિક્સમાં; (2) લીકર, વાર્નિશ તથા અત્તર જેવાં સુગંધી દ્રવ્યોની બનાવટમાં; (3) ચેપનાશક તરીકે; (4) શુદ્ધ આલ્કોહોલ (નિરપેક્ષ આલ્કોહોલ) નશાયુક્ત પીણાંની બનાવટમાં; (5) રૅક્ટિફાઇડ સ્પિરિટ બનાવવા.
પ્રશ્ન 54. ઇથેનોલની રાસાયણિક પ્રક્રિયાઓ સમજાવો.
ઉત્તર : ઇથેનોલની રાસાયણિક પ્રક્રિયાઓ (ગુણધર્મો) નીચે મુજબ છે :
(1) આલ્કોહોલની સોડિયમ (Na) ધાતુ સાથેની પ્રક્રિયાઃ ઇથેનોલમાંના − OH સમૂહની Na ધાતુ સાથેની પ્રક્રિયાથી સોડિયમ ઇથૉક્સાઇડ અને H2 વાયુ ઉત્પન્ન થાય છે.
(2) અસંતૃપ્ત હાઇડ્રોકાર્બન આપતી પ્રક્રિયા (ઍસિડ સાથેની પ્રક્રિયા – નિર્જલીકરણ) : ઇથેનોલને વધુ પ્રમાણમાં સાંદ્ર H2SO4 સાથે 443 K તાપમાને ગરમ કરતાં ડિહાઇડ્રેશન (નિર્જલીકરણ) થઈ પાણીનો એક અણુ મુક્ત થઈ ઈથીન મળે છે.
અહીં, સાંદ્ર H2SO4 નિર્જલીકરણકર્તા તરીકે કાર્ય કરે છે.
પ્રશ્ન 55. આલ્કોહોલ જીવિત મનુષ્ય પર કેવી રીતે અસર કરે છે? સમજાવો.
અથવા
“આલ્કોહોલ પીણાં તરીકે નુકસાનકારક છે.” વિધાન સવિસ્તાર સમજાવો.
ઉત્તર : જ્યા૨ે વધુ માત્રામાં ઇથેનોલનું સેવન કરવામાં આવે ત્યારે તે ચયાપચયની ક્રિયાને ધીમી કરે છે.
→ ઉપરાંત, મધ્યસ્થ ચેતાતંત્રને નિર્બળ બનાવે છે. પરિણામે જીવિત મનુષ્યમાં તાલમેલની ઊણપ, માનસિક દુવિધા, આળસ, સામાન્ય નિરોધન ઘટાડે છે. અંતે વ્યક્તિ બેહોશ થઈ જાય છે.
→ ઇથેનોલના સેવન દરમિયાન વ્યક્તિ માનસિક તાણમાં રાહત અનુભવે છે, પરંતુ તેની વિચારવાની સૂઝ, સમય-નિયંત્રણ સૂઝ તથા સ્નાયુઓના તાલમેલમાં ગંભીર રીતે ઘટાડો થાય છે.
→ ઇથેનોલના બદલે મિથેનોલની થોડી પણ માત્રા સેવન કરવામાં આવે, તો મૃત્યુ પણ થઈ શકે છે; કારણ કે યકૃતમાં મિથેનોલ- (CH3OH)ના ઑક્સિડેશનથી મિથેનાલ (HCHO) બને છે, જે યકૃતકોષોના ઘટકો સાથે ત્વરિત પ્રક્રિયા કરી જીવરસનું સ્પંદન કરે છે. (સ્કંદન : ઈંડાને ગરમ કરતાં પ્રવાહીનું ઘનમાં રૂપાંતર)
→ મિથેનોલ દૃષ્ટિચેતાને પણ અસર પહોંચાડે છે. તેનાથી વ્યક્તિ અંધ થઈ શકે છે.
→ આમ, આલ્કોહોલનું સેવન જીવિત મનુષ્ય પર ગંભીર અસર કરે છે.
પ્રશ્ન 56. ઇથેનોલનો પીણાં તરીકે ઉપયોગ ટાળવા શું કરવું જોઈએ?
ઉત્તર : ઇથેનોલ એક મહત્ત્વનું ઔદ્યોગિક દ્રાવક છે.
→ ઔદ્યોગિક ઉપયોગ માટે તૈયાર થતાં ઇથેનોલનો દુરુપયોગ રોકવા માટે તેમાં મિથેનોલ જેવો ઝેરી પદાર્થ મિશ્ર કરવામાં આવે છે. તેથી તે પીવાયોગ્ય રહેતું નથી.
→ આલ્કોહોલની સરળતાથી ઓળખ થઈ શકે તે માટે રંગક ઉમેરીને આલ્કોહોલને ભૂરા રંગનો બનાવવામાં આવે છે, જેને વિકૃત આલ્કોહોલ કહે છે.
પ્રશ્ન 57. બળતણ સ્વરૂપે આલ્કોહોલનો ઉપયોગ સમજાવો.
ઉત્તર : શેરડીના છોડ એ સૂર્યપ્રકાશ(પ્રકાશ-ઊર્જા)નું રાસાયણિક ઊર્જામાં રૂપાંતર કરવા માટે સૌથી સક્ષમ રૂપાંતરક છે.
→ શેરડીનો રસ મોલાસિસ (શર્કરા) બનાવવા માટે ઉપયોગી છે. તેના આથવણ દ્વારા આલ્કોહોલ (ઇથેનોલ) બને છે.
→ આલ્કોહોલ (ઇથેનોલ) પૂરતી હવા(ઑક્સિજન)ની હાજરીમાં દહન પામે ત્યારે માત્ર કાર્બન ડાયૉક્સાઇડ અને પાણી ઉત્પન્ન કરતો હોવાથી તે સફાઈકર્તા બળતણ છે. પરિણામે કેટલાક દેશોમાં પેટ્રોલમાં આલ્કોહોલ ઉમેરણ તરીકે – બળતણ સ્વરૂપે ઉમેરવામાં આવે છે.
4.4.2 ઇથેનોઇક ઍસિડના ગુણધર્મો
પ્રશ્ન 58. ઇથેનોઇક ઍસિડના ભૌતિક ગુણધર્મો લખો.
ઉત્તર : ઇથેનોઇક ઍસિડ(ઍસિટિક ઍસિડ)ના ભૌતિક ગુણધર્મો નીચે મુજબ છે :
( 1 ) તે રંગવિહીન, તીવ્ર ખટાશયુક્ત વાસ ધરાવતું પ્રવાહી છે.
( 2 ) શુદ્ધ ઇથેનોઇક ઍસિડનું ઉત્કલનબિંદુ 391 K છે.
( 3 ) શુદ્ધ ઇથેનોઇક ઍસિડનું ગલનબિંદુ 290 K જેટલું નીચું હોવાથી શિયાળામાં તેમજ ઠંડી આબોહવામાં તે થીજી જાય છે. તેથી તેને ગ્લેસિયસ ઍસિટિક ઍસિડ તરીકે પણ ઓળખવામાં આવે છે.
( 4 ) તેના પાણીમાં બનાવેલા 5 – 8% સાંદ્રતા ધરાવતા જલીય દ્રાવણને સ૨કો (વિનેગર) કહે છે.
( 5 ) તે નિર્બળ ઍસિડ છે, પરંતુ હાઇડ્રોક્લોરિક ઍસિડ એ પ્રબળ ઍસિડ (સંપૂર્ણ આયનીકરણ પામે) છે.
પ્રશ્ન 59. ઇથેનોઇક ઍસિડના રાસાયણિક ગુણધર્મો સમજાવો.
અથવા
ઇથેનોઇક ઍસિડની રાસાયણિક પ્રક્રિયાઓ સમજાવો.
ઉત્તર : ( 1 ) એસ્ટરીકરણ પ્રક્રિયા (March 20) : ખનીજ ઍસિડ ઉદ્દીપકની હાજરીમાં કાર્બોક્સિલિક ઍસિડ અને આલ્કોહોલ વચ્ચેની પ્રક્રિયાથી એસ્ટર અને પાણી નીપજે છે. આ પ્રક્રિયાને એસ્ટરીકરણ પ્રક્રિયા કહે છે.
→ ઇથેનોઇક ઍસિડ એ ખનીજ ઍસિડ ઉદ્દીપકની હાજરીમાં રિશુદ્ધ આલ્કોહોલ સાથે પ્રક્રિયા કરી ઇથાઇલએસિટેટ બનાવે છે અને ઉપનીપજ તરીકે પાણી નીપજે છે.
→ એસ્ટર એ મીઠી વાસ ધરાવતાં સંયોજનો છે. તે અત્તર બનાવવા તેમજ સ્વાદ ઉત્પન્નકર્તા પદાર્થ તરીકે ઉપયોગી છે.
→ એસ્ટરમાંથી આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડના સોડિયમ ક્ષારમાં રૂપાંતર થવાની પ્રક્રિયાને સાબુનીકરણ કહે છે.
→ સોડિયમ હાઇડ્રૉક્સાઇડ કે જે આલ્કલી (બેઇઝ) છે, તેના વડે એસ્ટરનું ફરીથી આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડના સોડિયમ ક્ષારમાં રૂપાંતર થાય છે.
(2) બેઇઝ સાથેની પ્રક્રિયા (તટસ્થીકરણ) : કાર્બોક્સિલિક ઍસિડ એ ખનિજ ઍસિડ(HCl, HNO3, H2SO4)ની જેમ બેઇઝ સાથે પ્રક્રિયા કરી ક્ષાર અને પાણી બનાવે છે, જેને તટસ્થીકરણ કહે છે.
→ ઇથેનોઇક ઍસિડ સોડિયમ હાઇડ્રૉક્સાઇડ સાથે પ્રક્રિયા કરી સોડિયમ
(3) કાર્બોનેટ અને હાઇડ્રોજન કાર્બોનેટ સાથેની પ્રક્રિયા ઃ ઇથેનોઇક ઍસિડ કાર્બોનેટ અને હાઇડ્રોજન કાર્બોનેટ સાથે પ્રક્રિયા કરી ક્ષાર, પાણી અને કાર્બન ડાયૉક્સાઇડ બનાવે છે.
→ અહીં, ઉત્પન્ન થતો ક્ષાર સામાન્ય રીતે સોડિયમ એસિટેટ કહેવાય છે.
પ્રશ્ન 60. ઇથેનોઇક ઍસિડના ઉપયોગો લખો.
ઉત્તર : ઇથેનોઇક ઍસિડના ઉપયોગો નીચે મુજબ છે :
(1) વિનેગરની બનાવટમાં જે ખોરાકમાં સ્વાદિષ્ટ ખટાશ લાવે છે. (2) ખોરાકને લાંબો સમય સાચવવા માટે ખોરાક-સંરક્ષક (પ્રિઝર્વેટિવ) તરીકે, (3) પ્રયોગશાળામાં દ્રાવક અને પ્રક્રિયક તરીકે; (4) સફેદ લેડ (સફેદો) બનાવવા.
Intext પ્રશ્નોત્તર
પ્રશ્ન 61. પ્રાયોગિક ધોરણે તમે આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડને કેવી રીતે જુદા પાડશો?
ઉત્તર : આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડ પ્રાયોગિક રીતે નીચેની પ્રક્રિયા દ્વારા અલગ કરી શકાય છેઃ
(1) સોડિયમ હાઇડ્રોજન કાર્બોનેટ કસોટી : બે જુદી જુદી કસનળીમાં બંને પદાર્થોનો થોડો જથ્થો લઈ, તેમાં સોડિયમ હાઇડ્રોજન કાર્બોનેટનું દ્રાવણ ઉમેરવામાં આવે છે.
→ જે કસનળીમાં કાર્બોક્સિલિક ઍસિડનું દ્રાવણ હશે તે કસનળીમાં ઝડપથી CO2 વાયુના ઊભરા આવે છે, જ્યારે ઇથેનોલના દ્રાવણમાં CO2 વાયુના ઊભરા આવતા નથી.
(2) આલ્કલાઇન પોટૅશિયમ પરમેંગેનેટ કસોટી : બે જુદી જુદી સનળીમાં બંને પદાર્થોનો થોડો જથ્થો લઈ, તેમાં આલ્કલાઇન પોટૅશિયમ પરમેંગેનેટનું દ્રાવણ ઉમેરવામાં આવે છે.
→ જે સનળીમાં આલ્કોહોલનું દ્રાવણ હશે તે કસનળીમાં પોટૅશિયમ પરમેંગેનેટનો જાંબલી રંગ દૂર થાય છે, જ્યારે કાર્બોક્સિલિક ઍસિડનું દ્રાવણ પોટૅશિયમ પરમેંગેનેટનો રંગ દૂર કરતું નથી.
પ્રશ્ન 62. ઑક્સિડેશનકર્તા એટલે શું?
ઉત્તર : જુઓ પ્રશ્ન 44નો ઉત્તર,
4.5 સાબુ અને પ્રક્ષાલકો
પ્રશ્ન 63, સાબુ એટલે શું? સાબુના અણુનું બંધારણ જણાવો.
ઉત્તર : સાબુ એ લાંબી શૃંખલાયુક્ત કાર્બોક્સિલિક ઍસિડ(ટી ઍસિડ)નો સોડિયમ અથવા પોટૅશિયમ ક્ષાર છે.
→ સાબુના અણુ-બંધારણમાં બે ભાગ હોય છે : (1) અધ્રુવીય ભાગ ઃ જે લાંબી હાઇડ્રોકાર્બન શૃંખલા ધરાવે છે. તે જળવિરાગી છેડો છે. તે અધ્રુવીય પૂંછડી તરીકે ઓળખાય છે. (2) ધ્રુવીય ભાગ : જે ઋણ ભાર ધરાવે છે. તે જળઅનુરાગી છેડો છે. તે ધ્રુવીય શીર્ષ તરીકે ઓળખાય છે.
પ્રશ્ન 64. સાબુ અને ડિટર્જન્ટના ક્રિયાશીલ સમૂહ જણાવી, તેના અણુનું બંધારણ જણાવો.
ઉત્તર : સાબુમાં હાઇડ્રોકાર્બન (R) સાથે – COONa (સોડિયમ કાર્બોક્સિલેટ) ક્રિયાશીલ સમૂહ જોડાયેલ હોય છે.
જ્યારે ડિટર્જન્ટમાં હાઇડ્રોકાર્બન (R) સાથે – SO3Na (સોડિયમ સલ્ફોનેટ) ક્રિયાશીલ સમૂહ જોડાયેલ હોય છે.
પ્રશ્ન 65. મિસેલ રચનાની ક્રિયાવિધિ સમજાવો.
અથવા
સફાઈકાર્યમાં સાબુની અસર સમજાવો.
અથવા
સાબુની સફાઈ પ્રક્રિયાની ક્રિયાવિધિ સમજાવો.
ઉત્તર : સાબુના અણુ લાંબી શૃંખલા ધરાવતા કાર્બોક્સિલિક ઍસિડના સોડિયમ અથવા પોટૅશિયમ ક્ષાર છે.
→ સાબુના અણુના બંને છેડા અલગ ગુણધર્મો ધરાવે છે. એક છેડો જળઅનુરાગી છે, જે પાણી સાથે પારસ્પરિક ક્રિયા કરે છે, જ્યારે બીજો છેડો જવિરાગી છે, જે હાઇડ્રોકાર્બન સાથે પારસ્પરિક ક્રિયા કરે છે.
→ જ્યારે સાબુ પાણીની સપાટી પર હોય, ત્યારે સાબુની જળવિરાગી (હાઇડ્રોફોબિક) ‘પૂંછડી’ પાણીમાં દ્રાવ્ય થશે નહિ અને તે પાણીની સપાટી પર ગોઠવાય છે. જ્યારે સાબુનું જળઅનુરાગી (હાઇડ્રોફિલિક) ‘શીર્ષ’ પાણીમાં દ્રાવ્ય થશે.
→ પાણીની અંદર આ અણુઓની એક વિશિષ્ટ પ્રકારની ગૌઠવણી હોય છે, જે હાઇડ્રોકાર્બન ભાગને પાણીની બહાર રાખે છે,
→ આવું અણુઓનો મોટો સમૂહ બનવાને કારણે થાય છે. જેમાં જવિરાગી પૂંછડી ઝુમખા(ગુચ્છ)ના અંદરના ભાગમાં હોય છે, જ્યારે તેનો આયનીય છેડો ઝુમખાની સપાટી પર હોય છે.
→ આ સંરચનાને મિસેલ કહે છે,
→ મિસેલના રૂપમાં સાબુ સફાઈ કરવા સક્ષમ હોય છે, કારણ કે તેલી મૈલ મિસેલના કેન્દ્રમાં એકત્રિત થાય છે,
→ આ મિસેલ દ્રાવણમાં કલિલ સ્વરૂપે રહે છે,
→ આયન-આયન વચ્ચેના અપાકર્ષણના કારણે તે અવક્ષેપિત થવા માટે એકઠા થતા નથી,
→ આમ, મિસેલમાં નિલંબિત થયેલા મેલને સરળતાથી ધોઈ શકાય છે.
→ સાબુના મિસેલ મોટા પાયે પ્રકાશનું પ્રકીર્ણન કરી શકે છે. આથી સાબુનું દ્રાવણ ધૂંધળું (વાદળ જેવું) દેખાય છે.
પ્રશ્ન 66, પ્રક્ષાલકો વિશે ટૂંકનોંધ લખો.
ઉત્તર : વસ્તુની સપાટી પર ચોંટેલા મેલને દૂર કરવા માટે વપરાતા રાસાયણિક પદાર્થોને પ્રક્ષાલકો કહે છે.
→ રાસાયણિક રીતે પ્રક્ષાલક લાંબી શૃંખલા ધરાવતા સલ્ફોનિક ઍસિડના સોડિયમ ક્ષાર કે ક્લોરાઇડ અથવા બ્રોમાઇડ આયનો ધરાવતા એમોનિયમ ક્ષાર છે.
→ પ્રક્ષાલકોના વીજભારિત છેડા કઠિન પાણીમાં હાજર કૅલ્શિયમ અથવા મેગ્નેશિયમ આયનો સાથે અદ્રાવ્ય અવક્ષેપ બનાવતા નથી, જે દ્રાવ્ય ક્ષારરૂપે હોય છે.
→ આમ, તે કઠિન પાણીમાં પણ અસરકારક રહે છે.
→ સામાન્ય રીતે પ્રક્ષાલકનો ઉપયોગ શૅમ્પૂ અને કપડાં ધોવાના પદાર્થો બનાવવા માટે થાય છે.
પ્રશ્ન 67. સાબુ અને ડિટર્જન્ટમાં કોણ વધુ અસરકારક પ્રક્ષાલક છે? શા માટે? સાબુ કરતાં ડિટર્જન્ટનો ઉપયોગ વધ્યો છે. કેમ?
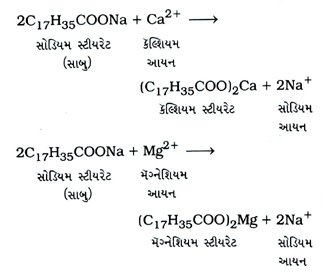
ઉત્તર : સાબુ અને ડિટર્જન્ટ પૈકી ડિટર્જન્ટ વધુ અસરકારક પ્રક્ષાલક છે. કઠિન પાણીમાં રહેલાં Ca2+ અને Mg2+ ધાતુ આયનો સાથે સાબુ પ્રક્રિયા કરી અવક્ષેપ આપે છે અને સાબુનો વ્યય થાય છે.
ડિટર્જન્ટ Ca2+ અને Mg2+ ધાતુ આયનો સાથે અવક્ષેપ આપતાં નથી, પરંતુ દ્રાવ્ય ક્ષારો આપે છે. આ કારણે ડિટર્જન્ટનો વ્યય થતો નથી. પરિણામે સાબુના પ્રમાણમાં ડિટર્જન્ટ ઓછો વપરાય છે.
આથી સાબુ કરતાં ડિટર્જન્ટનો ઉપયોગ વધ્યો છે.
Intext પ્રશ્નોત્તર
પ્રશ્ન 68. શું તમે પ્રક્ષાલકનો ઉપયોગ કરી ચકાસી શકો છો કે પાણી કઠિન છે કે નહિ?
ઉત્તર : ના. કારણ કે પ્રક્ષાલક કઠિન અને નરમ એમ બંને પ્રકારના પાણીમાં ફીણ ઉત્પન્ન કરે છે.
પ્રશ્ન 69. લોકો કપડાં ધોવા માટે વિવિધ પદ્ધતિઓનો ઉપયોગ કરે છે. સામાન્ય રીતે સાબુ ઉમેર્યા પછી લોકો કપડાં પથ્થર પર પછાડે છે કે પાવડી સાથે પછાડે છે. બ્રશથી ઘસે છે અથવા મિશ્રણને વૉશિંગ મશીનમાં ક્ષોભિત કરે (ખૂબ જોરથી હલાવે) છે. સાફ કપડાં મેળવવા માટે તેને રગડવાની જરૂર શા માટે પડે છે?
ઉત્તર : સાબુ પાણીનું પૃષ્ઠતાણ ઘટાડે છે.
→ સાબુનો અધ્રુવીય પૂંછડીવાળો હાઇડ્રોકાર્બન ભાગ એ કપડાં પરના મેલ અથવા તેલના અણુ સાથે આકર્ષાય છે, જ્યારે ધ્રુવીય પૂંછડીવાળો ભાગ એ પાણી પ્રત્યે આકર્ષાય છે. તેથી મિસેલની રચના થાય છે.
→ આ મિસેલ કપડાં પરથી દૂર કરવા માટે રગડવાની જરૂર પડે છે.
સ્વાધ્યાયના પ્રશ્નોત્તર
1. ઇથેન અણુનું આણ્વીય સૂત્ર C2H6 છે, તેમાં …
(a) 6 સહસંયોજક બંધ છે.
(b) 7 સહસંયોજક બંધ છે.
(c) 8 સહસંયોજક બંધ છે.
(d) 9 સહસંયોજક બંધ છે.
ઉત્તર : (b) 7 સહસંયોજક બંધ છે.
2. બ્યુટેનોન ચાર કાર્બન ધરાવતું સંયોજન છે, જેમાં ક્રિયાશીલ સમૂહ .
(a) કાર્બોક્સિલિક ઍસિડ
(b) આલ્ડિહાઇડ
(c) કીટોન
(d) આલ્કોહોલ
ઉત્તર : (C) કીટોન
3. ખોરાક રાંધતી વખતે, જો વાસણનાં તળિયાં બહારથી કાળાં થઈ રહ્યાં હોય, તો તેનો અર્થ એ છે કે …
(a) ખોરાક સંપૂર્ણ રંધાયો નથી.
(b) બળતણનું સંપૂર્ણ દહન થયું નથી.
(c) બળતણ ભીનું છે.
(d) બળતણ સંપૂર્ણ રીતે દહન પામી રહ્યું છે.
ઉત્તર : (b) બળતણનું સંપૂર્ણ દહન થયું નથી.
4. CH3Cl માં બંધ-નિર્માણનો ઉપયોગ કરી સહસંયોજક બંધની પ્રકૃતિ સમજાવો.
ઉત્તર : કાર્બન, હાઇડ્રોજન અને ક્લોરિનનો પરમાણ્વીય ક્રમાંક અનુક્રમે 6, 1 અને 17 છે. આથી તેમની ઇલેક્ટ્રૉનીય રચના નીચે મુજબ છે :
| પરમાણુ |
K કક્ષા |
L કક્ષા |
M કક્ષા |
| કાર્બન |
2 |
4 |
– |
| હાઇડ્રોજન |
1 |
– |
– |
| ક્લોરિન |
2 |
8 |
7 |
→ જે સૂચવે છે કે, કાર્બનને અષ્ટક પૂર્ણ કરવા માટે 4 ઇલેક્ટ્રૉનની, હાઇડ્રોજનને ડબ્લેટ (duplet) પૂર્ણ કરવા માટે 1 ઇલેક્ટ્રૉનની તથા ક્લોરિનને અષ્ટક પૂર્ણ કરવા માટે 1 ઇલેક્ટ્રૉનની આવશ્યકતા છે.
→ આથી કાર્બન પરમાણુની બાહ્યતમ કક્ષાના 4 ઇલેક્ટ્રૉન પૈકી 3 ઇલેક્ટ્રૉન ત્રણ હાઇડ્રોજન પરમાણુના ૩ ઇલેક્ટ્રૉન સાથે, જ્યારે 1 ઇલેક્ટ્રૉન ક્લોરિન પરમાણુના 1 ઇલેક્ટ્રૉન સાથે નીચે પ્રમાણે ભાગીદારી કરી ચાર સહસંયોજક બંધ રચે છે :
→ આમ, 4 ઇલેક્ટ્રૉન સાથે ભાગીદારી કરી કાર્બન ૫૨માણુ નજીકના નિષ્ક્રિય વાયુ નિયોન, હાઇડ્રોજન પરમાણુ નજીકના નિષ્ક્રિય વાયુ હિલિયમ અને ક્લોરિન પરમાણુ નજીકના નિષ્ક્રિય વાયુ આર્ગોન જેવી ઇલેક્ટ્રૉનીય રચના પ્રાપ્ત કરી; સ્થિરતા પ્રાપ્ત કરે છે.
→ ટૂંકમાં, ક્લોરોમિથેન ત્રણ C−H અને એક C – Cl એમ ચાર સહસંયોજક બંધ રચે છે.
5. ઇલેક્ટ્રૉન-બિંદુ નિરૂપણ દોરો :
(a) ઇથેનોઇક ઍસિડ
(b) H2S
(c) પ્રોપેનોન
(d) F2
ઉત્તર :
6. સમાનધર્મી શ્રેણી એટલે શું? ઉદાહરણ સહિત સમજાવો.
ઉત્તર : વ્યાખ્યા : કાર્બનિક સંયોજનોની એવી શ્રેણી કે જેમાં કાર્બન-શૃંખલામાં રહેલા હાઇડ્રોજનને સમાન પ્રકારના ક્રિયાશીલ સમૂહ દ્વારા વિસ્થાપિત કરવામાં આવેલ હોય, તેને સમાનધર્મી શ્રેણી કહે છે.
સમાન ક્રિયાશીલ સમૂહ ધરાવતાં જે કાર્બનિક સંયોજનોની શ્રેણીનો દરેક સભ્ય તેની પહેલાંના કે પછીના ક્રમિક સભ્યથી કાર્બન અને હાઇડ્રોજન પરમાણુઓની ચોક્કસ સંખ્યા(–CH2)માં તફાવત ધરાવતો હોય, તો તે કાર્બનિક સંયોજનોની શ્રેણીને સમાનધર્મી શ્રેણી કહે છે.
→ આ આલ્કોહોલની સમાનધર્મી શ્રેણી છે. આ શ્રેણીના દરેક સભ્યમાં સમાન ક્રિયાશીલ સમૂહ – OH (હાઇડ્રૉક્સિલ) છે.
→ આ શ્રેણીમાં ક્રમિક સભ્યથી પહેલાંના કે પછીના સભ્યમાં પરમાણુની સંખ્યામાં – CH2 જેટલો તફાવત છે. તેથી આણ્વીય દળમાં 14 u નો તફાવત છે.
7. તમે ભૌતિક તેમજ રાસાયણિક ગુણધર્મોને આધારે ઇથેનોલ અને ઇથેનોઇક ઍસિડને કેવી રીતે વિભેદિત કરશો?
ઉત્તર : ભૌતિક ગુણધર્મોમાં તફાવત :
8. જ્યારે સાબુને પાણીમાં ઉમેરવામાં આવે ત્યારે મિસેલનું નિર્માણ શા માટે થાય છે? શું ઇથેનોલ જેવાં બીજાં દ્રાવકો દ્વારા પણ મિસેલનું નિર્માણ થશે?
ઉત્તર : સાબુનો અણુ જુદા જુદા ગુણધર્મ ધરાવતા બે છેડા ધરાવે છે. એક છેડો ધ્રુવીય શીર્ષ ધરાવે છે, જેને હાઇડ્રોફિલિક શીર્ષ કહે છે. જ્યારે બીજો છેડો અધ્રુવીય પૂંછડી ધરાવે છે, જેને હાઇડ્રોફોબિક પૂંછડી કહે છે.
→ ધ્રુવીય શીર્ષ પાણીના અણુ પ્રત્યે આકર્ષણ ધરાવે છે, જ્યા૨ે અધ્રુવીય પૂંછડી પાણીના અણુ પ્રત્યે અપાકર્ષણ ધરાવે છે.
→ જ્યારે સાબુને પાણીમાં ઓગાળવામાં આવે છે, ત્યારે ધ્રુવીય શીર્ષ પાણીમાં દ્રાવ્ય થાય છે, પરંતુ અધ્રુવીય પૂંછડી પાણીમાં અદ્રાવ્ય રહે છે. પરિણામે ગોળાકાર મિસેલ રચાય છે.
→ સાબુ ઇથેનોલમાં સંપૂર્ણ દ્રાવ્ય છે. આથી ઇથેનોલ જેવાં દ્રાવકોમાં મિસેલ રચના શક્ય નથી.
9. કાર્બન અને તેનાં સંયોજનોનો ઉપયોગ મોટે ભાગે બળતણ તરીકે શા માટે થાય છે?
ઉત્તર : જ્યા૨ે કાર્બનનું હવા અથવા ઑક્સિજનની હાજરીમાં દહન કરવામાં આવે ત્યારે કાર્બન ડાયૉક્સાઇડ અને પાણી ઉત્પન્ન થાય છે. ઉપરાંત વિપુલ પ્રમાણમાં ઊર્જા અને પ્રકાશ ઉત્પન્ન થાય છે.
C(s) + O2(g) → CO2(g) + ઊર્જા + પ્રકાશ
→ જ્યારે કાર્બન અને તેના સંયોજનનું દહન કરવામાં આવે ત્યારે વધારાની ઉષ્માની જરૂર પડતી નથી. તેથી કાર્બન અને તેનાં સંયોજનો બળતણ માટે ઉપયોગી છે.
10. કઠિન પાણીમાં સાબુનો ઉપયોગ કરવાથી થતું ફીણનું નિર્માણ સમજાવો.
ઉત્તર : કઠિન પાણી કૅલ્શિયમ અને મૅગ્નેશિયમ આયનો ધરાવે છે, જે સાબુના અણુ સાથે સંયોજાઈ કૅલ્શિયમ અને મૅગ્નેશિયમના સફેદ અવક્ષેપ બનાવે છે, જેને સ્કમ (Scum) કહે છે.
11. જો તમે લિટમસપેપર(લાલ અથવા ભૂરા)થી સાબુને ચકાસો, તો તમે શું ફેરફાર અવલોકિત કરશો?
ઉત્તર : સાબુ એ બેઝિક (આલ્કલાઇન) માધ્યમ ધરાવતો હોઈ, લાલ લિટમસપત્ર ભૂરું (વાદળી) બને છે, જ્યારે વાદળી લિટમસપત્ર પર કોઈ અસર થશે નહિ.
12. હાઇડ્રોજનીકરણ એટલે શું? તેની ઔદ્યોગિક ઉપયોગિતા શું છે?
ઉત્તર : અસંતૃપ્ત હાઇડ્રોકાર્બન સંયોજનની નિકલ અથવા પેલેડિયમ ઉદ્દીપકની હાજરીમાં ડાયહાઇડ્રોજન સાથે પ્રક્રિયા થઈ સંતૃપ્ત હાઇડ્રોકાર્બન બનવાની ક્રિયાને હાઇડ્રોજનીકરણ કહે છે. ઉપયોગ : હાઇડ્રોજીનેશનથી ઔદ્યોગિક ધોરણે વનસ્પતિ તેલમાંથી વનસ્પતિ ઘી બનાવી શકાય છે.
13. આપેલ હાઇડ્રોકાર્બન C2H6, C3H8, C3H6, C2H2 અને CH4 પૈકી કોની યોગશીલ પ્રક્રિયા થાય છે?
ઉત્તર : C3H6 અને C2H2 આ બંને સંયોજનો અસંતૃપ્ત હોવાથી તેમની યોગશીલ પ્રક્રિયા થાય છે.
14. સંતૃપ્ત અને અસંતૃપ્ત હાઇડ્રોકાર્બનને વિભેદિત કરવા ઉપયોગમાં લેવાતી એક કસોટી જણાવો.
ઉત્તર : માખણ સંતૃપ્ત હાઇડ્રોકાર્બન સંયોજન છે, જ્યારે રાંધવા માટે વપરાતું તેલ અસંતૃપ્ત હાઇડ્રોકાર્બન સંયોજન છે.
→ અસંતૃપ્ત સંયોજન આલ્કલાઇન KMnO4 નો ગુલાબી રંગ દૂર કરે છે.
→ માખણમાં થોડા પ્રમાણમાં આલ્કલાઇન KMnO4 ઉમેરવાથી તેનો ગુલાબી રંગ દૂર થતો નથી, જ્યારે રાંધવા માટે વપરાતા તેલમાં થોડા પ્રમાણમાં આલ્કલાઇન KMnO4 ઉમેરતાં તેનો ગુલાબી રંગ દૂર થાય છે.
હેતુલક્ષી પ્રશ્નોત્તર
પ્રશ્ન 1. એક શબ્દમાં ઉત્તર આપો :
(1) પૃથ્વીના પોપડામાં ખનિજ સ્વરૂપે રહેલ કાર્બનનું ટકાવાર પ્રમાણ જણાવો.
(2) વાતાવરણમાં કાર્બન ડાયૉક્સાઇડનું ટકાવાર પ્રમાણ જણાવો.
(3) કાર્બન, ઑક્સિજન અને નાઇટ્રોજન પરમાણુમાં L કોશમાં ઇલેક્ટ્રૉનની સંખ્યા અનુક્રમે જણાવો.
(4) બાયોગૅસ અને CNGનો મુખ્ય ઘટક જણાવો.
(5) સામાન્ય રીતે સહસંયોજક સંયોજનોનાં ગલનબિંદુ અને ઉત્લનબિંદુ કેવાં હોય છે?
(6) વિદ્યુતના વહનની દૃષ્ટિએ કાર્બન સંયોજનો કેવાં હોય છે?
(7) કાર્બનનું સૌથી સખત બહુરૂપ કયું છે?
(8) કેટેનેશનની દૃષ્ટિએ કાર્બન પછીના ક્રમે આવતું તત્ત્વ જણાવો.
(9) કાર્બન સંયોજનોની સંખ્યા આશરે કેટલી અંદાજવામાં આવી છે?
(10) સંતૃપ્ત આલ્કેન સંયોજનોનું સામાન્ય સૂત્ર જણાવો.
(11) અસંતૃપ્ત આલ્કીન સંયોજનોનું સામાન્ય સૂત્ર જણાવો.
(12) અસંતૃપ્ત આલ્કાઇન સંયોજનોનું સામાન્ય સૂત્ર જણાવો.
(13) રાસાયણિક દૃષ્ટિએ સંતૃપ્ત સંયોજનો કરતાં અસંતૃપ્ત સંયોજનો કેવાં હોય છે?
(14) કેટલા કાર્બનથી વધુ કાર્બન હોય, તો જ વલય-રચના શક્ય બને?
(15) હેક્ઝેનના શક્ય સમઘટકો કેટલા છે?
(16) સમાનધર્મી શ્રેણીના બે ક્રમિક સભ્યમાં આણ્વીય દળનો તફાવત કેટલો હોય છે?
(17) હાઇડ્રોજીનેશન પ્રક્રિયામાં ઉદ્દીપક તરીકે વપરાતાં તત્ત્વો જણાવો.
(18) કઠિન પાણીમાં કયા આયનો હાજર હોય છે?
(19) બ્યુટેનોન અને બ્યુટેનાલમાં અનુક્રમે કયા કયા ક્રિયાશીલ સમૂહ છે?
ઉત્તર :
(1) 0.02 %
(2) 0.03%
(3) 4, 6, 5
(4) મિથેન
(5) નીચાં
(6) અવાહક
(7) હીરો
(8) સલ્ફર
(9) ત્રણ મિલિયન
(10) CnH2n+2
(11) CnH2n
(12) CnH2n-2
(13) વધુ ક્રિયાશીલ
(14) ત્રણ
(15) પાંચ
(16) 14 u
(17) નિકલ, પેલેડિયમ
(18) કૅલ્શિયમ, મૅગ્નેશિયમ
(19) કીટોન, આલ્ડિહાઇડ
પ્રશ્ન 2. વ્યાખ્યા આપો :
(1) સહસંયોજક બંધ
ઉત્તર : બે કે તેથી વધુ પરમાણુઓ વચ્ચે ઇલેક્ટ્રૉનની ભાગીદારી દ્વારા રચાતા બંધને સહસંયોજક બંધ કહે છે.
(2) કેટેનેશન
ઉત્તર : કાર્બન પરમાણુ અન્ય કાર્બન પરમાણુઓ સાથે બંધ બનાવવાની અદ્વિતીય ક્ષમતા ધરાવે છે, જેથી વધુ સંખ્યામાં અણુઓ (સંયોજનો) બને છે. કાર્બનના આ ગુણધર્મને કેટેનેશન કહે છે.
(3) સંતૃપ્ત કાર્બન સંયોજનો
ઉત્તર : જે કાર્બનિક સંયોજનોમાં કાર્બન પરમાણુઓ માત્ર એલબંધથી જોડાયેલા હોય તેવાં સંયોજનોને સંતૃપ્ત કાર્બન સંયોજનો કહે છે.
(4) અસંતૃપ્ત કાર્બન સંયોજનો
ઉત્તર : જે કાર્બનિક સંયોજનોમાં બે કે તેથી વધુ કાર્બન પરમાણુઓ દ્વિબંધ કે ત્રિબંધથી જોડાયેલા હોય તેવાં સંયોજનોને અસંતૃપ્ત કાર્બન સંયોજનો કહે છે.
(5) હાઇડ્રોકાર્બન
ઉત્તર : જે કાર્બન સંયોજનો માત્ર કાર્બન અને હાઇડ્રોજન ધરાવે છે, તેમને હાઇડ્રોકાર્બન કહે છે.
(6) ક્રિયાશીલ સમૂહો
ઉત્તર : વિષમ પરમાણુઓ અને તેમને સમાવતા સમૂહો કે જે સંયોજનોને વિશિષ્ટ ગુણધર્મો આપે છે, જે કાર્બન-શૃંખલાની લંબાઈ અને સ્વભાવ પર આધારિત નથી, તેમને ક્રિયાશીલ સમૂહો કહે છે.
(7) સમાનધર્મી શ્રેણી
ઉત્તર : કાર્બનિક સંયોજનોની એવી શ્રેણી કે જેમાં કાર્બન-શૃંખલામાં રહેલ હાઇડ્રોજનને સમાન પ્રકારના ક્રિયાશીલ સમૂહ દ્વારા વિસ્થાપિત કરવામાં આવેલ હોય, તેને સમાનધર્મી શ્રેણી કહે છે.
(8) દહન પ્રક્રિયા
ઉત્તર : કાર્બન (અથવા મોટા ભાગનાં કાર્બનિક સંયોજનો) તેના બધાં જ અપરરૂપોમાં, હવામાં દહન પામીને કાર્બન ડાયૉક્સાઇડ, ઉષ્મા અને પ્રકાશ મુક્ત કરે છે, તેને દહન પ્રક્રિયા કહે છે.
(9) ઑક્સિડેશનકર્તા
ઉત્તર : કેટલાક પદાર્થો અન્ય પદાર્થોમાં ઑક્સિજન ઉમેરવા માટે સક્ષમ હોય છે, તેને ઑક્સિડેશનકર્તા કહે છે.
(10) યોગશીલ પ્રક્રિયા
ઉત્તર : જે રાસાયણિક પ્રક્રિયા દરમિયાન કાર્બનિક સંયોજનોમાં બીજો અણુ ઉમેરાવાથી નવું કાર્બનિક સંયોજન બને, તો તે પ્રક્રિયાને યોગશીલ પ્રક્રિયા કહે છે.
(11) વિસ્થાપન પ્રક્રિયા
ઉત્તર : જે પ્રક્રિયામાં કાર્બનિક સંયોજનના અણુમાં રહેલા પરમાણુ કે પરમાણુઓના સમૂહનું અન્ય પરમાણુ કે પરમાણુઓના સમૂહ વડે વિસ્થાપન થાય, તો તે પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છે.
(12) એસ્ટરીકરણ
ઉત્તર : ખનીજ ઍસિડ ઉદ્દીપકની હાજરીમાં કાર્બોક્સિલિક ઍસિડ અને આલ્કોહોલ વચ્ચેની પ્રક્રિયાથી એસ્ટર અને પાણી નીપજે છે. આ પ્રક્રિયાને એસ્ટરીકરણ કહે છે.
(13) સાબુનીકરણ
ઉત્તર : એસ્ટરમાંથી આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડના સોડિયમ ક્ષારમાં રૂપાંતર થવાની ક્રિયાને સાબુનીકરણ કહે છે.
પ્રશ્ન 3. ખાલી જગ્યા પૂરોઃ
(1) તમામ સજીવ સંરચનાઓ ……….. પર આધારિત છે.
(2) પૃથ્વીનો પોપડો ખનિજ સ્વરૂપે ……….. કાર્બન ધરાવે છે.
(3) કાર્બન તેના બાહ્યતમ કોશમાં ……….. ઇલેક્ટ્રૉન ધરાવે છે.
(4) ક્લોરિનનો પરમાણુક્રમાંક ……….. છે.
(5) એમોનિયાનું અણુસૂત્ર ……….. છે.
(6) બાયોગૅસ અને CNGનો મુખ્ય ઘટક ……. છે.
(7) સંતૃપ્ત સંયોજનોમાં કાર્બન ૫૨માણુ વચ્ચે ………. બંધ હોય છે.
(8) બ્યુટેનોન ચાર કાર્બન ધરાવતું સંયોજન છે, જેમાં ……… ક્રિયાશીલ સમૂહ આવેલો છે.
(9) પ્રોપેનનું આણ્વીય સૂત્ર ………. છે.
(10) આલ્કીનનું સામાન્ય સૂત્ર ……. છે.
(11) મોટા ભાગનાં કાર્બન સંયોજનો દહન દ્વારા ……… અને મુક્ત કરે છે.
(12) અસંતૃપ્ત હાઇડ્રોકાર્બન ……. જ્યોત આપે છે.
(13) આલ્કોહોલનું …….. માં ઑક્સિડેશન થાય છે.
(14) જે પદાર્થો પ્રક્રિયાને અસર પહોંચાડ્યા વગર જ પ્રક્રિયાને જુદા જુદા દરથી આગળ વધારે છે, તેને ……. કહે છે.
(15) વનસ્પતિ તેલના હાઇડ્રોજીનેશનમાં ………. ઉદ્દીપકનો ઉપયોગ થાય છે.
(16) પ્રાણીજ ચરબીમાં ……… હોય છે.
(17) CH4 નું સૂર્યપ્રકાશની હાજરીમાં ક્લોરિન વડે વિસ્થાપન થવાથી ……… બને છે.
(18) ટિક્ચર આયોડિનની બનાવટમાં ……… ઉપયોગી છે.
(19) આલ્કોહોલની સોડિયમ સાથેની પ્રક્રિયાથી ………. ઉત્પન્ન થાય છે.
(20) સાંદ્ર H2SO4 એ ……… છે.
ઉત્તર :
(1) કાર્બન
(2) 0.02%
(3) ચાર
(4) 17
(5) NH3
(6 ) મિથેન
(7) એક
(8) કીટોન
(9) C3H8
(10) CnH2n
(11) ઉષ્મા, પ્રકાશ
(12) કાળા ધુમાડાવાળી પીળી
(13) કાર્બોક્સિલિક ઍસિડ
(14) ઉદ્દીપકો
(15) Ni
(16) સંતૃપ્ત ફૅટી ઍસિડ
(17) CH3Cl
(18) ઇથેનોલ
(19) H2/ હાઇડ્રોજન
(20) નિર્જલીકરણકર્તા
પ્રશ્ન 4. નીચેનાં વિધાનો ખરાં છે કે ખોટાં તે જણાવો:
(1) પ્રોપીન સંતૃપ્ત હાઇડ્રોકાર્બન છે. :
(2) આલ્કેન કરતાં અનુવર્તી આલ્કીન કે આલ્કાઇન સંયોજનોની ક્રિયાશીલતા વધુ હોય છે.
(3) સમાનધર્મી શ્રેણીના બે ક્રમિક સભ્યમાં પરમાણુની સંખ્યામાં CH2 જેટલો તફાવત હોય છે.
(4) 5 % પાણી ધરાવતા ઇથેનોલના દ્રાવણને પરિશુદ્ધ આલ્કોહોલ કહે છે.
(5) ફૉર્માલ્ડિહાઇડનું આણ્વીય સૂત્ર HCHO છે.
(6) CH3CH2COOHનું IUPAC નામ બ્યુટેનોઇક ઍસિડ છે.
(7) પ્રક્ષાલકનો ઉપયોગ શૅમ્પૂ અને કપડાં ધોવાના પદાર્થો બનાવવા માટે થાય છે.
(8) સાબુનો અણુ મિસેલ તરીકે ઓળખાતી રચના બનાવે છે.
(9) સાબુનું દ્રાવણ ધૂંધળું દેખાય છે, કારણ કે મિસેલ પ્રકાશનું પ્રકીર્ણન કરે છે.
(10) કાર્બોક્સિલિક ઍસિડની સોડિયમ કાર્બોનેટ સાથે પ્રક્રિયા કરતાં CO2 ઉત્પન્ન થાય છે.
(11) આલ્કોહોલ રંગક ઉમેરતાં ભૂરા રંગનો બને છે, જેને વિકૃત આલ્કોહોલ કહે છે.
(12) ઇથેનોલના નિર્જલીકરણથી પ્રોપીન બને છે.
(13) કોલસા તથા પેટ્રોલમાં થોડી માત્રામાં નાઇટ્રોજન અને સલ્ફર હોવાથી તેના દહનથી વાતાવરણમાં પ્રદૂષણ ફેલાય છે.
ઉત્તર :
(1) ખોટું
(2 ) ખરું
(3) ખરું
(4) ખોટું
(5) ખરું
(6) ખોટું
(7) ખરું
(8) ખરું
(9) ખરું
(10) ખરું
(11) ખરું
(12) ખોટું
(13) ખરું
પ્રશ્ન 5. નીચેના દરેક પ્રશ્ન માટે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરી ઉત્તર લખો :
1. (− CHO) ક્રિયાશીલ સમૂહ ધરાવતા પદાર્થોને કયા સંયોજનો કહે છે?
A. એમાઇડ
B. આલ્ડિહાઇડ
C. કીટોન
D. આલ્કોહોલ
ઉત્તર : B. આલ્ડિહાઇડ
2. મિથાઇલઇથેનોએટમાં નીચેનામાંથી કયો ક્રિયાશીલ સમૂહ રહેલો છે?
A. આલ્કોહોલ
B. હેલાઇડ
C. કીટોન
D. એસ્ટર
ઉત્તર : D. એસ્ટર
3. મિથેનાલનું રિડક્શન કરતાં કયો પદાર્થ મળે છે?
A. ઇથેનોલ
B. CO2 અને O2
C. મિથેનોલ
D. આપેલ તમામ
ઉત્તર : C. મિથેનોલ
4. આલ્કોહોલ અને કાર્બોક્સિલિક ઍસિડની સાંદ્ર HŻSO4ની હાજરીમાં થતી પ્રક્રિયા નીચેનામાંથી કઈ છે?
A. જળવિભાજન
B. બીટા વિલોપન
C. સાબુનીકરણ
D. એસ્ટરીકરણ
ઉત્તર : D. એસ્ટરીકરણ
5. –OH ક્રિયાશીલ સમૂહ ધરાવતો પદાર્થ કયો છે?
A. આલ્કોહોલ
B. કીટોન
C. એસ્ટર
D. કાર્બોક્સિલિક ઍસિડ
ઉત્તર : A. આલ્કોહોલ
6. ફૉર્મિક ઍસિડમાં કેટલા કાર્બન હોય છે?
A. 1
B. 2
C. 3
D. 4
ઉત્તર : A. 1
7. ખોરાક-સંરક્ષક તરીકે કયો પદાર્થ ઉપયોગી છે?
A. CH3OH
B. CH3COOH
C. CH3CHO
D. CH3COCH3
ઉત્તર : B. CH3COOH
8. સાબુ અને ડિટર્જન્ટમાં અધ્રુવીય પૂંછડી …….. પ્રત્યે આકર્ષણ ધરાવે છે અને ઋણભારીય શીર્ષ …….. પ્રત્યે આકર્ષણ ધરાવે છે.
A. ડાઘ, ગ્લિસરોલ
B. પાણીના અણુ, ડાઘ
C. ડાઘ, પાણીના અણુ
D. પાણીના અણુ, ગ્લિસરોલ
ઉત્તર : C. ડાઘ, પાણીના અણુ
9. ઇથેનોઇક ઍસિડનું સામાન્ય નામ શું છે?
A. ફૉર્મિક ઍસિડ
B. ઍસિટિક ઍસિડ
C. પ્રોપેનોઇક ઍસિડ
D. બ્યુટેનોઇક ઍસિડ
ઉત્તર : B. ઍસિટિક ઍસિડ
10. NH3 નો અણુ શું ધરાવે છે?
A. માત્ર એકલબંધો
B. માત્ર દ્વિબંધો
C. માત્ર ત્રિબંધો
D. બે દ્વિબંધ અને એક એકલબંધ
ઉત્તર : A. માત્ર એકલબંધો
11. ફુલેરિન એ કોનું અપરરૂપ છે?
A. ફૉસ્ફરસ
B. સલ્ફર
C. કાર્બન
D. ટિન
ઉત્તર : C. કાર્બન
12. તેલની પેલેડિયમ અને નિકલ ઉદ્દીપકની હાજરીમાં હાઇડ્રોજન સાથેની પ્રક્રિયાથી ચરબી બને છે, તે શેનું ઉદાહરણ છે?
A. યોગશીલ પ્રક્રિયા
B. વિસ્થાપન પ્રક્રિયા
C. પુનર્વિન્યાસ પ્રક્રિયા
D. ઑક્સિડેશન પ્રક્રિયા
ઉત્તર : A. યોગશીલ પ્રક્રિયા
13. કઈ પરિસ્થિતિમાં ક્લોરિન સંતૃપ્ત હાઇડ્રોકાર્બન સાથે ઓરડાના તાપમાને પ્રક્રિયા કરે છે?
A. સૂર્યપ્રકાશની ગેરહાજરીમાં
B. સૂર્યપ્રકાશની હાજરીમાં
C. પાણીની હાજરીમાં
D. HClની હાજરીમાં
ઉત્તર : B. સૂર્યપ્રકાશની હાજરીમાં
14. ઇથેનોલ સોડિયમ સાથે પ્રક્રિયા કરી કઈ નીપજ આપશે?
A. સોડિયમ ઇથેનોએટ અને હાઇડ્રોજન
B. સોડિયમ ઇથેનોએટ અને ઑક્સિજન
C. સોડિયમ ઇથૉક્સાઇડ અને હાઇડ્રોજન
D. સોડિયમ ઇથૉક્સાઇડ અને ઑક્સિજન
ઉત્તર : C. સોડિયમ ઇથૉક્સાઇડ અને હાઇડ્રોજન
15. વિનેગર શેનું દ્રાવણ છે?
A. આલ્કોહોલમાં 50 % – 60 % ઍસેટિક ઍસિડ
B. આલ્કોહોલમાં 5 % – 8 % ઍસેટિક ઍસિડ
C. પાણીમાં 5 % − 8 % ઍસેટિક ઍસિડ
D. પાણીમાં 50 % – 60 % ઍસેટિક ઍસિડ
ઉત્તર : C. પાણીમાં 5 % − 8 % ઍસેટિક ઍસિડ
16. કાર્બન એક-સંયોજક પરમાણુ એટલે કે હાઇડ્રોજન સાથે પોતાના ચાર સંયોજકતા ઇલેક્ટ્રૉનની વહેંચણી કરીને ચાર સહસંયોજક બંધ બનાવે છે. ચાર બંધ બન્યા પછી કાર્બન કોના જેવી ઇલેક્ટ્રૉન- રચના પ્રાપ્ત કરશે?
A. હિલિયમ
B. નિયોન
C. આર્ગોન
D. ક્રિપ્ટોન
ઉત્તર : B. નિયોન
17. આલ્કલાઇનની સમાનધર્મી શ્રેણીનું પ્રથમ સભ્ય ક્યું છે?
A. ઇથાઇન
B. ઇથીન
C. પ્રોપાઇન
D. મિથેન
ઉત્તર : A. ઇથાઇન
18. પેન્ટેન (C5H12) કેટલા સહસંયોજક બંધ ધરાવે છે?
A. 5
B. 12
C. 16
D. 17
ઉત્તર : C. 16
મૂલ્યો આધારિત પ્રશ્નોત્તર (Value Based Questions with Answers)
1. એક દિવસ મુદ્રા રસોડામાં તેની માતા સાથે વાત કરતી હતી. તેની માતા સ્ટીલના વાસણમાં શાક રાંધતી હતી. વાતચીત દરમિયાન મુદ્રાએ જોયું કે સ્ટીલના વાસણની બહારની બાજુએ કાળા ડાઘ પડે છે. આ અવલોકન તેણે તેની માતાને જણાવ્યું. તેની માતાએ કહ્યું કે, આવું તો છેલ્લા કેટલાક સમયથી થાય છે. તદ્ઉપરાંત વાસણ પરથી કાળા ડાઘ દૂર કરવા પણ અઘરા પડે છે. દસમા ધોરણમાં ભણતી મુદ્રાએ ગૅસનો સ્ટવ તપાસ્યો અને તેણીએ કારણ શોધી, તેની માતાને પણ સમજાવ્યું. આ દરમિયાન મુદ્રાને શાળાએ જવાનું મોડું થયું. આથી તેણે તેની માતાને આ કાળા ડાઘ દૂર કરવાની રીત ઝડપથી સમજાવી. માતાએ તેણે સમજાવ્યા મુજબ કાળા ડાઘ દૂર કર્યા અને તે રીત અપનાવવાથી લાંબા સમય સુધી રાંધતી વખતે વાસણ પર ડાઘ પણ પડ્યા નહિ.
પ્રશ્નો :
(1) વાસણ પર કાળા ડાઘ શા માટે પડતા હતા? સમજાવો.
(2) આ પ્રમાણે જો વાસણ પર કાળા ડાઘ પડે, તો તેના બીજા બે ગેરફાયદા (નુકસાન) જણાવો.
(3) મુદ્રાએ ગૅસના સ્ટવની તપાસ દરમિયાન શું અવલોકન કર્યું?
(4) આ ખામી દૂર કરવા તેણે કયાં પગલાં લીધાં?
(5) મુદ્રાની સલાહ બાદ તેની માતાએ લીધેલાં પગલાં બાદ કેવી જ્યોત મળી?
(6) આ ઘટનામાં મુદ્રાના કયા ગુણોનું અવલોકન થયું?
ઉત્તર :
(1) અહીં, બળતણ તરીકે વપરાતા LPGનું અપૂર્ણ દહન થતું હોવાથી કાર્બનના કણો મુક્ત થતા હોવાથી વાસણો પર કાળા ડાઘ પડે છે. LPGનું અપૂર્ણ દહન થવાથી પીળા રંગની જ્યોત મળે છે.
(2) (i) LPGનું અપૂર્ણ દહન થવાથી ઓછી ઉષ્મા મુક્ત થતી હોઈ બળતણનો વ્યય થાય છે.
(ii) LPGનું અપૂર્ણ દહન થતાં મુક્ત થયેલા કાર્બનના કણોથી વાતાવરણ પ્રદૂષિત થાય છે.
(3) મુદ્રાએ અવલોકન કર્યું કે, ગૅસ-સ્ટવનાં છિદ્રો આંશિક રીતે ભરાઈ ગયાં છે.
(4) મુદ્રાએ તેની માતાને આ છિદ્રો સાફ કરવાનું જણાવ્યું. જેથી પૂરતા પ્રમાણમાં હવાનો જથ્થો બળતણને મળી શકે અને બળતણનું સંપૂર્ણ દહન થાય.
(5) ગૅસ-સ્ટવનાં છિદ્રોની પૂર્ણ સફાઈ થવાથી હવાનો પૂરતો જથ્થો બળતણને પ્રાપ્ત થવાથી LPGનું સંપૂર્ણ દહન થાય છે. આથી હવે ભૂરા રંગની જ્યોત (ઑક્સિડાઇઝિંગ જ્યોત) મળે છે.
(6) મુદ્રામાં (1) સારી અવલોકનક્ષમતા, (2) બળતણના દહનનું જ્ઞાન, (3) મેળવેલા જ્ઞાનનો રોજિંદા જીવનમાં ઉપયોગ અને (4) પર્યાવરણની જાળવણી જેવા ગુણોનું અવલોકન થયું.
2. યુગ એ ધોરણ 10માં ભણતો વિદ્યાર્થી છે. શાળાના અભ્યાસ સમય દરમિયાન તેના વિજ્ઞાન-શિક્ષક વિદ્યાર્થીઓ સાથે તેલ અને ચરબી વિશે ચર્ચા કરતા હતા. આ ચર્ચાથી યુગે તેલ અને ચરબી વિશેનાં કેટલાંક તથ્યો જાણ્યાં, જે તે પહેલાં નહોતો જાણતો. યુગે ઘેર આવી તેની માતાને પૂછ્યું કે તે રસોઈ બનાવતી વખતે કયા તેલનો ઉપયોગ કરે છે. તેની માતાએ જણાવ્યું કે, તે વનસ્પતિ ઘીનો ખોરાક રાંધવા માટે ઉપયોગ કરે છે. યુગે તેની માતાને વિનંતી કરી કે વનસ્પતિ ઘી સ્વાસ્થ્ય માટે હાનિકારક હોવાથી તેનો ઉપયોગ કરવો જોઈએ નહિ. યુગે તેની માતાને સમજાવ્યું કે વનસ્પતિ તેલનો ઉપયોગ કરવો એ સ્વાસ્થ્યવર્ધક છે. તેની માતાએ પણ તેની વિનંતી સ્વીકારી અને તેના જણાવ્યા અનુસાર વનસ્પતિ તેલથી રસોઈ રાંધવાની શરૂઆત કરી.
પ્રશ્નો :
(1) વનસ્પતિ ઘી અને વનસ્પતિ તેલની ભૌતિક સ્થિતિ જણાવો.
(2) વનસ્પતિ તેલ અને ચરબી રાસાયણિક દૃષ્ટિએ કેવી રીતે ભિન્ન છે?
(3) વનસ્પતિ તેલનું વનસ્પતિ ઘીમાં રૂપાંતર કઈ પદ્ધતિ દ્વારા થાય છે?
(4) વનસ્પતિ ઘી સ્વાસ્થ્ય માટે શા માટે યોગ્ય નથી?
(5) લોકો દ્વારા ઉપયોગમાં લેવાતા પ્રાણીજ ચરબીનાં ઉદાહરણ આપો.
(6) વનસ્પતિ તેલ શા માટે સ્વાસ્થ્યવર્ધક છે?
ઉત્તર :
(1) વનસ્પતિ ઘી અને વનસ્પતિ તેલ અનુક્રમે ઘન અને પ્રવાહી અવસ્થા ધરાવે છે.
(2) વનસ્પતિ તેલ એ અસંતૃપ્ત કાર્બન સંયોજન છે, જ્યારે ચરબી એ સંતૃપ્ત કાર્બન સંયોજન છે.
(3) હાઇડ્રોજીનેશન પદ્ધતિ દ્વારા વનસ્પતિ તેલનું વનસ્પતિ ઘીમાં રૂપાંતર થાય છે.
(4) વનસ્પતિ ઘીમાં સંતૃપ્ત ફૅટી ઍસિડ હોવાથી તે શરીરમાં ખરાબ કોલેસ્ટરોલનું પ્રમાણ વધારે છે, જે લાંબા ગાળે હૃદયરોગનું જોખમ ઊભું કરે છે. આથી તે સ્વાસ્થ્ય માટે યોગ્ય નથી.
(5) માખણ એ લોકો દ્વારા ઉપયોગમાં લેવાતું પ્રાણીજ ચરબીનું ઉદાહરણ છે.
(6) વનસ્પતિ તેલમાં અસંતૃપ્ત ફૅટી ઍસિડ હોવાથી તે શરીરમાં કોલેસ્ટરોલનું પ્રમાણ ઘટાડે છે. આથી હૃદયરોગનું જોખમ ઘટે છે. આથી તે સ્વાસ્થ્યવર્ધક છે.
પ્રાયોગિક કૌશલ્યો આધારિત પ્રશ્નોત્તરી (Practical Skill Based Questions with Answers)
1. કાર્બનિક સંયોજન ‘A’ જે અથાણાની સાચવણી માટે વપરાય છે. તેનું આણ્વીય સૂત્ર C2H4O2 છે. આ સંયોજનની ઍસિડની હાજરીમાં ઇથેનોલ સાથે પ્રક્રિયા કરતાં મીઠી સુગંધ ધરાવતું સંયોજન ‘B’ મળે છે.
(1) સંયોજન ‘A’ ઓળખાવો.
(2) સંયોજન ‘A’ની ઍસિડની હાજરીમાં ઇથેનોલ સાથેની પ્રક્રિયાનું સમીકરણ લખો.
(3) ધોવાના સોડાની સંયોજન ‘A’ સાથે પ્રક્રિયા કરવાથી કયો વાયુ નીપજે છે? આ પ્રક્રિયાનું સમીકરણ લખો.
(4) સંયોજન ‘B’માંથી સંયોજન ‘A’ મેળવવાની પ્રક્રિયાનું સમીકરણ લખો.
ઉત્તર :
( 1 ) સંયોજન A : CH3COOH (ઍસિટિક ઍસિડ)
2. નીચેની પ્રક્રિયાઓમાં A, B, C, D અને E ઓળખાવો :
हमसे जुड़ें, हमें फॉलो करे ..