Gujarat Board | Class 9Th | Science | Chemistry | Model Question Paper & Solution | Chapter – 4 Structure of the Atom (પરમાણુનું બંધારણ)
પ્રશ્નોત્તર
પ્રસ્તાવના
પ્રશ્ન 1. દ્રવ્યના મૂળભૂત બંધારણીય ઘટકો કયા કયા છે? [2 ગુણ]
ઉત્તર : દ્રવ્યના મૂળભૂત બંધારણીય ઘટકો અણુ અને પરમાણુ છે.
→ જુદા જુદા પ્રકારનાં દ્રવ્યોનું અસ્તિત્વ તે દ્રવ્યની રચના કરતાં જુદા જુદા પરમાણુઓને કારણે હોય છે.
પ્રશ્ન 2. 19મી સદીના અંતમાં વૈજ્ઞાનિકો માટે પરમાણુના અભ્યાસ અંગે કેવા પડકારો હતા? [2 ગુણ]
ઉત્તર : 19મી સદીના અંતમાં વૈજ્ઞાનિકો સમક્ષ મુખ્ય પડકારો આ હતા.
→ પરમાણુનું બંધારણ રજૂ કરવું અને તેના મહત્ત્વના ગુણધર્મો સમજાવવા.
→ ઉપરાંત, પરમાણુનું વિભાજન શક્ય છે કે નહિ તે સમજાવવું.
પ્રશ્ન 3. પરમાણુના બંધારણ અંગેનો પ્રાથમિક ખ્યાલ સમજાવો. [3 ગુણ]
અથવા
પરમાણુના અવપરમાણ્વીય કણો સમજાવો.
ઉત્તર : પરમાણુના બંધારણ અંગેનો અભ્યાસ જે. જે. થોમસન અને ઇ. ગોલ્ડસ્ટીને કર્યો હતો.
→ ઈ. સ. 1886માં ઇ. ગોલ્ડસ્ટીને વાયુવિભાર નળીનો પ્રયોગ કર્યો હતો.
→ આ પ્રયોગ દરમિયાન તેમણે વાયુવિભાર નળીમાં ધન વીજભારિત વિકિરણોની નોંધ કરી હતી.
→ આ ધન વીજભારિત વિકિરણ(શક્તિનો તરંગ સ્વરૂપે સંચાર)ને કેનાલ કિરણો તરીકે ઓળખવામાં આવે છે. જે આખરે અન્ય અવપરમાણ્વીય કણોની શોધ કરવા માટે પ્રેરે છે.
→ ઈ. સ. 1900ના સમયગાળા દરમિયાન એવું જાણવા મળ્યું કે પરમાણુ સામાન્ય તેમજ અવિભાજ્ય નથી, પરંતુ તે ઓછામાં ઓછો એક અવપરમાણ્વીય કણ ધરાવે છે.
→ જે. જે. થોમસન નામના વૈજ્ઞાનિકે આ અવપરમાણ્વીય કણની ઓળખ ઇલેક્ટ્રૉન તરીકે આપી હતી.
→ પ્રોટોનના વીજભારની તીવ્રતા ઇલેક્ટ્રૉન જેટલી પરંતુ ચિહ્ન વિરુદ્ધ હતું.
→ પ્રોટોનનું દળ ઇલેક્ટ્રૉનના દળ કરતાં આશરે 2000 ગણું વધુ હતું.
→ સામાન્ય રીતે ઇલેક્ટ્રૉનનેe” અને પ્રોટોનને p* સંજ્ઞા દ્વારા દર્શાવાય છે.
→ પ્રોટોનનું દળ એક એકમ અને તેનો વીજભાર +1 લેવામાં આવે છે. ઇલેક્ટ્રૉનનું દળ નહિવત્ (અવગણી શકાય તેટલું) અને વીજભાર −1 લેવામાં આવે છે.
→ આમ, પરમાણુ પ્રોટોન અને ઇલેક્ટ્રૉનનો બનેલો છે, જે પરસ્પર એકબીજાના વીજભારને સમતોલિત કરે છે. આથી પરમાણુ વીજભારની દૃષ્ટિએ તટસ્થ હોય છે.
→ પરમાણુના અંદરના ભાગમાં પ્રોટોન હોય છે. તેથી પ્રોટોનને સહેલાઈથી દૂર કરી શકાતો નથી. જ્યારે ઇલેક્ટ્રૉન કેન્દ્રની બહારના ભાગમાં હોવાથી તેને સહેલાઈથી દૂર કરી શકાય છે.
4.1 દ્રવ્યમાં રહેલા વીજભારિત કણો
પ્રશ્ન 4. કેનાલ કિરણો શું છે? [1 ગુણ]
ઉત્તર : વાયુવિભારના પ્રયોગ દરમિયાન ઉદ્ભવતા ધન વીજભારિત વિકિરણોને કેનાલ કિરણો તરીકે ઓળખવામાં આવે છે.
પ્રશ્ન 5. જો કોઈ પરમાણુમાં એક પ્રોટોન અને એક ઇલેક્ટ્રૉન હોય, તો તે વીજભાર ધરાવતો હશે કે નહિ? [1 ગુણ]
ઉત્તર : આ પરમાણુ વીજભારની દૃષ્ટિએ તટસ્થ છે, કારણ કે તેમાં ધન વીજભાર અને ઋણ વીજભાર ધરાવતા કણોની સંખ્યા સમાન છે.
4.2 પરમાણુનું બંધારણ
પ્રશ્ન 6. ડાલ્ટનની કઈ અભિધારણા ખોટી સાબિત થઈ? કેવી રીતે? [1 ગુણ]
ઉત્તર : ડાલ્ટનના મત મુજબ પરમાણુ અવિભાજ્ય અને અવિનાશી છે. આ અભિધારણા પરમાણુના મૂળભૂત કણો(પ્રોટોન અને ઇલેક્ટ્રૉન)ની શોધે ખોટી સાબિત કરી.
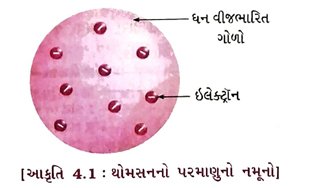
4.2.1 થોમસનનો પરમાણુનો નમૂનો
પ્રશ્ન 7. થોમસનના પરમાણુ નમૂનાનો ટૂંકમાં અહેવાલ આપો. [3 ગુણ]
અથવા
થોમસનના પરમાણુનો નમૂનો સમજાવો.
અથવા
થોમસનનો પરમાણુ નમૂનો સમજાવી, તે અન્ય કયાં કયાં નામથી પ્રચલિત છે તે જણાવો.
ઉત્તર : સૌપ્રથમ જે. જે. થોમસને ઈ. સ. 1898માં સૂચવ્યું કે, પરમાણુ ગોલીય આકાર ધરાવે છે. પરમાણુની ત્રિજ્યા આશરે 10-10 મીટર જેટલી છે.
→ થોમસનના મત મુજબ, પરમાણુ ધન વીજભારિત ગોળો છે અને તેમાં ઇલેક્ટ્રૉન જડિત થયેલા હોય છે.
→ આ નમૂનો ક્રિસમસ કેકને મળતો આવે છે. જેમ ક્રિસમસ કેકમાં સૂકી દ્રાક્ષ ગોઠવાયેલી હોય છે તેમ પરમાણુમાં ઇલેક્ટ્રૉન ગોઠવાયેલા હોય છે.
→ આ નમૂનો સમજવા માટે તરબૂચનું ઉદાહરણ પણ લઈ શકાય છે. જેમાં તરબૂચના લાલ ભાગમાં પ્રોટોન સમગ્ર રીતે ફેલાયેલા છે અને ઇલેક્ટ્રૉન એ લાલ ભાગમાં રહેલા કાળા બીજની જેમ ગોઠવાયેલા છે.
→ ઉપરાંત, થોમસને સૂચવ્યું કે પરમાણુમાં ઋણભાર અને ધનભાર સમાન માત્રામાં હોય છે. તેથી પરમાણુ વીજભારની દૃષ્ટિએ તટસ્થ હોય છે.
→ આ નમૂનો જુદાં જુદાં નામો જેવાં કે પ્લમ પુડિંગ, રાઝન પુડિંગ અથવા તરબૂચ નમૂનાથી પ્રચલિત છે.
પ્રશ્ન 8. થોમસનનો પરમાણ્વીય નમૂનો કેમ સ્વીકૃતિ પામ્યો નહિ? [2 ગુણ]
અથવા
થોમસનના પરમાણુ નમૂનાની મર્યાદા જણાવો.
ઉત્તર : થોમસનનો ૫૨માણ્વીય નમૂનો નીચેનાં કારણોસર સ્વીકૃતિ પામ્યો નહિ :
(1) થોમસને પરમાણ્વીય નમૂનામાં ધન અને ઋણ વીજભારોની ગોઠવણી સાચી દર્શાવી ન હતી, કારણ કે વિરુદ્ધ વીજભાર એકબીજાને આકર્ષી એકબીજામાં ભળી જવા જોઈએ. (2) થોમસને દર્શાવેલી ગોઠવણી જુદાં જુદાં તત્ત્વોના અલગ અલગ રાસાયણિક ગુણધર્મો સમજાવી શકતી નથી. (3) અન્ય વૈજ્ઞાનિકો દ્વારા થયેલા પ્રયોગોનાં પરિણામો થોમસનનો પરમાણ્વીય નમૂનો સમજાવી શક્યો નહિ.
4.2.2 રુથરફોર્ડનો પરમાણુનો નમૂનો
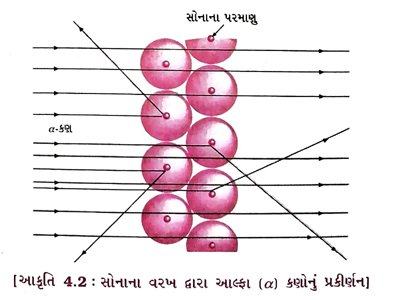
પ્રશ્ન 9. રુથરફોર્ડનો પ્રયોગ ટૂંકમાં વર્ણવી, આ પ્રયોગનાં અવલોકનો જણાવો. [3 ગુણ] અથવા ૪-કણ પ્રકીર્ણનનો પ્રયોગ સમજાવો.
ઉત્તર : રુથરફોર્ડનો પ્રયોગ : રુથરફોર્ડે સોનાના પાતળા વરખ પર ઝડપથી ગતિ કરતાં આલ્ફા (α) કણોનો મારો ચલાવ્યો. આ માટે તેમણે સોનાના 1000 પરમાણુ ધરાવતો અર્થાત્ લગભગ 100 nm જાડાઈ ધરાવતો વરખ પસંદ કર્યો હતો.
→ આલ્ફા કણનું સૂત્ર 42He++ છે. તે દ્વિવીજભારિત હિલિયમ આયન છે. તેનું દળ 4 u હોય છે.
→ ઝડપથી ગતિ કરતા આલ્ફા કણો નોંધપાત્ર ઊર્જા ધરાવે છે.
→ રુથરફોર્ડે એવું અનુમાન કર્યું હતું કે સોનાના ૫૨માણુઓમાં રહેલા અવપરમાણ્વીય કણો દ્વારા α-કણો વિચલન પામશે. અહીં પ્રોટોન કરતાં α-કણો ભારે હોવાથી વધુ વિચલનની અપેક્ષા ન હતી.
→ પરંતુ α – કણ પ્રકીર્ણનના પ્રયોગમાં મળેલાં અવલોકનો તદ્દન અનઅપેક્ષિત હતાં, જે નીચે મુજબ છેઃ
અવલોકનો : (1) ઝડપથી ગતિ કરતા વરખમાંથી સીધેસીધા જ પસાર થઈ જાય છે. -કણો સોનાના
(2) કેટલાંક -કણોનું સોનાના વરખ દ્વારા ઓછા અંશના ખૂણે વિચલન થાય છે.
(3) દર 12,000 વ-કણો પૈકી એક -કણ 180°ના ખૂણે અથડાઈને પાછો ફરે છે.
પ્રશ્ન 10. રુથરફોર્ડના -કણ પ્રકીર્ણનના પ્રયોગનાં તારણો જણાવો. [3 ગુણ]
અથવા
α-કણ પ્રકીર્ણનના પ્રયોગના ફલિતાર્થ જણાવો.
ઉત્તર : રુથરફોર્ડના વ-કણ પ્રકીર્ણનના પ્રયોગનાં તારણો (ફલિતાર્થ) નીચે મુજબ છે :
(1) સોનાના વરખમાંથી મોટા ભાગના -કણો વિચલન પામ્યા વગર સીધા જ પસાર થઈ જતાં હોવાથી કહી શકાય કે, પરમાણુનો મોટા ભાગનો વિસ્તાર ખાલી છે. અર્થાત્ પરમાણુ મહદંશે પોલો છે.
(2) ખૂબ જ થોડા -કણો પોતાના માર્ગમાંથી વિચલન પામે છે, જે દર્શાવે છે કે પરમાણુમાં ધન વીજભારિત ભાગ એ ખૂબ જ ઓછી જગ્યામાં રોકાયેલ છે.
(3) અતિશય ઓછી માત્રામાં -કણો 180° ખૂણે વિચલિત થયા હતા, જે સૂચવે છે કે સોનાના ૫૨માણુનો સંપૂર્ણ ધન વીજભારિત ભાગ અને દળ પરમાણુના અંદરના ભાગમાં ખૂબ જ ઓછી જગ્યામાં સંકેન્દ્રિત થયેલું છે.
(4) રુથરફોર્ડે ગણતરીથી શોધ્યું કે, પરમાણુની ત્રિજ્યા કરતાં તેના કેન્દ્રની ત્રિજ્યા 105 ગણી ઓછી છે.
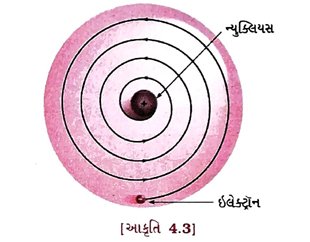
પ્રશ્ન 11. રુથરફોર્ડે સૂચવેલા પરમાણુના કેન્દ્રીય નમૂનાની લાક્ષણિકતાઓ જણાવો. [2 ગુણ]
ઉત્તર : રુથ૨ફોર્ડે તેના પ્રયોગના આધારે પરમાણુનો કેન્દ્રીય નમૂનો રજૂ કર્યો, જે નીચે મુજબની લાક્ષણિકતા ધરાવે છે :
(1) પરમાણુમાં રહેલ ધનભારિત કેન્દ્રને પરમાણુનું કેન્દ્ર (ન્યુક્લિયસ) કહે છે. તેમાં પરમાણુનું સમગ્ર દળ સમાયેલું છે.
(2) ઇલેક્ટ્રૉન કેન્દ્રની આસપાસ નિશ્ચિત કક્ષાઓમાં ભ્રમણ કરે છે.
(3) પરમાણુના કદની સાપેક્ષે તેનું કેન્દ્ર ખૂબ જ નાનું હોય છે.
પ્રશ્ન 12. રુથરફોર્ડના પરમાણુના નમૂનાની ખામીઓ જણાવો. [2 ગુણ]
અથવા
રુથરફોર્ડના પરમાણુના નમૂનાની મર્યાદાઓ દર્શાવો.
ઉત્તર : રુથરફોર્ડના પરમાણુના નમૂનાની ખામીઓ નીચે મુજબ છે :
→ વર્તુળાકાર પરિભ્રમણ કક્ષામાં ઇલેક્ટ્રૉનનું ભ્રમણ સ્થાયી હોઈ શકે નહિ, કારણ કે પ્રવેગિત કણ હંમેશાં વિકિરણ સ્વરૂપે ઊર્જા મુક્ત કરે છે.
→ આ પ્રમાણે ગતિ કરતો ઇલેક્ટ્રૉન ઊર્જા ગુમાવે અને અંતે કેન્દ્ર સાથે અથડામણ અનુભવે અથવા કેન્દ્રમાં દાખલ થઈ જાય.
→ જો આમ થાય તો ૫૨માણુ સ્થાયી રહી શકે નહિ અને દ્રવ્ય સ્વરૂપે અસ્તિત્વ ધરાવી શકે જ નહિ.
4.2.3 બોહ્રનો પરમાણુનો નમૂનો
પ્રશ્ન 13. નીલ્સ બોહરે રજૂ કરેલ પરમાણુ બંધારણ અંગેની અભિધારણાઓ જણાવો. [3 ગુણ]
અથવા
બોહ્રનો પરમાણુનો નમૂનો સમજાવો.
ઉત્તર : નીલ્સ બોહરે પરમાણુ બંધારણ અંગે નીચે મુજબની અભિધારણાઓ રજૂ કરી :
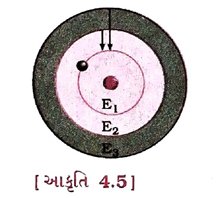
(1) પરમાણુમાં ઇલેક્ટ્રૉનની સ્વતંત્ર કક્ષાઓ તરીકે ઓળખાતી અમુક ચોક્કસ કક્ષાઓને માન્ય કક્ષાઓ તરીકે ગણવામાં આવે છે.
(2) સ્વતંત્ર કક્ષાઓ(માન્ય કક્ષાઓ)માં પરિભ્રમણ દરમિયાન ઇલેક્ટ્રૉન વિકિરણ સ્વરૂપે ઊર્જા મુક્ત કરતા નથી.
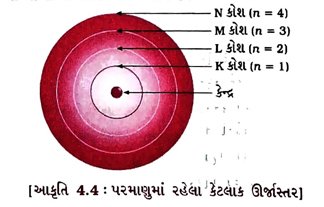
આ કક્ષાઓ અથવા કોશને ઊર્જાસ્તર તરીકે ઓળખવામાં આવે છે. જેમને K, L, M, N અક્ષરો દ્વારા અથવા n = 1, 2, 3, 4 સંખ્યાઓ વડે દર્શાવવામાં આવે છે.
Intext પ્રશ્નોત્તર
પ્રશ્ન 14. થોમસનના પરમાણુના નમૂનાના આધારે સમજાવો કે પરમાણુ સમગ્રતયા તટસ્થ છે. [1 ગુણ]
ઉત્તર : થોમસનના પરમાણુના નમૂના મુજબ પરમાણુમાં ઋણભાર અને ધનભાર સમાન માત્રામાં હોય છે. તેથી પરમાણુ વીજભારની દૃષ્ટિએ સમગ્રતયા તટસ્થ હોય છે.
પ્રશ્ન 15. રુથરફોર્ડના પરમાણુના નમૂનાના આધારે પરમાણુના કેન્દ્રમાં કયો અવપરમાણ્વીય કણ હાજર હોય છે? [1 ગુણ]
ઉત્તર : રુથરફોર્ડના પરમાણુના નમૂનાના આધારે પરમાણુના કેન્દ્રમાં પ્રોટોન અવપરમાણ્વીય કણ તરીકે હાજર હોય છે.
પ્રશ્ન 16. ત્રણ કોશ ધરાવતા પરમાણુનો બોહ્રનો નમૂનો દોરો. [1 ગુણ]
ઉત્તર : ત્રણ કોશ ધરાવતા પરમાણુનો બોહ્રનો નમૂનો નીચે મુજબ છે :
પ્રશ્ન 17. આલ્ફા કણ પ્રકીર્ણનના પ્રયોગમાં સોનાના વરખને બદલે અન્ય કોઈ ધાતુના વરખનો ઉપયોગ કરીને કરવામાં આવે, તો અવલોકન નોંધી શકાય? [2 ગુણ]
ઉત્તર : આલ્ફા કણ પ્રકીર્ણનના પ્રયોગમાં સોનાના વરખને બદલે જો તેના કરતાં વધુ ભારે ધાતુનો ઉપયોગ કરવામાં આવે, તો વિચલન વધુ પ્રમાણમાં અને જો સોના કરતાં હલકી ધાતુનો ઉપયોગ કરવામાં આવે તો વિચલન ઓછા પ્રમાણમાં જોવા મળશે.
→ ભારે ધાતુમાં અપાકર્ષણની માત્રા વધુ જ્યારે હલકી ધાતુમાં અપાકર્ષણની માત્રા ઓછી હોય છે.
4.2.4 ન્યૂટ્રોન
પ્રશ્ન 18. ન્યૂટ્રૉન વિશે સામાન્ય માહિતી આપો. [2 ગુણ]
ઉત્તર : ઈ. સ. 1932માં જૅમ્સ ચેડવિકે પરમાણુમાં રહેલા એક અન્ય અવપરમાણ્વીય કણની શોધ કરી હતી.
→ આ કણ વીજભારવિહીન (તટસ્થ) અને તેનું દળ પ્રોટોનના દળ જેટલું જ હતું, જેને ન્યૂટ્રૉન નામ અપાયું.
→ ન્યૂટ્રૉન પરમાણુના કેન્દ્રમાં આવેલા હોય છે. હાઇડ્રોજન પરમાણુના કેન્દ્રમાં ન્યૂટ્રૉન હોતો નથી.
→ તેની સંજ્ઞા ‘n’ છે. (10n)
→ પરમાણુનું સમગ્ર દળ પ્રોટોન અને ન્યૂટ્રૉનના દળના સરવાળા જેટલું હોય છે.
Intext પ્રશ્નોત્તર
પ્રશ્ન 19. પરમાણુના ત્રણ અવપરમાણ્વીય કણોનાં નામ આપો. [1 ગુણ)
ઉત્તર : પરમાણુના ત્રણ અવપરમાણ્વીય કણો પ્રોટોન, ન્યૂટ્રાન અને ઇલેક્ટ્રૉન છે.
પ્રશ્ન 20. હિલિયમ પરમાણુનું પરમાણ્વીય દળ 4u છે અને તેના કેન્દ્રમાં 2 પ્રોટોન છે, તો તેમાં કેટલા ન્યૂટ્રૉન હશે? [1 ગુણ]
ઉત્તર : ન્યૂટ્રૉનની સંખ્યા n = A − p = 4 − 2 = 2
4.3 વિવિધ કક્ષાઓ(કોશો)માં ઇલેક્ટ્રૉન કેવી રીતે વહેંચાય છે?
પ્રશ્ન 21. પરમાણુની વિભિન્ન કક્ષાઓમાં ઇલેક્ટ્રૉનની વહેંચણી કયા વૈજ્ઞાનિકોએ સૂચવી? જુદા જુદા ઊર્જાસ્તરમાં ઇલેક્ટ્રૉનની સંખ્યા દર્શાવવા માટેના નિયમો જણાવો. [3 ગુણ]
અથવા
પ્રથમ અઢાર તત્ત્વોની વિવિધ કોશોમાં ઇલેક્ટ્રૉનની વહેંચણીના નિયમો દર્શાવો.
ઉત્તર : પરમાણુની વિભિન્ન કક્ષાઓમાં ઇલેક્ટ્રૉનની વહેંચણી બોહ્ર અને બરી નામના વૈજ્ઞાનિકોએ સૂચવી.
→ જુદા જુદા ઊર્જાસ્તર અથવા કોશમાં ઇલેક્ટ્રૉનની સંખ્યા દર્શાવવા માટે નીચે મુજબના નિયમો અનુસરવામાં આવે છે :
(1) કક્ષામાં હાજર રહેલા ઇલેક્ટ્રૉનની મહત્તમ સંખ્યા 2n સૂત્ર દ્વારા દર્શાવાય છે; જ્યાં, n = કક્ષાનો અથવા ઊર્જાસ્તરનો ક્રમ 1, 2, 3, ….. વગેરે છે.
આમ, જુદી જુદી કક્ષાઓમાં રહેલા ઇલેક્ટ્રૉનની મહત્તમ સંખ્યા નીચે મુજબ દર્શાવી શકાય :
→ પ્રથમ કક્ષા અથવા K કોશમાં મહત્તમ e– = 2 (1)2 = 2
→ બીજી કક્ષા અથવા L કોશમાં મહત્તમ e– = 2 (2)2 = 8
→ ત્રીજી કક્ષા અથવા M કોશમાં મહત્તમ e– = 2 (3)2 = 18
→ ચોથી કક્ષા અથવા N કોશમાં મહત્તમ e– = 2 (4)2 = 32 અને તેવી જ રીતે આગળની કક્ષાઓમાં ઇલેક્ટ્રૉન ગોઠવી શકાશે.
(2) સૌથી બહારની કક્ષામાં મહત્તમ 8 ઇલેક્ટ્રૉન સમાવી શકાય છે.
(3) પરમાણુમાં જ્યાં સુધી અંદરની કક્ષાઓ ઇલેક્ટ્રૉનથી સંપૂર્ણ ભરાઈ ન જાય ત્યાં સુધી ઇલેક્ટ્રૉન બહારની કક્ષામાં દાખલ થતા નથી. ટૂંકમાં, કક્ષાઓ ઇલેક્ટ્રૉનથી તબક્કાવાર ભરાય છે.
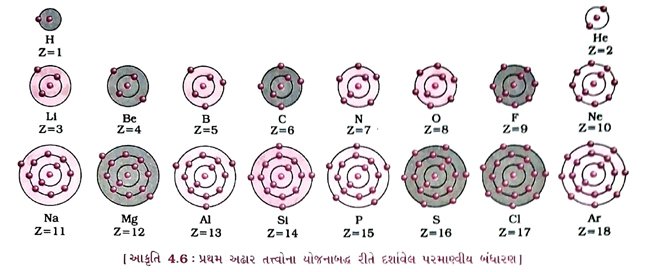
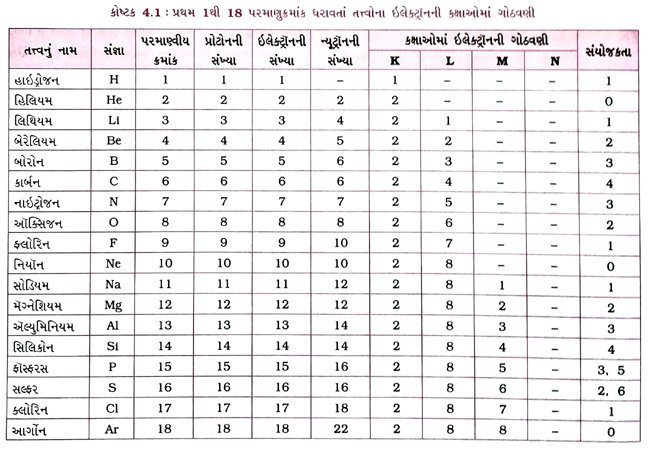
પ્રશ્ન 22. પ્રથમ અઢાર તત્ત્વોના પરમાણ્વીય બંધારણ જણાવો. [3 ગુણ)
ઉત્તર : પ્રથમ અઢાર તત્ત્વોના પરમાણ્વીય બંધારણ નીચે મુજબ છે :
પ્રથમ અઢાર તત્ત્વોની ઇલેક્ટ્રૉનીય રચના દર્શાવતો સ્થિર નમૂનો તૈયાર કરો.
ઉત્તર : પ્રથમ અઢાર તત્ત્વોની ઇલેક્ટ્રૉનીય રચના તથા પરમાણુઓની સંરચના નીચે કોષ્ટકમાં દર્શાવી છેઃ
Intext પ્રશ્નોત્તર
પ્રશ્ન 23. કાર્બન અને સોડિયમ પરમાણુઓમાં ઇલેક્ટ્રૉનની વહેંચણી દર્શાવો. [2 ગુણ]
ઉત્તર :
પ્રશ્ન 24. કોઇ પરમાણુના K અને L કોશ ઇલેક્ટ્રૉનથી ભરાયેલા છે, તો તે પરમાણુમાં ઇલેક્ટ્રૉન સંખ્યા કેટલી હશે? [2 ગુણ]
ઉત્તર : પરમાણુના K અને L કૌશ ઇલેક્ટ્રૉનથી ભરાયેલા છે, તો તે પરમાણુમાં કુલ 10 ઇલેક્ટ્રૉન હોય.
4.4 સંયોજકતા
પ્રશ્ન 25. સંયોજકતા વિશે નોંધ લખો. [3 ગુણ]
ઉત્તર : પરમાણુની સૌથી બહારની (બાહ્યતમ) કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યાને સંયોજકતા ઇલેક્ટ્રૉન કહે છે અને તે કક્ષાને સંયોજકતા કહે છે.
→ સંયોજકતા કક્ષામાંના અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યાને તે પરમાણુની સંયોજકતા કહે છે.
→ દરેક તત્ત્વનો પરમાણુ અન્ય તત્ત્વના પરમાણુ સાથે સંયોજાવા માટેની નિશ્ચિત ક્ષમતા ધરાવે છે, જેને સંયોજકતા કહે છે.
→ કોઇ પણ પરમાણુની બાહ્યતમ કક્ષામાં વધુમાં વધુ 8 ઇલેક્ટ્રૉન સમાવી શકાય છે.
→જે તત્ત્વોની બાહ્યતમ કક્ષા ઇલેક્ટ્રૉનથી સંપૂર્ણ ભરાયેલી હોય તેવાં તત્ત્વોના પરમાણુઓ ખૂબ જ ઓછી રાસાયણિક સક્રિયતા દર્શાવે છે. આવાં તત્ત્વોના પરમાણુઓની અન્ય તત્ત્વોના પરમાણુઓ સાથે સંયોજાવાની ક્ષમતા અથવા સંયોજકતા શૂન્ય હોય છે.
→જે તત્ત્વોની સંયોજકતા શૂન્ય હોય તેવાં તત્ત્વોને નિષ્ક્રિય તત્ત્વો કહે છે, નિષ્ક્રિય તત્ત્વો પૈકી માત્ર હિલિયમની બાહ્યતમ કક્ષામાં બે ઇલેક્ટ્રૉન છે, જ્યારે બાકીનાં તત્ત્વોની બાહ્યતમ કક્ષામાં આઠ ઇલેક્ટ્રૉન છે.
→ દરેક તત્ત્વનો પરમાણુ બાહ્યતમ કક્ષામાં અષ્ટક રચના પ્રાપ્ત કરવાનો પ્રયત્ન કરે છે. આ માટે તે પરમાણુ અન્ય તત્ત્વના પરમાણુ સાથે ઇલેક્ટ્રૉનની ભાગીદારી અથવા આપ-લે કરે છે.
→ બે કે તેથી વધુ તત્ત્વોના પરમાણુની બાહ્યતમ કક્ષામાં ભાગીદારી કરતાં અથવા વિનિમય કરતાં ઇલેક્ટ્રૉનની સંખ્યાને સંયોજકતા કહે છે.
પ્રશ્ન 26. તત્ત્વની સંયોજકતા કેવી રીતે નક્કી કરી શકાય છે. ઉદાહરણ આપી સમજાવો, [3 ગુણ)
ઉત્તર : કોઈ પણ તત્ત્વની સંયોજકતા બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યા દ્વારા નક્કી થાય છે.
દા. ત., ( 1 ) હાઇડ્રોજન લિથિયમ કે સોડિયમ તત્ત્વના પરમાણુઓ બાહ્યતમ કક્ષામાં એક ઇલેક્ટ્રૉન ધરાવે છે. આથી આ તત્ત્વો એક ઇલેક્ટ્રૉન ગુમાવી શકે છે. તેથી તેમની સંયોજકતા એક છે તેમ કહી શકાય.
( 2 ) મગ્નેશિયમ અને ઍલ્યુમિનિયમની સંયોજકતા અનુક્રમે બે અને ત્રણ છે.
→ જ્યારે સંયોજકતા ઇલેક્ટ્રૉનની સંખ્યા 5 થી 7 હોય, ત્યારે સૌથી બહારની કક્ષામાં અષ્ટક પૂર્ણ કરવા જોઈતા ઇલેક્ટ્રૉનની સંખ્યા સંયોજકતા બને, જેમ કે, ઑક્સિજનના ૫૨માણુની સૌથી બહારની કક્ષામાં 6 ઇલેક્ટ્રૉન હોવાથી અષ્ટક પૂર્ણ કરવા 2 ઇલેક્ટ્રૉન જોઈએ. તેથી ઑક્સિજનની સંયોજકતા 2 થાય. ક્લોરિનના પરમાણુની સૌથી બહારની કક્ષામાં 7 ઇલેક્ટ્રૉન હોવાથી અષ્ટક પૂર્ણ કરવા 1 ઇલેક્ટ્રૉન જોઈએ. તેથી ક્લોરિનની સંયોજકતા 1 છે.
[નોંધઃ 5 કે તેથી વધુ સંયોજકતા ઇલેક્ટ્રૉન ધરાવતા પરમાણુની સંયોજકતા, 8 માંથી સંયોજકતા ઇલેક્ટ્રૉનને બાદ કરતાં મળતી સંખ્યા જેટલી હોય છે.]
પ્રશ્ન 27. સંયોજકતા ઇલેક્ટ્રૉન કોને કહે છે? સંયોજકતા ઇલેક્ટ્રૉનનું મહત્ત્વ સમજાવો. [2 ગુણ]
ઉત્તર : સંયોજકતા ઇલેક્ટ્રૉન ઃ તત્ત્વના પરમાણુની સૌથી બહા૨ની કક્ષામાં રહેલા ઇલેક્ટ્રૉનને સંયોજકતા ઇલેક્ટ્રૉન કહે છે.
સંયોજકતા ઇલેક્ટ્રૉનનું મહત્ત્વ ઃ સંયોજકતા ઇલેક્ટ્રૉન દ્વારા (1) પરમાણુનો ઉત્સર્જન વર્ણપટ અને (2) પરમાણુના રાસાયણિક ગુણધર્મ સમજાવી શકાય છે.
Intext પ્રશ્નોત્તર
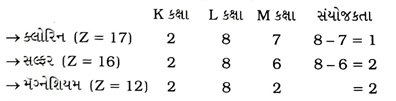
પ્રશ્ન 28. ક્લોરિન, સલ્ફર અને મૅગ્નેશિયમ પરમાણુઓની સંયોજકતા તમે કેવી રીતે શોધશો? [2 ગુણ]
ઉત્તર :
4.5 પરમાણ્વીય ક્રમાંક અને દળાંક
4.5.1 પરમાણ્વીય ક્રમાંક
પ્રશ્ન 29. પરમાણ્વીય ક્રમાંક એટલે શું? તેની લાક્ષણિકતાઓ જણાવો. [2 ગુણ]
ઉત્તર : પરમાણ્વીય ક્રમાંક : કોઈ પણ તત્ત્વના પરમાણુના કેન્દ્રમાં રહેલા પ્રોટોનની સંખ્યાને પરમાણ્વીય ક્રમાંક કહે છે.
→ પરમાણ્વીય ક્રમાંકને ‘Z’ વડે દર્શાવવામાં આવે છે.
→ કોઈ પણ પરમાણુના કેન્દ્રમાં જેટલા પ્રોટોન હોય તેટલી જ સંખ્યાના ઇલેક્ટ્રૉન કેન્દ્રની ફરતે પરિભ્રમણ કરતાં હોય છે. તેથી પરમાણુ વીજભારની દૃષ્ટિએ તટસ્થ હોય છે.
→ આમ, પરમાણ્વીય ક્રમાંક (Z) = કેન્દ્રમાં રહેલા પ્રોટોનની સંખ્યા (p)
= કેન્દ્રની ફરતે પરિભ્રમણ કરતા ઇલેક્ટ્રૉનની સંખ્યા (ē)
દા. ત., હાઇડ્રોજન માટે Z = 1 છે, કારણ કે હાઇડ્રોજનના કેન્દ્રમાં 1 પ્રોટોન હાજર છે. કાર્બન માટે Z = 6 છે, કારણ કે કાર્બનની કક્ષામાં 6 ઇલેક્ટ્રૉન હાજર છે. (વધુ સમજૂતી માટે જુઓ આકૃતિ 4.6)
પરમાણ્વીય ક્રમાંકની લાક્ષણિકતાઃ કોઈ એક તત્ત્વના બધા જ પરમાણુઓ માટે પરમાણ્વીય ક્રમાંક (Z) સમાન જ હોય છે.
→ પરમાણ્વીય ક્રમાંક હંમેશાં ઘન પૂર્ણાંક જ હોય છે.
4.5.2 પરમાણ્વીય દળાંક
પ્રશ્ન 30. દળાંક એટલે શું? સમજાવો. [2 ગુણ]
ઉત્તર : પ્રાયોગિક રીતે સાબિત થયું છે કે પરમાણુનું દળ કેન્દ્રમાં રહેલા પ્રોટોન અને ન્યૂટ્રૉન જેવા અવપરમાણ્વીય કણોને કારણે હોય છે. આમ, પરમાણુનું સમગ્ર દળ તેના કેન્દ્રમાં હોય છે.
→ પ્રોટોન અને ન્યૂટ્રૉનને ન્યુક્લિઓન્સ પણ કહે છે.
દળાંક : ૫૨માણુના કેન્દ્રમાં રહેલા પ્રોટોન અને ન્યૂટ્રૉનની કુલ સંખ્યાના સરવાળાને તત્ત્વનો દળાંક કહે છે.
→ દળાંકને ‘A’ વડે દર્શાવવામાં આવે છે.
→ ટૂંકમાં, દળાંક (A) = પ્રોટોનની સંખ્યા (p) + ન્યૂટ્રૉનની સંખ્યા (n)
∴ A = p + n
∴ A = Z + n (‘.’ p = Z)
∴ n = A – Z
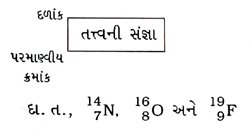
પ્રશ્ન 31. કોઈ પણ તત્ત્વના પરમાણુને દર્શાવવા માટેની સંજ્ઞા જણાવો. [2 ગુણ]
ઉત્તર : કોઈ પણ તત્ત્વના પરમાણુને દર્શાવવા માટે તેના પરમાણ્વીય ક્રમાંક, દળાંક અને તત્ત્વની સંજ્ઞા નીચે મુજબ દર્શાવી શકાય :
→ આ સંજ્ઞાને ન્યુક્લિઇડ્ઝ કહે છે.
પ્રશ્ન 32. જો પરમાણુમાં રહેલા ઇલેક્ટ્રૉનની સંખ્યા 8 અને પ્રોટોનની સંખ્યા પણ 8 હોય, તો ( i ) પરમાણુનો પરમાણ્વીય ક્રમાંક કેટલો થાય? અને (ii) પરમાણુનો વીજભાર કેટલો થાય? [2 ગુણ]
ઉત્તર : (i) Z = 8 (ii) વીજભાર = શૂન્ય
પ્રશ્ન 33. કોષ્ટક 4.1ની મદદથી ઑક્સિજન અને સલ્ફરના દળાંક શોધો. [2 ગુણ]
ઉત્તર : ઑક્સિજન પરમાણુ માટે,
પ્રોટોનની સંખ્યા (p) = 8; ન્યૂટ્રૉનની સંખ્યા (n) = 8
∴ દળાંક (A) = p + n = 8 + 8 = 16 u
સલ્ફર પરમાણુ માટે,
પ્રોટોનની સંખ્યા = 16; ન્યૂટ્રૉનની સંખ્યા = 16
∴ દળાંક(A) = p + n = 16 + 16 = 32 u
4.6 સમસ્થાનિકો
પ્રશ્ન 34. સમસ્થાનિકો વિશે નોંધ લખો. [3 ગુણ]
ઉત્તર : કુદરતમાં અમુક એવાં તત્ત્વો અસ્તિત્વ ધરાવે છે કે જેઓના પરમાણ્વીય ક્રમાંક સમાન, પરંતુ દળાંક અસમાન હોય છે. દા. ત.,
( 1 ) હાઇડ્રોજન પરમાણુ ત્રણ પરમાણ્વીય ઘટકો ધરાવે છે, જે અનુક્રમે પ્રોટિયમ (11H), ડ્યુટેરિયમ (21H અથવા D) અને ટ્રિટિયમ (31H અથવા T) છે. આ દરેકના પરમાણ્વીય ક્રમાંક 1 છે, પરંતુ દળાંક અનુક્રમે 1, 2 અને 3 છે.
( 2 ) કાર્બન : 126C અને 146C
( 3 ) ક્લોરિન : 3517Cl અને 3717Cl
વ્યાખ્યા : સમાન તત્ત્વના જુદા જુદા પરમાણુઓ કે જેમના પરમાણ્વીય ક્રમાંક સમાન, પરંતુ દળાંક અસમાન હોય તેમને સમસ્થાનિકો કહે છે.
→ ઘણાં તત્ત્વો સમસ્થાનિકોનું મિશ્રણ ધરાવતાં હોય છે. તત્ત્વનો દરેક સમસ્થાનિક એક શુદ્ધ પદાર્થ છે.
→ સમસ્થાનિકોના રાસાયણિક ગુણધર્મો સમાન હોય છે, પરંતુ તેઓના ભૌતિક ગુણધર્મો જુદા જુદા હોય છે.
પ્રશ્ન 35. જે તત્ત્વો સમસ્થાનિક ધરાવતા હોય તે તત્ત્વોનું પરમાણ્વીય દળ કેવી રીતે નક્કી કરી શકાય છે? [3 ગુણ]
ઉત્તર : કોઈ પણ કુદરતી તત્ત્વના પરમાણુનું દળ એ તે તત્ત્વના કુદરતી રીતે મળતા તમામ પરમાણુઓના દળના સરેરાશ જેટલું હોય છે.
→ જો . તત્ત્વને કોઈ સમસ્થાનિક ન હોય તો તે તત્ત્વનું દળ તેના કેન્દ્રમાં રહેલા પ્રોટોન અને ન્યૂટ્રૉનની કુલ સંખ્યાના સરવાળા જેટલું હોય છે.
→ પરંતુ જે તત્ત્વ સમસ્થાનિક સ્વરૂપે મળે તો દરેક સમસ્થાનિક સ્વરૂપના ટકાવાર પ્રમાણ પરથી સરેરાશ પરમાણ્વીય દળની ગણતરી કરવામાં આવે છે, જે નીચે મુજબ છે :
જો સમસ્થાનિક સ્વરૂપનું ટકાવાર પ્રમાણm n અને પરમાણ્વીય દળ અનુક્રમે a અને b હોય, તો
→ આમ, Clનું સરેરાશ પરમાણ્વીય દળ 35.5u છે. આનો અર્થ એમ નથી કે ક્લોરિનનો કોઈ પણ પરમાણુ અપૂર્ણાંક દળ ધરાવે છે. આનો અર્થ એમ થાય છે કે જો ચોક્કસ માત્રામાં ક્લોરિન લેવામાં આવે અને તેમાં ક્લોરિનના બંને સમસ્થાનિકોનો સમાવેશ થાય તો તેનું સરેરાશ પરમાણ્વીય દળ 35.5 1 હશે.
પ્રશ્ન 36. સમસ્થાનિકોના અનુપ્રયોગ જણાવો. [3 ગુણ]
ઉત્તર : એક જ તત્ત્વના તમામ સમસ્થાનિકોના રાસાયણિક ગુણધર્મો સમાન હોય છે.
→ અમુક સમસ્થાનિકો વિશિષ્ટ ગુણધર્મો ધરાવે છે, જેનો ઉપયોગ વિભિન્ન ક્ષેત્રોમાં થાય છે.
→ સમસ્થાનિકોના અનુપ્રયોગો નીચે મુજબ છેઃ
(1) પરમાણુ ભઠ્ઠીમાં બળતણ સ્વરૂપે યુરેનિયમના સમસ્થાનિકનો ઉપયોગ થાય છે. (2) કોબાલ્ટનો એક સમસ્થાનિક કૅન્સરની સારવારમાં વપરાય છે. (3) ગૉઇટર (Goitre) રોગની સારવારમાં આયોડિનના એક સમસ્થાનિકનો ઉપયોગ થાય છે.
4.6.1 સમદળીય
પ્રશ્ન 37. સમદળીય અથવા સમભારીય તત્ત્વો એટલે શું? [2 ગુણ]
ઉત્તર : જુદાં જુદાં તત્ત્વોના પરમાણુ કે જેમના પરમાણ્વીય ક્રમાંક અસમાન, પરંતુ પરમાણ્વીય દળાંક સમાન હોય તેવાં તત્ત્વોને સમદળીય અથવા સમભારીય તત્ત્વો કહે છે.
→ આ તત્ત્વો જુદાં જુદાં હોવાથી તેમના રાસાયણિક ગુણધર્મો જુદા જુદા હોય છે. માત્ર આ તત્ત્વોના પરમાણુઓમાં ન્યુક્લિઓન્સની કુલ સંખ્યા જ સમાન હોય છે.
સ્વાધ્યાયના પ્રશ્નોત્તર
(1) ઇલેક્ટ્રૉન, પ્રોટોન અને ન્યૂટ્રૉનના ગુણધર્મોની સરખામણી કરો. [3 ગુણ]
ઉત્તર :

(2) આ પ્રકરણમાં રજૂ થયેલા પરમાણુના નમૂનાઓની સરખામણી દર્શાવો. [3 ગુણ]
ઉત્તર : આ પ્રકરણમાં રજૂ થયેલા પરમાણુના નમૂનાની સરખામણી નીચે મુજબ છેઃ
(3) સિલિકોન અને ઑક્સિજનનાં ઉદાહરણો દ્વારા સંયોજકતા વ્યાખ્યાયિત કરો. [2 ગુણ]
ઉત્તર : 14Si : 2 K, 8 L, 4 M. આમ, સિલિકોનની બાહ્યતમ કક્ષામાં ચાર ઇલેક્ટ્રૉન છે. આથી અષ્ટક રચના પ્રાપ્ત કરવા ચાર ઇલેક્ટ્રૉનની ભાગીદારી કરશે.
8O : 2 K, 6 L. આમ, ઑક્સિજનની બાહ્યતમ કક્ષામાં છ ઇલેક્ટ્રૉન છે. આથી અષ્ટક રચના પ્રાપ્ત કરવા બે ઇલેક્ટ્રૉન મેળવશે અથવા ભાગીદારી કરશે.
આમ, કોઈ પણ તત્ત્વની બાહ્યતમ કક્ષામાં અષ્ટક રચના પૂર્ણ કરવા માટે ભાગીદારી કરતાં અથવા વિનિમય પામતા ઇલેક્ટ્રૉનની સંખ્યાને સંયોજકતા કહે છે.
હેતુલક્ષી પ્રશ્નોત્તર
પ્રશ્ન 1. નીચેના પ્રશ્નોના ટૂંકમાં ઉત્તર આપો : [પ્રત્યેકનો 1 ગુણ]
(1) પરમાણુ અવિભાજ્ય ન હોવાના સંકેત જણાવો.
ઉત્તર : પરમાણુ અવિભાજ્ય ન હોવાના સંકેત સ્થિર વિદ્યુત અને જુદા જુદા પદાર્થોની વિદ્યુતના વહનની પરિસ્થિતિ છે.
(2) કેનાલ કિરણો કયાં પ્રકારનાં વિકિરણો છે?
ઉત્તર : કેનાલ કિરણો ધન વીજભારિત વિકિરણો છે.
(3) પરમાણુમાં પ્રોટોન અને ઇલેક્ટ્રૉનનું સ્થાન જણાવો.
ઉત્તર : ૫૨માણુમાં પ્રોટોન કેન્દ્રમાં, જ્યારે ઇલેક્ટ્રૉન કેન્દ્રની બહાર કક્ષામાં પરિભ્રમણ કરે છે.
(4) પરમાણુનું બંધારણ સમજવા કયા કયા નમૂના રજૂ કરવામાં આવ્યા?
ઉત્તર : ૫૨માણુનું બંધારણ સમજવા (1) થોમસનનો પરમાણુ નમૂનો, (2) રુથરફોર્ડનો પરમાણુ નમૂનો અને (૩) નીલ્સ બોહ્રનો પરમાણુ નમૂનો એમ ત્રણ નમૂના રજૂ કરવામાં આવ્યા.
(5) થોમસનના મત મુજબ પરમાણુ શેનો બનેલો છે?
ઉત્તર : થોમસનના મત મુજબ પરમાણુ ધનભારિત ગોળાનો બનેલો છે અને તેમાં ઇલેક્ટ્રૉન જડિત થયેલા છે.
(6) કયા વૈજ્ઞાનિકોએ પરમાણુની વિભિન્ન કક્ષાઓમાં ઇલેક્ટ્રૉનની વહેંચણી સૂચવી?
ઉત્તર : બોહ્ર અને બરી નામના વૈજ્ઞાનિકોએ પરમાણુની વિભિન્ન કક્ષાઓમાં ઇલેક્ટ્રૉનની વહેંચણી સૂચવી.
પ્રશ્ન 2. વ્યાખ્યા આપો : [પ્રત્યેકનો 1 ગુણ]
( 1 ) પરમાણ્વીય ક્રમાંક ( 2 ) ૫૨માણ્વીય ( 3 ) સમસ્થાનિક ( 4 ) સ્થિર કક્ષા ( 5 ) સંયોજકતા દળાંક
ઉત્તર :
(1) પરમાણ્વીય ક્રમાંક : તત્ત્વના તટસ્થ પરમાણુમાં રહેલા પ્રોટોન અથવા ઇલેક્ટ્રૉનની સંખ્યાને પરમાણ્વીય ક્રમાંક કહે છે.
(2) પરમાણ્વીય દળાંક : તત્ત્વના પરમાણુકેન્દ્રમાં રહેલા પ્રોટોન (p) અને ન્યૂટ્રૉન(n)ની સંખ્યાના સરવાળાને પરમાણ્વીય દળાંક કહે છે.
(3) સમસ્થાનિક : એક જ તત્ત્વના જુદા જુદા પરમાણુઓ કે જેમના પરમાણ્વીય ક્રમાંક સરખા હોય, પરંતુ પરમાણ્વીય દળ જુદા જુદા હોય, તો તેવા પરમાણુઓને એકબીજાના સમસ્થાનિક કહે છે. (અથવા એક જ તત્ત્વના જુદા જુદા પરમાણુઓ કે જેમાં પ્રોટોનની સંખ્યા સમાન હોય, પરંતુ ન્યૂટ્રૉનની સંખ્યા જુદી જુદી હોય તેવા પરમાણુઓને એકબીજાના સમસ્થાનિક કહે છે.)
(4) સ્થિર કક્ષા : કોઈ પણ પરમાણુના ૫૨માણુકેન્દ્રની આસપાસની કક્ષા કે જેમાં ભ્રમણ કરતો ઇલેક્ટ્રૉન ઊર્જા ગુમાવતો ન હોય તે કક્ષાને સ્થિર કક્ષા કહે છે.
(5) સંયોજકતા : સંયોજકતા કક્ષામાંના અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યાને તે પરમાણુની સંયોજકતા કહે છે.
પ્રશ્ન 3. ખાલી જગ્યા પૂરોઃ [પ્રત્યેકનો 1 ગુણ]
(1) કોઈ પણ તત્ત્વના પરમાણુની બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યાને ……..કહે છે.
(2) ઑક્સિજનની સંયોજકતા …….. છે.
(3) …….. ના સમસ્થાનિકનો ઉપયોગ પરમાણુ ભઠ્ઠીમાં થાય છે.
(4) ગૉઇટરના રોગની સારવારમાં ……… એક સમસ્થાનિક ઉપયોગી છે.
(5) કોબાલ્ટનો એક સમસ્થાનિક ……… ની સારવારમાં વપરાય છે.
(6) સમસ્થાનિક તત્ત્વોમાં …….. ની સંખ્યા ભિન્ન હોય છે.
(7) પ્રોટોન અને ન્યૂટ્રૉનને …….. પણ કહે છે.
(8) M કોશમાં મહત્તમ ઇલેક્ટ્રૉનની સંખ્યા …….. છે.
(9) રુથરફોર્ડે -કણ પ્રકીર્ણનના પ્રયોગમાં ……… ધાતુનો વરખ પસંદ કર્યો.
(10) પરમાણુકેન્દ્રમાં રહેલા …….. કણો ધન વીજભાર ધરાવે છે.
ઉત્તર :
(1) સંયોજકતા
(2) 2
(3) યુરેનિયમ
(4) આયોડિન
(5) કૅન્સર
(6) ન્યૂટ્રૉન
(7) ન્યુક્લિઓન્સ
(8) 18
(9) સોના
(10) પ્રોટોન
પ્રશ્ન 4. નીચેનાં વિધાનો ખરાં છે કે ખોટાં તે જણાવો : [પ્રત્યેકનો 1 ગુણ]
(1) પ્રોટોન પરમાણુના અંદરના ભાગમાં રહેલા છે.
(2) પ્રોટોનનું દળ ઇલેક્ટ્રૉનના દળ કરતાં આશરે 2000 ગણું ઓછું હતું.
(3) પરમાણુમાંથી પ્રોટોન સહેલાઈથી દૂર કરી શકાય છે, પરંતુ ઇલેક્ટ્રૉન દૂર કરી શકાતો નથી.
(4) આલ્ફા કણો દ્વવીજભારિત ગતિશીલ હિલિયમ આયનો છે.
(5) પરમાણુની ત્રિજ્યા તેના કેન્દ્રની ત્રિજ્યા કરતાં 1075 ગણી ઓછી છે.
(6) ટ્રિટિયમના કેન્દ્રમાં 2 પ્રોટોન અને 2 ન્યૂટ્રૉન છે.
(7) પરમાણુનું દળ નક્કી કરવામાં ઇલેક્ટ્રૉનનો ફાળો નહિવત્ છે.
(8) જ્યારે ઇલેક્ટ્રૉન સ્વતંત્ર કક્ષાઓમાં પરિભ્રમણ કરે ત્યારે ઊર્જા મુક્ત કરે છે.
(9) સૌથી બહારની કક્ષામાં વધુમાં વધુ 10 ઇલેક્ટ્રૉન સમાવી શકાય છે.
(10) હાઇડ્રોજન, સોડિયમ અને લિથિયમની સંયોજકતા સમાન છે.
(11) હિલિયમ અને આર્ગોનની સંયોજકતા મહત્તમ છે.
(12) સમસ્થાનિક તત્ત્વોની રાસાયણિક પ્રક્રિયાઓ સમાન હોય છે.
(13) સમદળીય તત્ત્વોના પરમાણ્વીય ક્રમાંક અસમાન હોતા નથી.
(14) સમદળીય તત્ત્વોના પરમાણુઓમાં ન્યુક્લિઓન્સની કુલ સંખ્યા સમાન છે.
(15) ક્લોરિનનું સરેરાશ પરમાણ્વીય દળ 35.5 1 હોય છે.
ઉત્તર :
(1) ખરું
(2) ખોટું
(3) ખોટું
(4) ખરું
(5) ખોટું
(6) ખોટું
(7) ખરું
(8) ખોટું
(9) ખોટું
(10) ખરું
(11) ખોટું
(12) ખરું
(13) ખોટું
(14) ખરું
(15) ખરું
પ્રશ્ન 5. નીચેના દરેક પ્રશ્ન માટે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરી ઉત્તર લખો : [પ્રત્યેકનો 1 ગુણ)
1. વ-કણ શેના બનેલા છે?
A. 2 ઇલેક્ટ્રૉન અને 2 પ્રોટોન
B. 2 પ્રોટોન અને 2 ન્યુટ્રૉન
C. 2 ઇલેક્ટ્રૉન અને 2 ન્યૂટ્રૉન
D. હિલિયમ પરમાણુ
2. કોઈ પણ તત્ત્વના પરમાણુની બાહ્યતમ કક્ષામાં મહત્તમ કેટલા ઇલેક્ટ્રૉન સમાવી શકાય?
A. 2
B. 8
C. 18
D. 16
3. સમદળીય તત્ત્વોમાં …….. હોય છે.
A. સમાન સંખ્યામાં પ્રોટોન અને ઇલેક્ટ્રૉન
B. સમાન સંખ્યામાં પ્રોટોન અને ન્યુટ્રૉન
C. સમાન સંખ્યામાં ઇલેક્ટ્રૉન અને ન્યુટ્રૉન
D. સમાન સંખ્યામાં ન્યૂટ્રૉન
4. કૅલ્શિયમનો પરમાણ્વીય ક્રમાંક 20 છે. તે K, L, M અને N કક્ષાઓ ધરાવે છે, તો તેની કઈ કઈ કક્ષાઓ અપૂર્ણ ભરાયેલી હશે?
A. L, M, N
B. M, N
C. N
D. K, L, M, N
5. ક્લોરિન, આર્ગોન, પોટૅશિયમ, કૅલ્શિયમમાં ઇલેક્ટ્રૉનની સંખ્યા અનુક્રમે 17, 18, 19, 20 અને ન્યૂટ્રૉનની સંખ્યા 18, 22, 20, 20 છે, તો તત્ત્વની કઈ જોડ સમદળીય છે?
A. ક્લોરિન અને કૅલ્શિયમ
B. પોટૅશિયમ અને ક્લોરિન
C. આર્ગોન અને કૅલ્શિયમ
D. પોટૅશિયમ અને આર્ગોન
6. જ્યારે પરમાણુમાંથી આયન બને ત્યારે કયા અવપરમાણ્વીય કણની સંખ્યામાં ફેરફાર થાય છે?
A. પ્રોટોન
B. ન્યૂટ્રૉન
C. ઇલેક્ટ્રૉન
D. પ્રોટોન અને ન્યૂટ્રૉન
7. બાહ્યતમ કક્ષામાં રહેલા ઇલેક્ટ્રૉનની સંખ્યાને …… કહે છે.
A. સંયોજકતા ઇલેક્ટ્રૉન
B. અષ્ટક
C. દ્વિઅણુ
D. ન્યુક્લિઓન
8. હાઇડ્રોજન પરમાણુમાં કયો અવપરમાણ્વીય કણ હાજર નથી?
A. પ્રોટોન
B. ન્યૂટ્રૉન
C. નેગાટ્રોન
D. ઇલેક્ટ્રૉન
9. ગ્રેફાઇટમાં સંયોજકતા ઇલેક્ટ્રૉનની સંખ્યા જણાવો.
10. તત્ત્વ Xનો પરમાણ્વીય ક્રમાંક 3, જ્યારે તત્ત્વ Yનો પરમાણ્વીય ક્રમાંક 4 છે, તો આ તત્ત્વ Yની સંયોજકતા …….. છે.
A. 1
B. 2
C. 3
D. 4
11. નીચેના પૈકી કયો કણ પરમાણુના કેન્દ્રમાં નથી?
A. પ્રોટોન
B. ન્યૂટ્રૉન
C. ઇલેક્ટ્રૉન
D. આપેલ તમામ
ઉત્તર :
1. 2 પ્રોટોન અને 2 ન્યૂટ્રૉન
2. 8
3. સમાન સંખ્યામાં પ્રોટોન અને ન્યૂટ્રૉન
4. M, N
5. આર્ગોન અને કૅલ્શિયમ
6. ઇલેક્ટ્રૉન
7. સંયોજકતા ઇલેક્ટ્રૉન
8. ન્યૂટ્રૉન
9. 4
10. 2
11. ઇલેક્ટ્રૉન
મૂલ્યો આધારિત પ્રશ્નોત્તર (Value Based Questions with Answers)
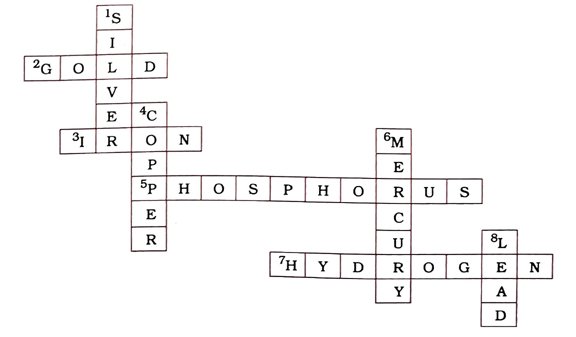
(1) નીચેના ક્રૉસવર્ડ પઝલમાં રાસાયણિક તત્ત્વોનાં નામ લખો :
આડી ચાવી : 2. α-કણ પ્રકીર્ણનના પ્રયોગમાં વપરાયેલું તત્ત્વ (4)
3. તત્ત્વ કે જે ભેજવાળી હવામાં ક્ષારણ પામે છે. (4)
5. સક્રિય અધાતુ તત્ત્વ કે જે પાણીમાં સંગ્રહવામાં આવે છે. (10)
7. ઝિંક તત્ત્વની સાંદ્ર હાઇડ્રોક્લોરિક ઍસિડ સાથે પ્રક્રિયા કરતાં ઉત્પન્ન થતો વાયુ (8)
ઊભી ચાવી : 1. સફેદ ચળકતી ધાતુ જે ઘરેણાં બનાવવા માટે વપરાય છે, ઉપરાંત ભેજવાળી હવામાં સહેજ કાળી પડે છે. (6)
4. ધાતુ કે જે પિત્તળ અને કાંસા જેવી મિશ્રધાતુની ઘટક છે. (6)
6. ઓરડાના તાપમાને પ્રવાહી સ્વરૂપની ધાતુ છે. (7)
8. ધાતુ કે જેની સંજ્ઞા Pb છે. (4)
ઉત્તર :
આડી ચાવી : 2. GOLD 3. IRON 5. PHOSPHORUS 7. HYDROGEN
ઊભી ચાવી : 1. SILVER 4. COPPER 6. MERCURY 8. LEAD
(2) એક તત્ત્વ Xનો પરમાણુ તેની M કક્ષામાં 7 ઇલેક્ટ્રૉન ધરાવે છે.
(a) તત્ત્વ X ની ઇલેક્ટ્રૉન-રચના લખો.
(b) તત્ત્વ X નો પરમાણ્વીય ક્રમાંક જણાવો.
(c) તત્ત્વ X ધાતુ છે કે અધાતુ તે જણાવો.
(d) તત્ત્વ X માંથી કેવા પ્રકારના આયનો બની શકે?
(e) તત્ત્વ X કયું હશે?
ઉત્તર :
(a) ઇલેક્ટ્રૉન-રચના : 2 K, 8 L, 7 M
(b) Z = 17
(c) અધાતુ તત્ત્વ
(d) ઋણ આયન (X)
(e) ક્લોરિન (Cl)
हमसे जुड़ें, हमें फॉलो करे ..