NCERT Solutions Class 9Th Science Chemistry – परमाणु की संरचना
NCERT Solutions Class 9Th Science Chemistry – परमाणु की संरचना
अतिलघु उत्तरीय प्रश्नोत्तर
परमाणु की संरचना
1. परमाणु के नाभिक की खोज किसने की ?
उत्तर – लॉर्ड रदरफोर्ड ।
2. किसी परमाणु के मूलभूत कणों (अवपरमाणुक) के नाम क्या हैं ?
उत्तर – परमाणु के मूलभूत कणों के नाम प्रोटॉन, इलेक्ट्रॉन तथा न्यूटॉन हैं।
3. पदार्थों का परमाण्विक सिद्धांत का प्रतिपादन किसने किया है ?
उत्तर – जॉन डॉल्टन |
4. रेडियोऐक्टिविटी की खोज किसने की ?
उत्तर – हेनरी बैकेरल ।
5. उस वैज्ञानिक का नाम लिखें जिसने रेडियोऐक्टिवता की परिघटना की खोज की।
उत्तर – हेनरी बैकेरल |
6..किसी इलेक्ट्रॉन का निरपेक्ष द्रव्यमान तथा निरपेक्ष आवेश कितना होता है ?
उत्तर – (i) उत्तर इलेक्ट्रॉन का निरपेक्ष द्रव्यमान = 9.109 × 10-31 kg,
(ii) इलेक्ट्रॉन का निरपेक्ष आवेश = 1.602 × 10-19 कूलॉम ।
7. इलेक्ट्रॉन के आवेश के मान का निश्चय किसने किया ?
उत्तर – राबर्ट ए० मिलिकन ने।
8. इलेक्ट्रॉन का आविष्कार किसने किया ?
उत्तर – जे० जे० टॉमसन ।
9. प्रोटॉन का आविष्कार किसने किया ?
उत्तर – ई० गोल्डस्टीन ।
10. न्यूट्रॉन का आविष्कार कब और किसने किया ?
उत्तर – 1932 ई० में जे० चैडविक ने किया ।
11. एनोड किरण किस प्रकार के कणों से बनी है ?
उत्तर – प्रोटॉन ।
12. इलेक्ट्रॉन पर आवेश का मान बताएँ।
उत्तर – इलेक्ट्रॉन पर ऋण आवेश का 1.6 × 10-19 कूलॉम होता है ।
13. इलेक्ट्रॉन पर आवेश की प्रकृति क्या होती है ?
उत्तर – इलेक्ट्रॉन पर आवेश ऋणात्मक होता है।
14. न्यूट्रॉन के अस्तित्व को किसने प्रस्तावित किया ?
उत्तर – रदरफोर्ड ने।
15. प्रायोगिक रूप से न्यूट्रॉन की खोज किसने की ?
उत्तर – जेम्स चैडविक ने।
16. सर्वप्रथम इलेक्ट्रॉन के आवेश को किसने मापा था ?
उत्तर – रॉबर्ट ए० मिलकेन ने।
17. रेडियो तरंगों, X- किरणों, पराबैंगनी किरणों, दृश्य किरणों और अवरक्त किरणों के तरंगदैध्यों को बढ़ते क्रम में व्यवस्थित करके लिखें।
उत्तर – X- किरणें, पराबैंगनी किरणें, दृश्य किरणें, अवरक्त किरणें तथा रेडियो तरंगें ।
18. कैथोड किरणें किन कणों से मिलकर बनी है ?
उत्तर – अत्यंत सूक्ष्म द्रव्यमान युक्त उच्च वेग वाले कणों से मिलकर बनी है।
19. L कोश में अधिकतम इलेक्ट्रॉनों की संख्या कितनी होती है ?
उत्तर – 8.
20. सोडियम (11) का इलेक्ट्रॉनिक विन्यास लिखें।
उत्तर – 2, 8, 1.
21. उन कणों के नाम लिखें जो किसी परमाणु के द्रव्यमान को निर्धारित करते हैं।
उत्तर – प्रोटॉन तथा न्यूटॉन ।
22. समस्थानिकों में कौन समान और कौन असमान होते हैं ?
उत्तर – परमाणु संख्या समान एवं द्रव्यमान संख्या असमान ।
23. Cl आयन में संयोजकता – इलेक्ट्रॉनों की संख्या कितनी है ?
उत्तर – Cl आयन में संयोजकता – इलेक्ट्रॉनों की संख्या 8 है।
24. बोर सिद्धांत के अनुसार किसी भी कोश में इलेक्ट्रॉनों की अधिकतम संख्या कितनी हो सकती है ?
उत्तर – किसी भी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 2n 2 हो सकती है, जहाँ n = कोश की संख्या ।
25. प्रोटॉन के द्रव्यमान के बराबर उस उदासीन कण का नाम बताएँ जो नाभिक में रहता है।
उत्तर – उस उदासीन कण को न्यूट्रॉन कहते हैं ।
26. किसी परमाणु के तृतीय कक्ष में अधिकतम इलेक्ट्रॉनों की संख्या कितनी होती है ?
उत्तर – 18 इलेक्ट्रॉन ।
27. विसर्जन नलिका में कैथोड से उत्सर्जित कण धन प्लेट की ओर झुकते हैं । कण की प्रकृति बताएँ ।
उत्तर – कण की प्रकृति विद्युत ऋणात्मक है।
28. किसी तत्त्व के समस्थानिकों में किसमें समानता है ?
उत्तर – किसी तत्त्व के समस्थानिक में प्रोटॉनों तथा इलेक्ट्रॉनों की संख्या समान होती है।
29. किसी परमाणु के बाह्यतम कोश में उपस्थित इलेक्ट्रॉन किस नाम से पुकारे जाते हैं।
उत्तर – संयोजकता इलेक्ट्रॉन ।
30. हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे ?
उत्तर – दो न्यूट्रॉन होंगे।
31. रदरफोर्ड का अल्फाकण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था?
उत्तर – परमाणु केन्द्रक ।
32. हाइड्रोजन परमाणु में कौन-सा कण नहीं होता है ?
उत्तर – न्यूट्रॉन।
33. उस समस्थानिक का नाम बताएँ जिसका उपयोग घेंघा रोग के इलाज में किया जाता है।
उत्तर – आयोडीन के समस्थानिक का उपयोग होता है।
लघु उत्तरीय प्रश्नोत्तर
1. केनाल किरणें क्या हैं ?
उत्तर – 1886 ई० में गोल्डस्टीन ने धनावेशित विकिरण की खोज की, जिनका नाम उन्होंने ‘केनाल किरणें’ दिया ।
2. यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं ?
उत्तर – कोई आवेश नहीं होगा क्योंकि प्रोटॉन का आवेश + 1 इलेक्ट्रॉन के आवेश – 1 विपरीत तथा बराबर है।
3. किसी तत्त्व का इलेक्ट्रॉनिक विन्यास उसकी संयोजकता से किस प्रकार संबंधित है ?
उत्तर – किसी तत्त्व की संयोजकता उस तत्त्व के संयोजकता इलेक्ट्रॉनों की संख्या के बराबर होती है, या (8- संयोजकता इलेक्ट्रॉन) की संख्या के बराबर होती है।
4. रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सी अवपरमाणुक कण विद्यमान है ?
उत्तर – प्रोटॉन (धनावेशित) होता है।
5. कक्षा या शेल क्या है ?
उत्तर – इलेक्ट्रॉन जिन वृत्ताकार पथों पर चक्कर काटता हैं उन्हें कक्षा कहते है। इन कक्षाओं को K, L, M, N, O, P अक्षरों से सूचित किया जाता है। प्रत्येक शेल में इलेक्ट्रॉनों की संख्या 2n2 होती है, जहाँ n कक्षा की संख्या है।
6. उपकक्षा या सबशेल क्या है ?
उत्तर – प्रत्येक कक्षा में कई उपकक्षाएँ होती हैं जिसे s, p, d, f अक्षर द्वारा सूचित किया जाता है। s–उपकक्षा में अधिकतम 2, p में 6, d में 10 और f में 14 इलेक्ट्रॉन रह सकते है ।
7. परमाणु का नाभिक क्या है ?
उत्तर – परमाणु का लगभग संपूर्ण द्रव्यमान एवं संपूर्ण धन आवेश, परमाणु के केंद्र में संचित रहता है। इस केंद्र को नाभिक कहते हैं। नाभिक का आयतन परमाणु के संपूर्ण आयतन की अपेक्षा नगण्य होता है।
8. परमाणु आवेश उदासीन क्यों होता है ?
उत्तर – प्रत्येक प्रोटॉन पर +1 आवेश तथा प्रत्येक इलेक्ट्रॉन पर -1 आवेश होता है। परमाणु में प्रोटॉनों की संख्या, इलेक्ट्रॉनों की संख्या के बराबर होने के कारण कुल धन आवेश, कुल ऋण आवेश के बराबर होता है। इसी कारण परमाणु आवेश उदासीन होता है।
9. जे० जे० टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर – जे० जे० टॉमसन के परमाणु संरचना मॉडल ने परमाणु की उदासीन प्रकृति की भली-भाँति व्याख्या दी, परंतु अन्य वैज्ञानिकों द्वारा किए गए प्रयोगों के निष्कर्षों को यह मॉडल नहीं दर्शा पाया ।
10. द्रव्यमान संख्या से क्या समझते हैं ?
उत्तर – किसी तत्त्व का द्रव्यमान संख्या, उसके परमाणु में उपस्थित प्रोटॉनों एवं न्यूट्रॉनों की संख्या के योग के बराबर होती है। यह एक पूर्णांक संख्या है जिसका मान उस तत्त्व के परमाणु द्रव्यमान के निकटतम होता है।
11. संयोजकता से क्या समझते हैं ?
उत्तर – किसी परमाणु से संयोग करने की क्षमता को संयोजकता कहते है l
12. संयोजी इलेक्ट्रॉन क्या है ?
उत्तर – किसी भी परमाणु के बाह्यतम कक्षा में उपस्थित इलेक्ट्रॉन को संयोजी इलेक्ट्रॉन कहते हैं। जैसे- क्लोरीन का इलेक्ट्रॉनिक विन्यास 2, 8, 7 है,
अतः संयोजी इलेक्ट्रॉन = बाह्यतम कक्षा में उपस्थित इलेक्ट्रॉन = 7 है।
16. क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा ?
उत्तर – सोना सर्वाधिक अघातवर्ध्य धातु है, और इसीलिए a कणों के प्रथम तल के परमाणुओं से टकराने की संभावना अधिक होती है। साथ ही, सोना सबसे कम क्रियाशील धातु है। यदि सोने के अलावा किसी अन्य धातु का उपयोग किया जाए, तो हो सकता है कि वो धातु a कणों के साथ अभिक्रिया करे, अथवा धातु के कम अघातवर्ध्य होने के कारण a कण उसकी मोटी पन्नी के परमाणुओं से टकरा न पाएँ ।
17. न्यूट्रॉन के संबंध में प्रस्तावित रदरफोर्ड के क्या विचार थे ? इस कण का नाम न्यूट्रॉन किसने दिया ?
उत्तर – सन् 1920 ई० में रदरफोर्ड ने प्रस्तावित किया कि परमाणु के नाभिक में इलेक्ट्रॉन व प्रोटॉन अपने उच्च स्थिर विद्युत आकर्षण के कारण व एक दूसरे से आपस में इतना करीब होंगे कि इनको एक ही कण माना जाए और इसका कुल आवेश शून्य होगा। इसने इसका नाम न्यूट्रॉन दिया। इस कण का नाम न्यूट्रान चैडविक ने दिया।
18. परमाणु के नाभिक की खोज किसने और कैसे की ?
उत्तर – लार्ड रदरफोर्ड ने परमाणु के नाभिक की खोज की। रदरफोर्ड ने सोने की एक अत्यंत पतली पन्नी पर – कणों द्वारा बमबारी की और इस पन्नी द्वारा x कणों के प्रकीर्णन का अध्ययन किया। इस प्रयोग के परिणामों के आधार पर रदरफोर्ड इस निष्कर्ष पर पहुँचे कि इन कणों में से अधिकांश कण बिना विचलित हुए पन्नी के आरपार चले जाते हैं। इसका अर्थ यह है कि इन कणों को विचलित करने वाले धनात्मक आवेश परमाणु के आंतरिक भाग में अत्यंत कम जगह में ही विद्यमान हैं। इसी केंद्र का नाम रदरफोर्ड रखा |
19. परमाणु की संरचना को समझने में ई० रदरफोर्ड के क्या-क्या आधारभूत योगदान हैं ? स्पष्ट करें।
उत्तर – परमाणु की संरचना को समझने में ई० रदरफोर्ड के आधारभूत योगदान निम्नांकित है –
(i) प्रत्येक तत्त्व के परमाणु के अंदर उसके केंद्र में सूक्ष्म नाभिक पाया जाता है।
(ii) इस नाभिक पर धनात्मक आवेश विद्यमान होता है।
(iii) परमाणु का संपूर्ण भार सामान्यतः उसके इसी नाभिक पर केंद्रित होता है।
आंकिक प्रश्नोत्तर
1. यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(i) परमाणु की परमाणुक संख्या क्या है ?
(ii) परमाणु का क्या आवेश है ?
उत्तर – (i) परमाणु संख्या = प्रोटॉनों की संख्या = 8
(ii) प्रोटॉनों की संख्या = 8
धनात्मक आवेश = 8
इलेक्ट्रॉनों की संख्या = 8
ऋणात्मक आवेश = 8
कुल आवेश = + 8 – 8 = 0
2. हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन हैं। उसमें कितने न्यूट्रॉन हैं ?
उत्तर –

3. किसी तत्व के परमाणु में 11 इलेक्ट्रान और 12 न्यूट्रॉन हैं । तत्व का परमाणु क्रमांक और परमाणु द्रव्यमान निकालें ।
उत्तर –परमाणु संख्या = प्रोटॉन की संख्या = इलेक्ट्रॉन की संख्या = 11
परमाणु द्रव्यमान = प्रोट्रॉन की संख्या + न्यूट्रॉन की संख्या
= 11 + 12 = 23
4. एक तत्व की द्रव्यमान संख्या 23 है। उसमें 11 इलेक्ट्रॉन हैं। उसमें प्रोट्रॉनों और न्यूट्रानों की संख्या क्या है ? तत्व की परमाणु संख्या ज्ञात करें।
उत्तर – प्रोटॉन की संख्या = इलेक्ट्रॉन की संख्या = 11
परमाणु द्रव्यमान = प्रोट्रॉन की संख्या + न्यूट्रॉन की संख्या
23 = 11 + न्यूट्रॉन की संख्या
न्यूट्रॉन की संख्या = 23 – 11 = 12
परमाणु संख्या = प्रोट्रॉन की संख्या = 11
5. एक तत्व का परमाणु क्रमांक बताएँ जिसका परमाणु द्रव्यमान 23 है और उसके नाभिक में 12 न्यूट्रॉन हैं ।
उत्तर – परमाणु द्रव्यमान = p + n
23 = p + 12
p = 23 – 12 = 11
परमाणु क्रमांक = प्रोट्रॉन की संख्या = 11
6. एक तत्व का परमाणु क्रमांक 11 और परमाणु द्रव्यमान 23 है | तत्व के परमाणु में प्रोटॉन, इलेक्ट्रान तथा न्यूट्रॉन की संख्या ज्ञात करें।
उत्तर – प्रोट्रॉन की संख्या = परमाणु संख्या = 17
इलेक्ट्रॉन की संख्या = परमाणु संख्या = 11
न्यूट्रॉन की संख्या = परमाणु द्रव्यमान – प्रोट्रॉन की संख्या
= 23 – 11 = 12
7. किसी तत्व के परमाणु में 5 प्रोट्रॉन, 5 इलेक्ट्रॉन और 5 न्यूट्रॉन हैं। उनकी परमाणु संख्या, द्रव्यमान संख्या, इलेक्ट्रॉनिक विन्यास, कोर इलेक्ट्रॉन एवं संयोजकता लिखें ।
उत्तर – प्रोटॉन की संख्या = परमाणु संख्या = 5
परमाणु द्रव्यमान = p + n = 5 + 5 = 10
इलेक्ट्रॉनिक विन्यास = 2, 3
कोर इलेक्ट्रान = 5 (2, 8, 5)
तत्व की संयोजकता = 3
8. किसी तत्त्व का परमाणु क्रमांक तथा परमाणु द्रव्यमान क्रमशः 17 तथा 35 हैं। इसके परमाणु के नाभिक में उपस्थित प्रोटॉनों तथा न्यूट्रॉनों की संख्या बताएँ ।
उत्तर – परमाणु संख्या = प्रोट्रॉन की संख्या = 17
न्यूट्रॉन की संख्या = परमाणु द्रव्यमान – प्रोट्रॉन की संख्या
= 35 – 17 = 18
9. किसी तत्व का परमाणु क्रमांक 15 और परमाणु द्रव्यमान 31 है। इसके परमाणु में उपस्थित प्रोट्रॉनों, न्यूट्रॉनों व संयोजकता इलेक्ट्रानों की संख्या बताएँ तथा तत्व की संयोजकता लिखें ।
उत्तर – प्रोटॉन की संख्या = परमाणु संख्या = 15
न्यूट्रॉन की संख्या = परमाणु द्रव्यमान – प्रोट्रॉन की संख्या
= 31 – 15 – 16
संयोजकता इलेक्ट्रान = 5 (2,8, 5)
तत्व की संयोजकता = 3 या 5
10. किसी परमाणु के नाभिक में 15 इलेक्ट्रॉन तथा 16 न्यूट्रॉन हैं। परमाणु का इलेक्ट्रॉनिक विन्यास, संयोजकता इलेक्ट्रॉनों की संख्या, परमाणु क्रमांक तथा परमाणु द्रव्यमान लिखें।
उत्तर – इलेक्ट्रनिक विन्यास = 2, 8, 5
संयोजकता इलेक्ट्रॉन = 5
परमाणु क्रमांक = इलेक्ट्रॉन की संख्या = 15
परमाणु द्रव्यमान = p + n
= 15 + 16 = 31
13. मरकरी का परमाणु क्रमांक 80 और परमाणु द्रव्यमान 200 है, तो उसमें इलेक्ट्रॉन की संख्या, प्रोट्रॉन की संख्या तथा न्यूट्रॉन की संख्या ज्ञात करें।
उत्तर – इलेक्ट्रॉन की संख्या = परमाणु संख्या = 80
प्रोट्रॉन की संख्या = परमाणु संख्या = 80
न्यूट्रॉन की संख्या = परमाणु द्रव्यमान – प्रोट्रॉन की संख्या
= 200 – 80 = 120
दीर्घ उत्तरीय प्रश्नोत्तर
1. समस्थानिकों की परिभाषा दें। इसके मुख्य अभिलक्षण एवं अनुप्रयोग लिखें।
उत्तर – वैसे तत्त्व जिनकी परमाणु संख्या समान, लेकिन द्रव्यमान संख्या अलग-अलग होती है, समस्थानिक कहलाते हैं ।

समस्थानिकों के मुख्य अभिलक्षण –
(i) तत्त्वों के सभी समस्थानिकों के नाभिक के अन्दर प्रोटॉन की संख्या समान होती है।
(ii) तत्त्वों के सभी समस्थानिकों के नाभिक के अन्दर न्यूट्रॉन की संख्या असमान होती है।
(iii) किसी तत्त्व के सभी समस्थानिकों की रासायनिक अभिक्रिया समान होती है।
समस्थानिकों के अनुप्रयोग –
(i) यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी में ईंधन के रूप में होता है।
(ii) कैंसर के इलाज में कोबाल्ट के समस्थानिक का उपयोग होता है।
(iii) घेंघा रोग के इलाज में आयोडीन के समस्थानिक का उपयोग होता है।
2. रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर – रदरफोर्ड के परमाण्विक मॉडल की मुख्य कमी यह थी कि इससे परमाणु के स्थायित्व का पता नहीं चलता।
जब कोई आवेशित कण त्वरित होता है, तो वो ऊर्जा को विकिरित करता है। विकिरण के इस उत्सर्जन द्वारा इलेक्ट्रॉन में ऊर्जा की कमी होगी, जिसके कारण उसकी कक्षा के आकार का संकुचन होगा । फलस्वरूप, कुछ ही समय में इलेक्ट्रॉन नाभिक से टकरा जाएगा। रदरफोर्ड यह नहीं समझा पाए कि वास्तव में ऐसा क्यों नहीं होता ।
3. बोर के परमाणु मॉडल की व्याख्या करें ।
उत्तर – डैनिश वैज्ञानिक नील्स बोर ने 1912 ई० में एक परमाण्विक मॉडल प्रस्तावित किया, जिसे बोर परमाण्विक मॉडल कहा जाता है। बोर परमाण्विक मॉडल की मूल अवधारणाएँ इस प्रकार हैं –
(i) एक परमाणु में इलेक्ट्रॉन नाभिक के इर्द-गिर्द एक निश्चित चक्रीय पथ पर घूमते हैं। ये चक्रीय पथ इलेक्ट्रॉन कक्ष या ऑर्बिट कहलाते हैं। इन्हें ऊर्जा स्तर भी कहते हैं ।
(ii) प्रत्येक इलेक्ट्रॉन कक्ष एक निश्चित ऊर्जा से युक्त होता है।
(iii) इलेक्ट्रॉन कक्ष या ऊर्जा स्तरों को अंकित करते हैं। ये पूर्णांक 1.2.3.4 हैं । 1.2.3…… या K.L.M………………आदि से …… को कक्षा की क्वान्टम संख्या कहते है।
(iv) एक इलेक्ट्रॉन केवल निश्चित व आवश्यक ऊर्जा को खो सकता है या प्राप्त कर सकता है।
4. रदरफोर्ड के प्रयोग के वर्णन द्वारा स्पष्ट करें कि परमाणु के केन्द्र में धन आवेशित कण है तथा परमाणु का संपूर्ण द्रव्यमान उसके नाभिक में केंद्रित रहता है।
उत्तर – 1911 ई० में रदरफोर्ड ने सोने के पतले पत्तर पर a- कणों का आधात कर निम्नांकित निरीक्षण किया –
(i) अधिकांश – कण, सोने के पत्तर से होकर अपने पूर्व पथ से सीधे निकल जाते हैं। I
(ii) कुछ a – कण बड़े कोण से एवं अन्य कुछ छोटे कोण से विचलित होते हैं ।
(iii) बहुत ही कम – कण जिस दिशा से जाते हैं, इसके विपरीत दिशा में लौट आते हैं ।

नाभिक के निकट से गुजरनेवाले धन आविष्ट a- कण का विचलित होना इस बात को प्रमाणित करता है कि परमाणु के नाभिक में धन आविष्ट कण, प्रोट्रॉन है।
(iv) चूँकि अधिकांश – कण सीधे निकल जाते हैं, अतः परमाणु का अधिकांश खोखला है और उसका संपूर्ण द्रव्यमान, उसके नाभिक में केंद्रित रहता है।
5. रदरफोर्ड का नाभिकीय सिद्धांत लिखें।
उत्तर – रदरफोर्ड ने सोने के पत्तर पर α – कण का आधात कर परमाणु के बारे में निम्नांकित निष्कर्ष निकाला जिसे रदरफोर्ड का नाभिकीय सिद्धांत कहते हैं।
(i) परमाणु गोलाकार होता है।
(ii) परमाणु का अधिकांश भाग खाली होता है।
(iii) परमाणु का संपूर्ण धन-आवेश एवं लगभग संपूर्ण द्रव्यमान परमाणु के केंद्र में केंद्रित रहता है जिसे नाभिक कहते हैं ।
(iv) नाभिक का आयतन, परमाणु के कुल आयतन की तुलना में नगण्य होता है।
(v) परमाणु में उपस्थित इलेक्ट्रॉन (ऋण आवेश) की संख्या धन आविष्ट प्रोटॉन की संख्या के बराबर होता है । फलतः परमाणु उदासीन होता है।
(vi) इलेक्ट्रॉन, नाभिक के चारों ओर वृत्ताकार पथों में तीव्र वेग से परिक्रमा करते रहते है। इन पथों को कक्षा कहते हैं ।
(vii) इलेक्ट्रॉन के वेग से उत्पन्न केंद्रापसारी बल, नाभिक और इलेक्ट्रॉन के बीच विद्युतीय आकर्षण बल को संतुलित करता है जिससे इलेक्ट्रॉन, नाभिक में नहीं गिरता है।
6. रदरफोर्ड के नाभिकीय सिद्धांत में क्या दोष पाये गये ? इन दोषों को बोर सिद्धांत द्वारा किस प्रकार दूर किया गया ?
उत्तर – रदरफोर्ड के सिद्धांत के निम्नांकित दोष हैं-
(i) रदरफोर्ड के अनुसार इलेक्ट्रॉन, नाभिक के चारों ओर चक्कर लगाते हैं। विद्युत चुंबकीय सिद्धांत से चक्कर लगानेवाले ऋण आवेशित इलेक्ट्रॉन की ऊर्जा का हास होता जाएगा। जिससे इसकी कक्षा की त्रिज्या छोटी होती जाएगी और अंत में इलेक्ट्रॉन नाभिक में गिर जाएगा। लेकिन ऐसी बात नहीं हो पाती है।
(ii) रदरफोर्ड ने कक्षा में इलेक्ट्रॉनों की संख्या निश्चित नहीं किया ।
7. परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट करें।
उत्तर – 1899 में टॉमसन ने प्रस्तावित किया कि-
(i) परमाणु एक धनात्मक क्षेत्र से बना है जिसमें ऋणात्मक कण इलेक्ट्रॉन यहाँ-वहाँ बिखरे हुए हैं।
(ii) परमाणु के धनात्मक और ऋणात्मक आवेश एक-दूसरे को संतुलित अथवा काट देते हैं, इसीलिए परमाणु उदासीन होता है।
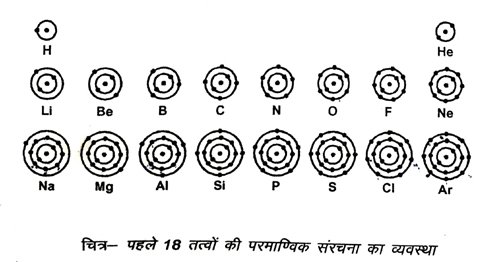
8. पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखें।
उत्तर – किसी परमाणु में विभिन्न ऊर्जा स्तरों (इलेक्ट्रॉन कक्षों) में इलेक्ट्रॉनों के वितरण के लिए बोर तथा बरी योजना निम्न नियमों पर आधारित है –
(i) किसी कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या 2n 2 हो सकती है, जहाँ n इलेक्ट्रॉन कक्षों की क्वान्टम संख्या को प्रदर्शित करता है।
अतः विभिन्न कक्षों में इलेक्ट्रॉनों की अधिकतम संख्या निम्न है –
प्रथम (K) कक्ष = 2 × 12 = 2
द्वितीय (L) कक्ष = 2 x 22 = 8
तृतीय (M) कक्ष = 2 x 32 = 18
चतुर्थ (N) कक्ष = 2 x 42 = 32
(ii) बाह्यतम कक्ष (जिसे संयोजकता कक्ष भी कहते हैं) मैं अधिकतम 8 इलेक्ट्रॉन हो सकते हैं और उससे पूर्व वाले कक्ष में अधिकतम 18 इलेक्ट्रॉन हो सकते
हैं ।
(iii) यह आवश्यक नहीं है कि किसी कक्ष में इलेक्ट्रॉनों की संख्या उससे अग्रिम कक्ष में इलेक्ट्रॉन भरने से पूर्ण हो जाए।
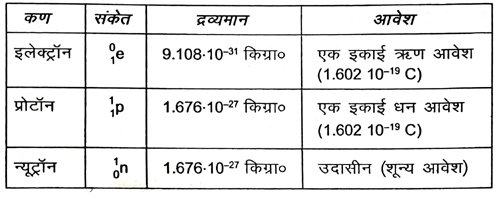
9. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना करें।
उत्तर –
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here